2. 吉林农业科技学院,吉林 132000
2. Jilin Agriculture Science and Technology College, Jilin 132000
“桑黄”类真菌是一类具有重要药用价值的大型真菌,又被称为桑臣、桑耳、胡孙眼等,始记于中药学专著《神农本草经》中,名为“桑耳”。民间用于治疗血淋、血崩、带下、闭经、脱肛泻血、脱脾泄泻等症[1]。“桑黄”类真菌的现代医学研究表明其热水提取物对小鼠肉瘤180抑制率为96.7%,而对正常细胞没有毒性[2]。此外,“桑黄”类真菌还具有抗菌、抗氧化、抗肝纤维化、增强免疫等作用,民间多用“桑黄”类真菌水煎液来辅助防癌和抗癌治疗[3]。本研究选用民间作为“桑黄”类真菌用药的火木层孔菌(Phellinus igniarius(L.:Fr.)Quél.)、鲍姆木孔菌(Phellinus baumii Pilát,Bull.)、瓦尼木层孔菌(Phellinus vaninii Ljub.)、粗毛纤孔菌[Inonotus hispidus(Bull.:Fr.)P. Karst.]以及山野木层孔菌[Phellinus yamanoi(Tamz.)Shaw.]等6种药用真菌为实验材料[4],对它们的水提物进行体内抗肿瘤活性研究,并对其抑瘤机理进行了初步探讨,旨在为“桑黄”类真菌的进一步开发提供理论依据。
1 材料与方法 1.1 材料 1.1.1 六种“桑黄”类真菌子实体粗毛纤孔菌Inonotus hispidus(Bull.:Fr.)P. Karst.、火木层孔菌Phellinus igniarius(L.:Fr.)Quél.、鲍姆木孔菌Phellinus baumii Pilát,Bull.、瓦尼木层孔菌Phellinus vaninii Ljub.以及山野木层孔菌Phellinus yamanoi(Tamz.)Shaw.子实体均采自吉林省长白山,经吉林农业大学图力古尔教授鉴定。标本均保存于吉林农业大学菌物研究所标本馆(标本号分别为:HMJAU-4588,HMJAU-5220,HMJAU-6666,HMJAU-4208,HMJAU-22217)。椭圆嗜蓝孢孔菌Fomitiporia ellipsoidea B.K. Cui & Y.C. Dai采自福建万木林自然保护区,经崔宝凯教授和戴玉成教授鉴定,标本保存于吉林农业大学菌物研究所标本馆(标本号为:HMJAU-22698)。
1.1.2 实验动物昆明种小鼠150只,雌性,体重18-22g,购自吉林大学实验动物中心;腹水型H22荷瘤小鼠购自吉林省肿瘤医院。
1.1.3 试剂及仪器环磷酰胺(江苏恒瑞医药服份有限公司);小鼠IL-2试剂盒(博士德生物工程有限公司);生理盐水(长春豪邦药业有限公司);吐温-80;电热高压灭菌锅(上海博迅实业有限公司);DAB染色剂(购于博士德生物制品有限公司);SABC Kit(购于博士德生物制品有限公司);一抗(Rabbit anti-VEGF)(购于博士德生物制品有限公司)(1:100稀释);PBS溶液(PH 7.4);4%多聚甲醛(购于博士德生物制品有限公司);迈新S-P A\B\C\D液;氨水;苏木素;二甲苯;离心机(TGL-16B上海安亭科学仪器厂);酶标仪(美国Spectra公司);电子天平(SHIMADZU-AUY220型);离心机(SORVALL);酶标仪(Multiskan),FDU-1200型冻干机(东京理化器械株式会社);生物超净工作台(BCN-1360北京东联哈尔仪器制造有限公司)。
1.2 方法 1.2.1 药物的配置阳性药:环磷酰胺(CTX)浓度为20 mg/kg。阴性药:生理盐水(20 mg/kg)。受试药:六种“桑黄”类真菌子实体干燥后粉碎并称取0.5 kg采用连续回流提取法,用水100℃回流提取,提取3次,每次8 h,合并提取液,减压浓缩,置干净的蒸发皿中,于冻干机中冻干,计算得率。获得6种“桑黄”类真菌子实体的水提取物,每个受试药均用生理盐水配制,高低剂量浓度为(1 000 mg/kg,500 mg/kg)。
1.2.2 荷瘤小鼠模型制备取接种7 d、生长良好的腹水型H22荷瘤小鼠,无菌抽提腹水,用生理盐水稀释至浓度为1×106个/mL的细胞悬液,以每鼠0.1 mL接种于140只小鼠右后腋皮下。
1.2.3 实验动物分组及给药方式150只小鼠分为15组,给药组12组,阴性组,阳性组和空白组各一组。除空白组外,其他组均需要移植肿瘤细胞。小鼠造模24 h后,阳性组腹腔注射环磷酰胺(20 mg/kg)。对照组给予生理盐水灌胃,各受试组均为灌胃给药,各组给药体积均为0.2 mL/10 g,连续给药10 d。
1.2.4 抑瘤率、脾指数和胸腺指数检测移植肿瘤细胞小鼠末次给药24 h后(即第11天),摘眼球取血后处死小鼠,摘取瘤块、脾脏和胸腺,分别称重,计算抑瘤率、脾指数、胸腺指数[5]。
肿瘤抑制率=(对照组平均瘤重-给药组平均瘤重)/对照组平均瘤重×100%
脾指数=脾的重量(mg)/体重(g);胸腺指数=胸腺的重量(mg)/体重(g)
1.2.5 白细胞介素2(IL-2)含量检测第11天小鼠摘眼球取血0.5-1.0 mL。将血液离心(9 800 r/min,10 min),取血清待测IL-2含量。采用ELISA酶联免疫检测法测定小鼠血清中IL-2含量,按照试剂盒说明书进行操作。血清中IL-2含量:根据标准品OD值的标准曲线,计算各组小鼠血清中IL-2的含量。
1.2.6 肿瘤病例切片的制备HE染色药品的配置、肿瘤的固定、脱水和透明、浸蜡、包埋、修蜡、切片及展片、脱蜡及染色、培养肿瘤细胞免疫组化流程、肿瘤细胞标本进行染色观察、石蜡切片免疫组化流程等[6]。
1.2.7 统计数据的处理数据采用SPSS18.0统计软件进行处理,实验数据采用(x±s)表示。P < 0.05说明在统计学上呈显著差异,P < 0.01说明在统计学上呈极显著差异。
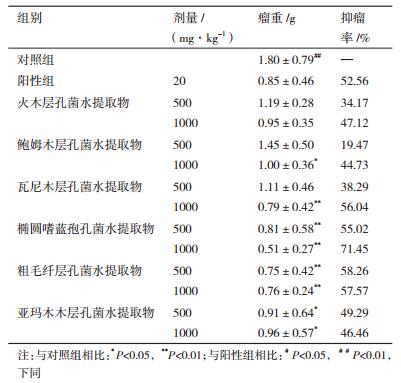
2 结果 2.1 六种“桑黄”类真菌的水提取物对H22荷瘤小鼠的抑制作用“桑黄”类真菌体内抑瘤作用结果如表 1所示,粗毛纤孔菌、椭圆嗜蓝孢孔菌、山野木层孔菌的水提取物高、低剂量组以及火木层孔菌、鲍姆木孔菌、瓦尼木层孔菌的水提取物高剂量组对肿瘤均具有较好的抑制作用,抑瘤率均大于40%,其中椭圆嗜蓝孢孔菌水提取物高剂量组(1 000 mg/kg)的抑瘤效果最佳,其抑瘤率为71.45%,比阳性组的抑瘤率(52.56%)高。而鲍姆木孔菌水提取物的抑瘤效果不明显,抑瘤率为19.47%。“桑黄”类真菌的水体液肿瘤图见图 1。

|
| 图 1 “桑黄”水层组肿瘤对比图片 A:火木层孔菌水层组肿瘤对比图片;B:鲍姆木层孔菌水层组肿瘤对比图片;C:瓦尼木层孔菌水层组肿瘤对比图片;D:椭圆嗜蓝孢孔菌水层组肿瘤对比图片;E:粗毛层孔菌水层组肿瘤对比图片;F:亚玛木层孔菌水层组肿瘤对比图片 |
从表 2中可以看出,与阳性组相比,给药组小鼠的脾指数均高于阳性组,除山野木层孔菌外,所有给药组小鼠的脾指数均具有显著性差异(P < 0.05);与对照组相比,瓦尼木层孔菌及椭圆嗜蓝孢孔菌低剂量组小鼠的脾指数具有显著性差异(P < 0.05),除山野木层孔菌和瓦尼木层孔菌低剂量组外,其它各组小鼠的脾指数均高于对照组。与阳性组相比,粗毛纤孔菌高剂量组小鼠的胸腺指数有极显著性差异(P < 0.01),其余各组小鼠胸腺指数与之相比差异不明显;与对照组相比,粗毛纤孔菌高剂量组小鼠的胸腺指数有极显著性差异(P < 0.01)。而阳性组与对照组相比,脾指数、胸腺指数均低于对照组。
六种“桑黄”类真菌水提取物对H22荷瘤小鼠血清中IL-2含量的影响,结果如表 3所示。6种“桑黄”类真菌水提取物除火木层孔菌及瓦尼层孔菌高低剂量组外,其他各组高低剂量IL-2含量均高于阳性组,低于空白组含量,其中鲍姆层孔菌水提取物高剂量组浓度为1 000 mg/kg时荷瘤小鼠血清中IL-2含量最高,达到59.829 ng/L。IL-2含量的高低能够直接反应提取物对荷瘤小鼠免疫功能的影响,且IL-2对小鼠肿瘤细胞无直接细胞毒作用,能够通过调节机体的免疫系统发挥抗肿瘤效应。
由表 4可知,肿瘤细胞Bax蛋白表达增强,Bcl-2蛋白表达减弱,且Bax/Bcl-2明显增高(P < 0.05)。
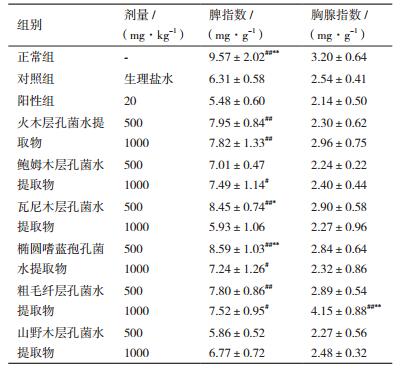
由图 2可知,阴性组小鼠肿瘤细胞形态正常,细胞呈圆球形,体积大小不同,肿瘤细胞排列紧密,呈现弥散性分布,染色程度较深;阳性组小鼠肿瘤细胞部分发生变形或畸形,细胞近似圆锥形,体积缩小,坏死细胞数量较多,细胞核染色程度比较浅,可清晰看到小鼠肿瘤细胞生长状况受到抑制;各受试药组肿瘤细胞形态改变明显,多数为圆锥形,体积缩小,弥散性分布,肿瘤细胞生长在一定程度上受到了限制。受试药组与阳性组病理切片相近,细胞生长明显受到了抑制。
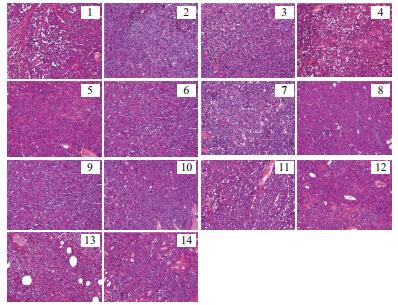
|
| 图 2 “桑黄”类真菌的水提取物对肿瘤细胞的影响 1:阴性对照组;2:阳性对照组;3:火木层孔菌水提取物低剂量组;4:火木层孔菌水提取物高剂量组;5:鲍姆木层孔菌水提取物低剂量组;6:鲍姆木层孔菌水提取物高剂量组;7:瓦尼木层孔菌水提取物低剂量组;8;瓦尼木层孔菌水提取物高剂量组;9:椭圆嗜蓝孢孔菌水提取物低剂量组;10:椭圆嗜蓝孢孔菌水提取物高剂量组;11:粗毛纤层孔菌水提取物低剂量组;12:粗毛纤层孔菌水提取物高剂量组;13:亚玛木木层孔菌水提取物低剂量组;14:亚玛木木层孔菌水提取物高剂量组,下同 |
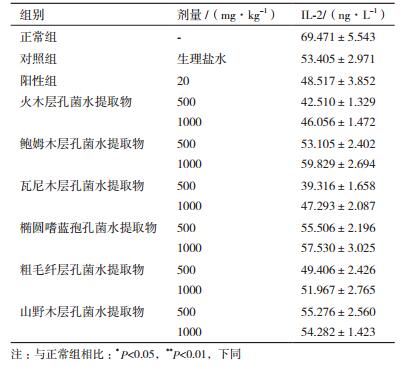
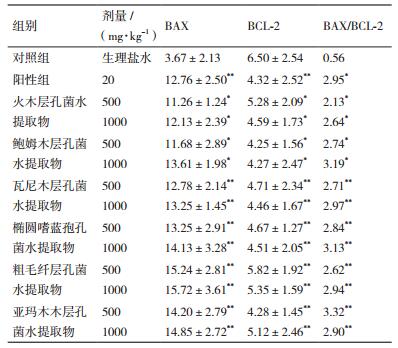
由图 3及图 4可知,阴性组的Bax蛋白表达不明显,而阳性组和各受试药组的Bax表达较阴性组明显,细胞浆呈棕黄色弥散分布较多,表明“桑黄”类真菌水提取物对提高小鼠肿瘤细胞中Bax的表达起到了积极作用;阴性组的Bcl-2蛋白的表达很明显,棕黄色弥散分布居多,Bax/Bcl-2的值也很小,由此表明小鼠肿瘤的凋亡细胞极少,而阳性和受试药组的Bax/Bcl-2的值与阴性对照组相比明显升高,表明凋亡的细胞较多,由此表明,“桑黄”水提取物对小鼠肿瘤细胞中Bcl-2的表达起到了抑制作用。
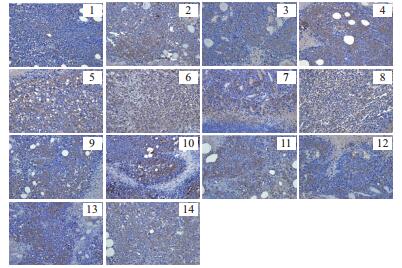
|
| 图 3 H22荷瘤小鼠肿瘤组织内BAX蛋白的表达(DAB,×400) |
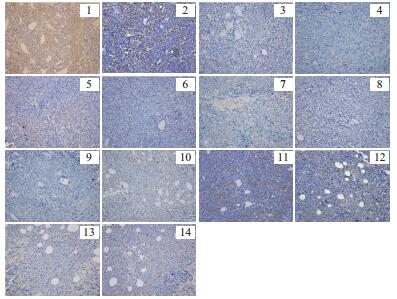
|
| 图 4 H22荷瘤小鼠肿瘤组织内BCL-2蛋白的表达(DAB,×400) |
本研究对不同“桑黄”类真菌水提取物的抗肿瘤活性进行了对比研究,结果表明6种“桑黄”类真菌水提取物,除鲍姆层孔菌水提取物低剂量组外,所有组分的肿瘤抑制率均达到30%以上。其中椭圆嗜蓝孢孔菌水提取物高剂量组(1 000 mg/kg)的抑瘤效果最佳,其抑瘤率为71.45%,比阳性组的抑瘤率(52.56%)高。瓦尼木层孔菌、椭圆嗜蓝孢孔菌及粗毛纤孔菌水提取物高低剂量组的抑瘤率与阴性对照组相比具有极显著性差异。山野木层孔菌水提取物高低剂量组及鲍姆木孔菌水提取物高剂量组与阴性对照组相比具有显著性差异。
同时,各组水提取物均可使免疫器官指数有所增加。与阳性组相比,各给药组小鼠的脾指数均高于阳性组,除山野木层孔菌外,所有给药组小鼠的脾指数均具有显著性差异(P < 0.05);与对照组相比,瓦尼木层孔菌及椭圆嗜蓝孢孔菌低剂量组小鼠的脾指数具有显著性差异(P < 0.05),除山野木层孔菌和瓦尼木层孔菌低剂量组外,其它各组小鼠的脾指数均高于对照组。与阳性组相比,粗毛纤孔菌高剂量组小鼠的胸腺指数有极显著性差异(P < 0.01),其余各组小鼠胸腺指数与之相比差异不明显;与对照组相比,粗毛纤孔菌高剂量组小鼠的胸腺指数有极显著性差异(P < 0.01)。而阳性组与对照组相比,脾指数、胸腺指数均低于对照组。本研究表明“桑黄”类真菌水提取物具有显著性的抗肿瘤活性,可能是由于“桑黄”类真菌水提取物中主要含有具有抗肿瘤活性的多糖类物质,这有待于进一步研究。
六种“桑黄”类真菌水提取物,除火木层孔菌及瓦尼木层孔菌高低剂量组外,其他各组高低剂量IL-2含量均高于阳性组,低于空白组含量,其中鲍姆木孔菌水提取物高剂量组浓度为1 000 mg/kg时荷瘤小鼠血清中IL-2含量最高,达到59.829ng/L。IL-2含量的高低能够直接反应提取物对荷瘤小鼠免疫功能的影响,且IL-2对小鼠肿瘤细胞无直接细胞毒作用,能够通过调节机体的免疫系统发挥抗肿瘤效应。IL-2能够促进T淋巴细胞和B细胞增殖与分化,体内增强T细胞的杀伤活性并产生免疫球蛋白,刺激巨噬细胞,提高巨噬细胞的吞噬能力。
从小鼠肿瘤病理切片图中看出,阳性组小鼠肿瘤细胞与阴性组相比,肿瘤细胞排列较分散,细胞体积变小,形状发生了改变,死亡细胞数目多,肿瘤细胞的生长明显受到抑制;火木层孔菌、粗毛纤孔菌及椭圆嗜蓝孢孔菌水提取物高、低剂量组(1 000 mg/kg,500 mg/kg)的肿瘤细胞与阴性组相比,肿瘤坏死细胞堆积,局部组织较分散,细胞形状变形,体积变小,肿瘤细胞生长受到了一定程度的抑制;鲍姆木孔菌、瓦尼木层孔菌及山野木层孔菌水提取物高、低剂量组(10 000 mg/kg,500 mg/kg)的肿瘤细胞形状和体积具有明显的变化,与阳性组接近,弥散性分布,肿瘤细胞生长受到抑制。
许多研究发现,肿瘤的发生及其生物学特性不仅与肿瘤细胞的增值有关,且与其凋亡密切相关。肿瘤细胞凋亡是细胞在各种死亡信号刺激后发生的一系列瀑布式激活的主动性细胞死亡过程,凋亡的发生受促进性和抑制性双向因素的供同行调节。Bax和Bcl-2分别是促进和抑制细胞凋亡两类基因,在细胞凋亡中发挥着重要的调节作用[7]。Bax作为一种促凋亡基因,其表达产物为Bax蛋白;Bcl-2作为一种抑制凋亡基因,其表达产物为Bcl-2蛋白[8]。
在小鼠肿瘤病理切片图中,阴性组肿瘤细胞没有变形,呈圆球形,体积大小不一,排列紧密,弥散性分布,染程度较深,Bcl-2蛋白的表达非常明显,棕黄色居多,Bax和Bcl-2的比值小,说明小鼠肿瘤的凋亡细胞少;阳性组和各受试药组的肿瘤细胞发生了明显的变形,近圆锥形,体积变小,细胞核的染色程度浅,坏死细胞数量较多,Bax表达明显,细胞浆多显黄褐色;Bax和Bcl-2的比值高,凋亡的细胞较多,肿瘤细胞生长明显受到了抑制。
有文献记载,“桑黄”类真菌的抗肿瘤活性成分以多糖类物质研究的最为广泛,且多数学者对“桑黄”类真菌多糖的抗肿瘤活性,提高免疫等方面作了深入研究,研究结果表明“桑黄”类真菌多糖类的抗肿瘤活性效果显著。日本学者Ikekaw等[2]发现,鲍姆木孔菌子实体热水提取物对小白鼠肉瘤S180具有相当高抑制效果,抑瘤率达到96.7%。Sasaki T等[9]进一步研究发现,鲍姆木孔菌中主要发挥抗肿瘤作用的成分为子实体多糖。本研究对6种“桑黄”类真菌水提取物的抗肿瘤活性进行了对比研究,研究表明“桑黄”类真菌水提取物具有显著性的抗肿瘤活性,可能是由于“桑黄”类真菌水提取物中主要含有具有抗肿瘤活性的多糖类物质,其详细机理有待于进一步研究。
4 结论六种“桑黄”类真菌水提取物的抗肿瘤作用主要通过增强免疫功能、IL-2的含量增加及对Bax蛋白的表达的促进和Bcl-2蛋白表达的抑制等途径达到了抑瘤效果,其较详细的机理有待于深入研究。
| [1] |
刘波. 中国药用真菌学[M]. 太原: 山西人民出版社, 1974.
|
| [2] |
Ikekawa T, Nakanish M, et al. Antitumoraction of some basidiomye-eteses Pecially Phellinus linleus[J]. Gann, 1968, 59: 155-157. |
| [3] |
周存山, 马海乐. 桑黄及其药理作用研究进展[J]. 食用菌, 2005, 26(2): 50-51. |
| [4] |
戴玉成, 杨祝良. 中国药用真菌名录及部分名称的修订[J]. 菌物学报, 2008, 27: 801-824. |
| [5] |
梁伟. 山野木层孔菌化学成分及抗肿瘤活性研究[D]. 长春: 吉林农业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10193-1011150314.htm
|
| [6] |
王超義. "桑黄"的生药学鉴定及抗肿瘤活性的对比研究[D]. 长春: 吉林农业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10193-1013309856.htm
|
| [7] |
罗洪英, 等. Bcl-2和Bax蛋白在青年人肺癌中的表达及其临床意义[J]. 郴州医学高等专科学校学报, 2003, 5(1): 4-6. DOI:10.3969/j.issn.1673-498X.2003.01.002 |
| [8] |
刘同慎, 刘希琴, 等. Bax蛋白在大鼠肝癌发生过程中的表达和意义[J]. 中国组织化学与细胞化学杂志, 2000, 9(3): 269-271. DOI:10.3870/j.issn.1004-1850.2000.03.009 |
| [9] |
Sasaki T, Fujii K, Sugura M, et al. Antitumor polysaccharides from some polyporaceae Ganderma applanatum(Pers.)Pat. and Phellinus linteus(Berk. & Curt.)Teng[J]. Che Pharm Bull, 1971, 19: 821. DOI:10.1248/cpb.19.821 |