2. 江南大学工业生物技术教育部重点实验室,无锡 214122
2. The Key Laboratory of Industrial Biotechnology of Ministry of Education, Jiangnan University, Wuxi 214122
经济和社会的日益发展使得石油消耗不断增加,燃料乙醇已成为开发新能源的重要组成部分,而木质纤维素被认为是生产燃料乙醇最理想的原料,但仍存在一些亟待解决的问题,如在稀酸水解的过程中会产生抑制物糠醛,它是木质纤维素发酵的主要抑制剂[1],它不仅能诱导细胞活性氧(ROS)的积累,引起线粒体、液泡膜、肌动蛋白骨架和染色质严重损害,而且会降低各种代谢流关键酶的活性,从而抑制微生物的生长[2]。因此对微生物的糠醛耐受性机理研究受到广泛的关注。
在低浓度的糠醛存在下,酵母可以利用原位脱毒作用将糠醛转化为低毒性的糠醇(依赖醛还原酶)。因此,利用此机制过表达zwf1(编码葡萄糖-6-磷酸脱氢酶),构建TAL1和ADH1共过表达菌株可以提高糠醛的降解率[3-4]。虽然利用基因工程、代谢工程等手段发现了一些可能与糠醛耐受性相关基因,为糠醛耐受性机理研究提供了基础,但是微生物在抑制物的胁迫环境下发生的变化极其复杂,酿酒酵母的糠醛耐受性由多个基因相互调控,单一改变某些基因或几个基因难以达到理想的结果[5]。
分子标记技术是以DNA序列多态性为基础反映生物个体之间的差异。作为第二代分子标记的微卫星(SSR)是由几个碱基对作为核心单位,串联重复形成的一类DNA序列[6],由于核心单位重复数目的变化构成了SSR基因座的遗传多态性,真核生物平均每50-150 kb就存在一个微卫星位点[7]。SSR具有分布广泛,易于检测,信息量大,有高度多态性并遵循孟德尔共显性遗传等特点[8],已被广泛应用于遗传制图、连锁分析、亲子鉴定、物种多态性、疾病基因以及农作物、水产养殖相关经济性状的基因定位研究。Zhou等[9]采用分子标记遗传学的研究方法,筛选与花生农艺性状显著相关的SSR标记,发现77个SSR标记与18个农艺性状相关,每个性状相关的标记数在2-16之间,以期应用于花生农艺性状的分子标记辅助育种。
本研究从正向遗传学角度来研究酿酒酵母的糠醛耐受性机制,在酿酒酵母基因组上筛选出多态性微卫星位点对F2代群体(39株单倍体耐受/敏感型)进行遗传差异分析,以期获得与糠醛耐受性紧密相关的微卫星(SSR)标记,是耐受性状遗传图谱构建以及数量性状(QTL)精确定位的前提,同时也为酿酒酵母糠醛胁迫机制研究提供参考。
1 材料与方法 1.1 材料 1.1.1 菌株48株酿酒酵母(Saccharomyces cerevi-siae),来自实验室保藏以及中国工业微生物菌种保藏中心(CICC)。
1.1.2 主要培养基YPD培养基(g/L)葡萄糖20.0,蛋白胨20.0,酵母粉10.0,固体加20 g琼脂。Mcclary培养基(g/L)葡萄糖1.0,KCl 1.8,NaAc 8.2,酵母膏2.5,固体加20 g琼脂。
1.1.3 试剂2×TaqDNAPCR Master Mix、PCR产物纯化试剂盒购自杭州宝赛生物公司;Ex Taq Max DNA Polymerase、PMD19-T(simple)Vector、DNA Marker购自宝生物工程(大连)公司;其他试剂为国产分析纯;引物由参考文献[10]和本实验室前期利用SSRhunter软件筛选获得,均送至上海生物工程公司合成。
1.2 方法 1.2.1 糠醛极端耐受性亲本菌株的筛选根据Pereira等[11]的方法适当修改,将实验室保藏的48株酿酒酵母于YPD平板中活化培养后,挑取少许菌转接至新鲜的YPD液体培养基中,30℃,200 r/min振荡培养24 h,取样稀释测定各菌株的OD600 nm值。将菌液稀释至OD600 nm=1,取4 μL菌悬液接种到含有不同浓度的糠醛平板上(添加至YPD固体培养基中终浓度分别为5、7、9、11、13、15、17、19、20、21 mmol/L),30℃培养,以在不含糠醛的YPD平板上生长的菌落作为对照,若在添加糠醛YPD平板上生长状况与其相当,则为其耐受表型值;筛选得到2株糠醛耐受性表型显著二倍体菌株,涂布在Mcclary培养基[12]上进行产孢培养,将单倍体菌株再一次进行表型筛选,以此获得表型极端差异单倍体亲本菌株作为亲本。
1.2.2 酵母基因组的提取(酸性玻璃珠法)接种酵母单菌落于20 mL YPD培养基中,30℃,200 r/min培养18-24 h,取适量菌液于1.5 mL离心管中,10 000 r/min离心1 min,弃上清,收集菌体;向离心管中加入与菌体量等体积酸性玻璃珠,400 μL ST-ES溶液,400 μL 24:1(V/V)氯仿/异戊醇;剧烈震荡30 s,立即冰浴30 s,间隔处理重复操作10次;加入400 μL TE溶液,10 000 r/min离心10 min;吸取上清液于离心管中,加入50 μL 3 mol/L醋酸钠,1 mL无水乙醇,混匀后于-40℃冰箱放置30 min,10 000 r/min离心10 min,弃上清;加入500 μL 75%乙醇洗涤沉淀,10 000 r/min离心10 min,弃上清;于37℃烘箱晾干乙醇,加入30 μL ddH2O溶解染色体DNA,琼脂糖凝胶电泳检测,于-20℃保存。
1.2.3 酿酒酵母单倍体交配型的PCR快速鉴定将纯化得到的单倍体菌株基因组为模板,用以下3条引物进行单倍体的快速鉴定[13]:
MAT-F:5'-AGTCACATCAAGATCGTTTATGG-3',MAT-α:5'-GCACGGAATATGGGACTACTTCG-3',MAT-a:5'-ACTCCACTTCAAGTAAGAGTTTG-3'。
100 μL PCR反应体系:2×TaqPCR Master Mix 50 μL,加入50 μL ddH2O,引物各1 μL,加入1 μL酵母染色体DNA作为模板进行扩增;PCR扩增条件:95℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min(延伸时间根据片段长度设定,扩增速度为1 000 bp/min),30个循环;72℃延伸10 min,4℃保存。PCR扩增产物通过1.5%琼脂糖凝胶电泳检测分别对应配型MATa(544 bp)和MATα(404 bp),从而可快速鉴定出单倍体菌株。
1.2.4 HO基因的敲除利用Cre-LoxP系统[14]对筛选出来的两株极端表型单倍体亲本进行HO基因敲除,以酵母基因组为模板PCR扩增上游HO基因同源臂(490 bp)、下游同源臂(546 bp)及以质粒PMGKR为模板PCR扩增KanMX片段(1 697 bp)作为抗性标记,再通过降落PCR得到这3个片段的融合片段,即为HO基因敲除盒(HO-KanMX-HO)并与PMD19-T(simple)进行T/A克隆并转化大肠杆菌JM109感受态细胞,获得重组质粒。通过PEG-LiAC介导[15]转化酵母细胞,并对转化子进行G418抗性平板筛选。基因敲除相关引物见表 1。
HO基因敲除盒PCR扩增体系(100 μL):Ex Taq 0.5 μL,10×Ex Taq Buffer 10 μL,dNTP Mixture 8 μL,模板DNA 1 μL,HOL-1和HOR-2各1 μL,ddH2O 78.5 μL反应条件:95℃ 5 min,94℃ 30 s,55℃ 30 min,72℃ 10 min,16℃ forever,30个循环。
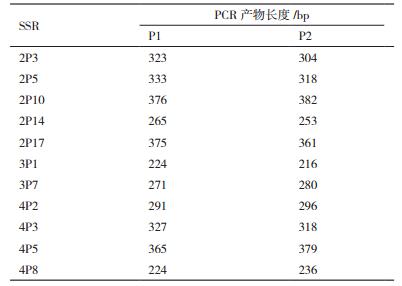
1.2.5 微卫星标记的基因分型根据从酵母基因组中的SSR位点设计带有不同荧光标记特异性引物,并对筛选的两亲本菌株进行基因分型,选择在两亲本之间具有多态性SSR位点作为标记,对两亲本杂交后获得的F2群体(39株)进行基因型分析,PCR扩增总体系为20 μL,分别为2×Taq PCR Master Mix 10 μL,上下游引物、酵母基因组各0.2 μL,ddH2O补足20 μL。反应条件:95℃ 5 min,94℃ 30 s,55-57℃ 30 s(不同引物的退火温度不同),72℃ 30 s,35个循环,72℃ 10 min,4℃保存。PCR扩增片段经1.5%琼脂糖凝胶电泳检测有无所需条带后,送至上海睿迪生物科技有限公司检测,采用荧光检测系统(ABI 3730×1测序仪),以Liz-500为分子内标对SSR进行精确的DNA片段分析,用Peak Scanner 1.0软件对收集到的数据进行处理分析,获得最终基因分型结果,具有多态性微卫星位点引物序列见表 2。
将F2群体(39株)的基因分型统计结果运用t检验分析不同位点的基因型在两基因池中的差异显著性,以此获得与糠醛耐受性相关的微卫星位点。
1.2.7 极显著差异位点基因型的克隆与测序将极显著差异基因片段PCR扩增并胶回收纯化,连接PMD19-T(simple)载体,转化感受态大肠杆菌JM109,挑取阳性克隆并测序。
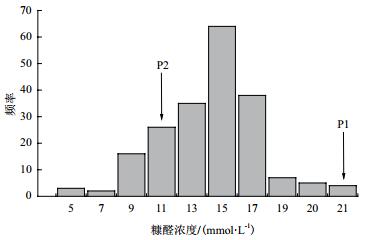
2 结果 2.1 两株极端耐受性菌株的获得如图 1所示,不同菌株之间具有不同的表型值,筛选对糠醛极端耐受性菌株,最大表型值达到21 mmol/L,最小表型值达到5 mmol/L,大部分菌株的表型值处在11 mmol/L-17 mmol/L。本研究选择耐糠醛表型值为21 mmol/L的CICC 31144(二倍体)作为耐受菌株,本应选择耐糠醛表型值尽可能低的作为低耐性亲本菌株,但由于工业酿酒酵母的产孢子能力退化,会影响后续实验进行,因此选择耐糠醛表型值为11 mmol/L CICC 1373(二倍体)作为敏感菌株,同时通过产孢培养及表型鉴定,获得表型极端差异单倍体亲本菌株P1、P2。另外,利用SPSS软件对表型值进行描述性统计分析,偏度系数为﹣0.375,峰度系数为0.238,二者系数小于1,近似为正态分布,表明此耐受性的复杂遗传机制是由多个基因来调控性状。
|
| 图 1 酿酒酵母(F2)糠醛耐受性的表型值分布 |
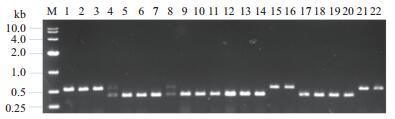
酿酒酵母产孢获得单倍体是进行酵母遗传学及育种极为关键的一步,它既是性状遗传分析所必需,又可为杂交作好亲本的准备。将CICC 31144和CICC 1373分别进行产孢培养及单倍体分离鉴定。如图 2所示,经1.5%凝胶电泳检测,PCR产物片段大小在544 bp为MAT-a,即泳道1-3、15-16、21-22,片段大小在404 bp为MAT-α,即泳道5-7、9-14、17-20,产物大小同时出现两个片段时为二倍体酵母细胞,即泳道4、8。
|
| 图 2 部分单倍体交配型的PCR鉴定 |
HO基因表达一种位点特异性内切酶,在酵母生孢过程中将导致单倍体配型的交换,从而与周围的异型孢子结合恢复为二倍体,不易分离出单倍体,需通过同源重组敲除HO基因才能有效分离出单倍体。将前期实验构建好的重组质粒进行PCR扩增获得敲除盒,利用PEG-LiAC法转化酵母细胞,并挑选G418抗性平板上的转化子进行验证,如图 3所示,泳道1、2片段大小在1 761 bp,为野生型HO基因,泳道3、4片段大小在2 632 bp,为突变型HO基因,泳道5、6片段为进一步验证,排除假阳性的可能。
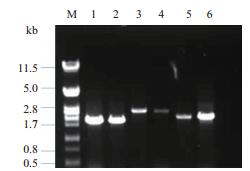
|
| 图 3 HO基因敲除验证 M:核酸标准分子量;1-2:野生型;3-4:突变型(敲除HO基因) |
根据SSR分子标记具有分布广泛,易于检测,高度多态性并属于共显性遗传标记等遗传特性,筛选出与目标基因紧密连锁的分子标记并应用于追踪与性状相关的功能基因或QTL的遗传动态。通过对单倍体亲本菌株的基因分型,筛选出11个具有多态性位点,扩增统计结果如表 3所示,所选的微卫星位点在亲本中表现出不同的基因型,说明这些位点在双亲衍生群体中具有较高的选择力。
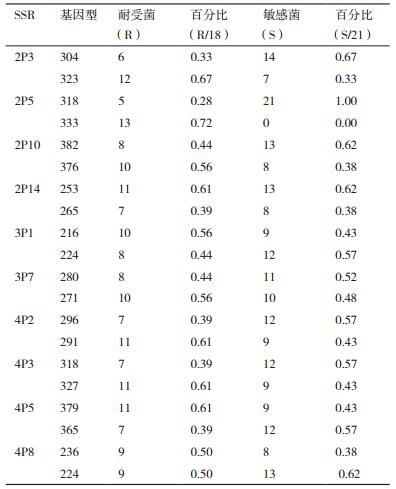
利用多态性的位点对图 1 F2代群体表型分布在两极端的个体基因分型,也叫选择基因型分析,统计结果如表 4所示,表中2P5位点有两种基因型,在耐受菌(18株)中318 bp出现率为28%,333 bp出现率为72%,而敏感菌(21株)318 bp出现率为100%,333 bp出现率为0%,说明该位点可能存在与该性状相关的目标基因具有一定的连锁关系。根据表 4的统计结果,运用t检验分析不同位点的基因型在两基因池中的差异显著性,如表 5所示,2P3位点统计量t=1.815,显著性P值为0.039﹤0.05,具有显著差异,2P5位点统计量t=3.971,显著性P值为0.000﹤0.01,达到极显著差异,说明该位点与控制该性状的基因具有极显著连锁遗传关系。
将极显著差异基因片段进行序列克隆、测序,获得微卫星位点差异条带的DNA序列,通过NCBI数据库BLAST比对,该片段序列和酿酒酵母S288c基因组一段高度吻合,同源性达到100%,基因登陆号为CP020124.1,2P5位点在耐受型R菌株测序结果为:5'-GATTCCGATGGCGTCTCATTGGTCAATAGTGACAATTCCCTCTCTAACATTCCATTATTCTCTTCTACTTTTCATCGTAAGTCAGAGTCTTCCTTAGCTTCGACATCCGTTGCACCTTCTTCTTCCTCCGAATTTGAGGTAGAAAACGAAATCTTGGAGGAAAAAAATGGATTAGCAAGTAAAATCGCACAGGCCGTCTTAAACAAGAGAATTGGTGAAAATACTGCCAGGGAAGAGGAAGAGGAAGAAGAAGAGGAAGAAGAAGAAGAGGAAGAAGAAGAAGAAGGGAAAGAAGGAGATGCGTAGATGCCATTTACTGACGGTGAAGATACT-3';
在敏感型S菌株测序结果为:5'-GATTCCGATGGCGTCTCATTGGTCAATAGTGACAATTCCCTCTCTAACATTCCATTATTCTCTTCTACTTTTCATCGTAAGTCAGAGTCTTCCTTAGCTTCGACATCCGTTGCACCTTCTTCTTCCTCCGAATTTGAGGTAGAAAACGAAATCTTGGAGGAAAAAAATGGTTAGCAAGTAAAATCGCACAGGCCGTCTTAAACAAGAGAATTGGTGAAAATACTGCCAGGGAAGAGGAAGAGGAAGAAGAAGAGGAAGAAGAAGAAGAAGGGAAAGAAGGAGATGCGTAGATGCCATTTACTGACGGTGAAGATACT-3'。
测序结果长度与基因分型分析结果大小一致,并对上述两种基因片段利用DNAMAN软件进行序列比对,如图 4所示,发现敏感型S菌株缺少4个GAA重复单元,推测重复单元的丢失导致了耐受性状相关基因的失活。

|
| 图 4 微卫星2P5等位基因片段的序列比对 |
目前对酵母糠醛耐受性研究主要利用反向遗传学来发现可能与耐受抑制剂相关响应代谢途径的基因及转录调控因子,并对微生物进行改造(过表达或敲除)来提高耐受性[16-17],但是此耐受性是由多个基因调控的数量性状,需从整体水平上对酵母进行系统的分析并深入了解性状的遗传结构。
在酿酒酵母中利用分子标记解析数量性状遗传基础的实例应用包括耐热性[18]、乙醇耐受性[10]、乙酸耐受性[19]、产孢率[20]、抗药物敏感[21]等抗逆性状。本研究通过筛选出两株表型差异二倍体菌株产孢培养获得子一代单倍体,再一次表型测定得到两株表型显著差异的亲本单倍体菌株,同时需要敲除HO基因获得稳定的单倍体,并杂交构建子二代单倍体群体F2(200株),将控制目标性状的基因在子代充分分离重组。本研究首次利用在酵母基因组中筛选出的多态性微卫星(SSR)标记对F2(39株)群体进行基因分型,选择在研究中表型性状极端个体(即性状的最大表达),意味着在全基因组范围内搜索检测到与耐受性相关的数量性状基因座(QTL)的机会通常较高[22],分析不同位点的基因型在两基因池中的差异显著性,发现2P5位点在耐受菌(18株)中318 bp出现率为28%,而敏感菌(21株)318bp出现率为100%,333 bp出现率为0%,统计量t=3.971(P=0.000﹤0.01),达到极显著差异水平,说明2P5位点可能与糠醛耐受性相关基因存在一定的连锁,同时将极显著差异基因型进行序列克隆、测序,发现敏感型S菌株缺少4个GAA重复单元,重复单元的丢失可能会导致耐受性状相关基因的失活。寻找与目标基因紧密连锁且不受环境影响的遗传标记在分子设计育种方面可用来选择有利等位基因,提高育种的准确性和预见性,后续将进一步构建糠醛耐受性状遗传图谱,并对表型性状贡献大的位点一一准确定位,数量性状定位可以是基因,也可以是一段非编码序列DNA,从而打破了仅仅从基因入手的局限性,同时可与在反向遗传学得出的已有研究结果进行对比验证,可能将发现更多的新型功能基因,从而提供在纤维素水解液中发酵产燃料乙醇菌株的正确改造方向。
4 结论本研究在酿酒酵母基因组上筛选出多态性微卫星位点对F2代群体(39株单倍体耐受/敏感型)进行遗传差异分析。结果发现两个与糠醛耐受性有关的微卫星位点,其中位点2P3在两基因池中达到显著差异(P=0.039﹤0.05),而位点2P5达到极显著差异(P=0.000﹤0.01)。对于微卫星位点2P5,耐受亲本P1在该位点的基因型(333 bp)在子代耐受群体中出现率为72.2%,而敏感亲本P2的基因型(318 bp)在子代敏感群体中出现率达100%(333 bp出现率为零),可能与糠醛耐受性相关基因存在一定连锁。
| [1] |
张译之, 苟敏, 汤岳琴. 紫外诱变驯化提高酿酒酵母木糖发酵的抑制物耐受性[J]. 生物技术通报, 2017, 33(9): 191-199. |
| [2] |
Sardi M, Rovinskiy N, Zhang Y, et al. Leveraging genetic-background effects in Saccharomyces cerevisiae to improve lignocellulosic hydrol-ysate tolerance[J]. Applied & Environmental Microbiology, 2016, 82(19): 01603-16. |
| [3] |
Wang S, Cheng G, Joshua C, et al. Furfural tolerance and detoxification mechanism in Candida tropicalis[J]. Biotechnology for Biofuels, 2016, 9(1): 250-261. DOI:10.1186/s13068-016-0668-x |
| [4] |
Hasunuma T, Ismail KS, et al. Co-expression of TAL1 and ADH1 in recombinant xylose-fermenting Saccharomyces cerevisiae improves ethanol production from lignocellulosic hydrolysates in the presence of furfural[J]. J Biosci Bioeng, 2014, 117(2): 165-169. DOI:10.1016/j.jbiosc.2013.07.007 |
| [5] |
赵鲜仙. 酿酒酵母糠醛耐受关键转录调控基因的筛选及其被调控基因的转录分析[D]. 雅安: 四川农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10626-1016050594.htm
|
| [6] |
Putman AI, Carbone I. Challenges in analysis and interpretation of microsatellite data for population genetic studies[J]. Ecology & Evolution, 2014, 4(22): 4399-4429. |
| [7] |
Tautz D. Hypervariability of simple sequences as a general source for polymorphic DNA markers[J]. Nucleic Acids Research, 1989, 17(16): 6463-6471. DOI:10.1093/nar/17.16.6463 |
| [8] |
黄龙花, 吴清平, 杨小兵, 等. 基于特定引物PCR的DNA分子标记技术研究进展[J]. 生物技术通报, 2011, 20(2): 61-65. |
| [9] |
Zhou JC, Yang XL, Cui SL, et al. Correlation between SSR markers and agronomic traits in peanut(Arachis hypogaea L.)[J]. Acta Agronomica Sinica, 2014, 40(7): 1197-1205. DOI:10.3724/SP.J.1006.2014.01197 |
| [10] |
Hu XH, Wang MH, Tan T, et al. Genetic dissection of ethanol tolerance in the budding yeast Saccharomyces cerevisiae[J]. Genetics, 2007, 175(3): 1479-1487. |
| [11] |
Pereira FB, Teixeira MC, Mira NP, et al. Genome-wide screening of Saccharomyces cerevisiae genes required to foster tolerance towards industrial wheat straw hydrolysates[J]. Journal of Industrial Microbiology & Biotechnology, 2014, 41(12): 1753-1761. |
| [12] |
李华, 刘丽丽, 李娟. 酿酒酵母产孢培养基的筛选及单倍体的分离[J]. 酿酒科技, 2008, 2(6): 22-24. |
| [13] |
Huxley C, Green ED, Dunham I. Rapid assessment of S. cerevisiae mating type by PCR[J]. Trends Genet, 1990, 6(8): 236-236. |
| [14] |
Guldener U, Heck S, Fielder T, et al. A new efficient gene disruption cassette for repeated use in budding yeast[J]. Nucleic Acids Research, 1996, 24(13): 2519-2524. DOI:10.1093/nar/24.13.2519 |
| [15] |
Gietz RD, Schiestl RH, Willems AR, et al. Studies on the transformation of intact yeast cells by the LiAc/SS-DNA/PEG procedure[J]. Yeast, 1995, 11(4): 355-360. DOI:10.1002/(ISSN)1097-0061 |
| [16] |
Song HS, Jeon JM, Kim HJ, et al. Increase in furfural tolerance by combinatorial overexpression of NAD salvage pathway enzymes in engineered isobutanol-producing E. coli[J]. Bioresource Technology, 2017, 245: 1430-1435. DOI:10.1016/j.biortech.2017.05.197 |
| [17] |
Wu G, Xu Z, Jönsson LJ. Profiling of Saccharomyces cerevisiae transcription factors for engineering the resistance of yeast to lignocellulose-derived inhibitors in biomass conversion[J]. Microbial Cell Factories, 2017, 16(1): 199-214. DOI:10.1186/s12934-017-0811-9 |
| [18] |
Steinmetz LM, Sinha H, Richards DR, et al. Dissecting the architecture of a quantitative trait locus in yeast[J]. Nature, 2002, 416(6878): 326-330. DOI:10.1038/416326a |
| [19] |
Geng P, et al. Genetic dissection of acetic acid tolerance in Saccha-romyces cerevisiae[J]. World J Microbiol Biotechnol, 2016, 32(9): 1-8. |
| [20] |
Ben-Ari G, Zenvirth D, Sherman A, et al. Four linked genes participate in controlling sporulation efficiency in budding yeast[J]. PLoS Genetics, 2006, 2(11): 195-205. DOI:10.1371/journal.pgen.0020195 |
| [21] |
Perlstein EO, Ruderfer DM, Roberts DC, et al. Genetic basis of individual differences in the response to small-molecule drugs in yeast[J]. Nature Genetics, 2007, 39(4): 496-502. DOI:10.1038/ng1991 |
| [22] |
Swinnen S, Thevelein JM, Nevoigt E. Genetic mapping of quantitative phenotypic traits in Saccharomyces cerevisiae[J]. Fems Yeast Research, 2012, 12(2): 215-227. DOI:10.1111/j.1567-1364.2011.00777.x |