多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是指由2个及以上苯环组成的稠环芳香烃化合物,由于其毒性以及在环境中的持久性而受到广泛关注[1-2],美国环境保护署(EPA)已将16种PAHs列入优先控制有机污染物黑名单中[3]。生物法去除多环芳烃主要通过生物的吸附、降解及两种方式联用去除环境中的多环芳烃。生物吸附能够将PAHs快速从环境中去除,但仍然附着在吸附剂上,易产生二次污染;生物降解是通过各类酶催化降解PAHs为毒性较小或无毒的化合物,但处理周期长;而生物吸附和降解联用先在短期内吸附大量PAHs,将其滞留在微生物体内,再利用微生物酶将PAHs完全降解,无二次污染。利用生物法去除多环芳烃因其经济成本较低,可将污染物转变为低毒或无毒的物质,对环境危害小,可操作性强,成为现今主要去除多环芳烃的方法之一。但生物法去除PAHs过程也受各种因素影响,如PAHs的化学性质、微生物的数量和种类及环境条件等[4]。
一般认为,PAHs的毒性随着苯环数目的增加而增大。研究发现低分子量(2个或3个苯环)的PAHs(如萘、菲和蒽等)容易作为微生物生长所需的碳源和能源而被快速降解。而高分子量(4个及以上苯环)的PAHs(如芘、苯并蒽、屈、苯并芘和二苯并蒽等)较难被微生物降解。已发现可降解/转化多环芳烃的微生物种类很多,包括细菌,如假单胞菌(Pseudomonas)[5]、红球菌(Rhodococcus)[6]、分支杆菌(Mycobacterium)[7]和鞘氨醇单胞菌(Sphingomonas)[8]等;真菌,如白腐真菌(White Rot Fungi)[9-10]、青霉菌(Penicillium funiculosum)[11]、曲霉真菌(Aspergillus)[12]、镰刀菌(Fusarium)[13]、毛霉菌(Mucor)[14]等;藻类,如羊角月牙藻(Selenastrum capricornutum)等[15-16]。由于丝状真菌在减少土壤中高环多环芳烃的含量以及降低多环芳烃毒性方面具有独特的优势,近年来得到了广泛的关注,目前已知具有PAHs降解功能的真菌超过了220种[17],在污染土壤修复中得到应用的也有30余种。与细菌相比,真菌能在低湿度、低pH的环境中生存,能对污染物保持较好的降解能力[18]。且真菌独特的丝状结构特征使其能够适应特殊的生长环境,更易于在复合污染环境中存活[19]。目前,在污染土壤修复中主要研究的大多为白腐真菌和子囊菌门的盘菌亚门,其中白腐真菌还可修复其他有机污染或重金属对土壤环境的污染,甚至可实现复合污染共脱毒[20]。此外,在多环芳烃降解研究中发现,细菌主要利用细胞色素(P450)单加氧酶降解多环芳烃[21-22],而白腐真菌可同时利用胞内单加氧酶和胞外双加氧酶(漆酶Laccase、木素过氧化物酶LiP和锰过氧化物酶MnP)降解PAHs。随着真菌PAHs降解机制及真菌生态学研究的深入,真菌在污染(特别是复合污染)土壤修复中的潜在价值逐渐显现[23]。
本实验以蒽为唯一碳源和能源,从长期受污染的土壤中分离出一株黄曲霉(Aspergillus flavus sp.),并对黄曲霉菌降解PAHs特性以及不同耐受性进行研究,对微生物降解多环芳烃的实际应用提供理论依据。
1 材料与方法 1.1 材料 1.1.1 土壤采集土壤采自新疆北部某化工厂周围的土样,将土壤表面大约5 cm的土层去掉,用灭过菌的铁铲采集5 cm-10 cm的土样,然后装入无菌的塑料袋中,密封后带回实验室于4℃保存备用。土样经除杂、碎散、过筛(0.85 mm)、混匀后密封储存在塑料袋中,备用。
1.1.2 培养基LB培养基(g/L):酵母提取物5 g,胰蛋白胨10 g,NaCl 10 g,琼脂20 g,pH7,蒸馏水1 000 mL,用于菌种保藏。无机盐培养基(MSM):(NH4)2SO4 4.95 g,KH2PO40.5 g,K2HPO4·3H2O 0.5 g,无机盐溶液2 mL,水1 000 mL,pH7。若是固体培养基则加入琼脂20 g。添加不同浓度的PAHs用于菌株筛选。无机盐溶液:MgSO4·7H2O 2 g,CuSO4·5H2O 0.5 g,MnSO4·H2O 0.5 g,FeSO4·7H2O 0.5 g,CaCl2·2H2O 0.5 g,水500 mL。PAHs固体培养基:PAHs-丙酮溶液(50 mg/L)均匀地喷涂于固体无机盐培养基上,待丙酮挥发尽后备用。添加不同浓度的PAHs用于菌株筛选。(PAHs:蒽、菲、芘、苯并蒽、二苯并蒽(浓度 > 97%)均购于阿拉丁工业公司)。PAHs储备溶液:以丙酮为溶剂分别配制PAHs(1 g/L和5 g/L)的母液,将配制好的溶液置于冰箱中4℃保存备用(PAHs同上)。PAHs的标准溶液(作标准曲线用):准确称量PAHs标准试剂各0.005 0 g,用环己烷溶解,定容至50 mL(PAHs同上)。
1.2 方法 1.2.1 菌株的筛选取10 g采集的土样加入90 mL已灭菌的蒸馏水中混匀,取5 mL加入50 mL无机盐培养基中,在振荡速度为150 r/min恒温30℃的摇床中培养5 d后,从培养液中取出5 mL菌液加入到含蒽(50 mg/L)的无机盐培养液中,培养5 d,富集培养几个周期,至可以看到明显的菌丝球形成。取0.1 mL菌液涂布于不同浓度(50、100、200、300和400 mg/L)的PAHs固体培养基中直至出现单菌落,挑取单菌落在斜面培养基上划线,4℃保存备用。
1.2.2 菌株的培养将已纯化的菌株接种至MSM液体培养基(50 mg/L)中,30℃、150 r/min振荡培养,分别测定7 d内菌株对蒽的去除率。
1.2.3 菌株鉴定光学显微镜下观察菌株的形态,并将菌株送至上海生工生物工程技术服务有限公司完成18S rRNA测序。用BLAST软件在GenBank上对获得的18S rRNA序列进行同源性比对。利用MEGA软件和Neighbor-Joining法,以比对结果和参考菌株序列及其他菌属序列构建系统发育树。
1.2.4 菌株的吸附与降解测定菌株在无PAHs的MSM培养基中培养72 h后,分别取同批次的发酵液(包括活菌和培养液)、活菌丝(8 000 r/min离心10 min后去除上清液)、失活菌丝(高温120℃,高压1×105 Pa,灭菌30 min)、发酵上清液(8 000 r/min离心10 min后取上清液)作为蒽去除剂,每组总反应体系20 mL(不足则补充灭菌的培养液),反应体系中蒽的浓度为50 mg/L,分别在1、2、3和6 h测定蒽的去除率。
1.2.5 蒽降解菌生长特性的研究50 mL的三角瓶中装20 mL MSM培养液(蒽浓度为50 m/L),接种量1 mL(培养24 h的菌悬液),在24、36、48、60和72 h测定蒽的去除率,依次优化培养温度(25、30、35、40和45℃),摇床振荡培养(150 r/min);摇床转速(120、150、170和200 r/min)恒温振荡培养;起始pH值(4、5、6、7、8和9)以不接种的培养基对照,每个处理设3个重复。
1.2.6 降解菌的耐受性测定 1.2.6.1 菌株对蒽的耐受性在MSM培养基中加入蒽-丙酮溶液,调节蒽的质量浓度分别为50、100、200、400、800和1 000 mg/L。50 mL的三角瓶中装20 mL培养液,接种量1 mL(培养24 h的菌悬液),最优条件下培养72 h测定蒽的去除率。以不接种的培养基对照,每个处理设3个重复。
1.2.6.2 不同盐浓度下菌株对蒽的降解在MSM培养基(蒽浓度为50 mg/L)中加入NaCl浓度分别为1%、3%、5%、6%、7%和9%。最优条件下培养72 h后测定蒽的去除率。以接种在原培养基的菌株去除率为对照,实验设接菌不加盐对照,每个处理设3个重复。
1.2.6.3 不同重金属浓度下菌株对蒽的降解在MSM培养基中分别加入浓度为1、2、3、4和5 mmol/L的5种重金属离子Cu2+、Mn2+、Cr3+、Cd2+和Pb2+,最优条件下培养72 h后测定蒽的去除率。以接种在原培养基的菌株去除率为对照,每个处理设3个重复。
1.2.6.4 菌株的底物广谱性分别配置50mg/L的蒽、菲、芘、苯并蒽和二苯并蒽,50 mL的三角瓶中分别装20 mL MSM培养液(多环芳烃浓度为50 mg/L,接种量1 mL(培养24 h的菌悬液),72 h后测定多环芳烃的去除率,以加不同底物不接菌的培养基为对照,每个处理设3个重复。
1.2.7 多环芳烃去除率的测定 1.2.7.1 蒽的标准曲线配置10 mg/L蒽的标准溶液,分别取0、0.1、0.2、0.3、0.4、0.5、0.6、0.7和0.8 mL并定容至10 mL,分别再λ=254 nm的波长下测其吸光度值,最后得到蒽的标准曲线方程为:Y=1.232 9 X-0.000 1,R2=0.999 9。
1.2.7.2 去除率的测定培养液用环己烷1:1体积比在125 mL梨形分液漏斗中反复萃取3次,合并有机相,经无水Na2SO4脱水后定容[24]。萃取液经适当稀释后,在254 nm处测定其吸光值,根据蒽的标准曲线,得出蒽的浓度。
去除率:(D)
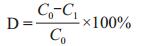 (1)
(1)
C0:空白对照蒽的浓度;C1:培养液中残留蒽的浓度。
2 结果 2.1 菌株的筛选与鉴定以蒽为唯一碳源和能源进行筛选,对富集培养后的菌株进行纯化,挑取单菌落至新的平板上进行培养观察,所筛选得到的菌株菌落结构疏松,表面颜色呈淡黄色,有复杂的分支菌丝(图 1-A),在显微镜下观察可见分生孢子头疏松放射状,顶囊近似球形,粗糙(图 1-B和1-C)。提取蒽降解菌株基因组总DNA后,经PCR扩增18S rRNA得到1 275 bp大小的扩增片段,扩增后的DNA片段经过纯化测序,并在GenBank中与相似性较高的菌株进行比对、构建系统发育树。结果显示,蒽降解菌株与黄曲霉属的相似性最高(图 2),命名为黄曲霉AD-X-1(Aspergillus flavus AD-X-1)。
|
| 图 1 所筛菌株的菌落照片及显微照片 A:菌落照片;B:菌株显微镜照片(40倍);C:菌株显微镜照片(100倍) |

|
| 图 2 筛选菌株的系统发育树 |
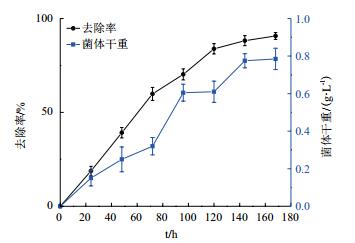
考察所筛选菌株AD-X-1的生长曲线及对蒽(50 mg/L)的去除,结果如图 3所示,菌株AD-X-1在蒽存在时生长相对较慢,144 h左右菌株AD-X-1达到稳定期,此时的生物量达到最大(0.8 g/L),蒽的去除率为85%左右。该菌株的去除率与菌株生长成正比,后期实验仅考察72 h内的去除率。
|
| 图 3 菌株AD-X-1的去除率及生长曲线 |
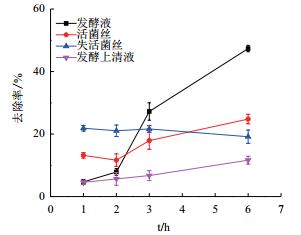
真菌因其巨大的比表面积和众多的附着位点,有利于对疏水性VOCs摄取和利用,真菌对有机污染的去除有多种形式,包括吸附、降解和吸附降解共同作用。为确定菌株AD-X-1对多环芳烃的去除方式,在不同处理条件下考察菌株AD-X-1对蒽的去除。结果如图 4所示,失活菌丝在1 h时可达吸附平衡,去除率在21%左右,说明失活菌丝吸附已经达到饱和。相比较,菌株AD-X-1的发酵液、活菌丝、发酵上清液的去除率随时间延长而持续增加,在6 h时去除率分别可达47%、25%和12%。表明菌株AD-X-1除菌丝体吸附外,还有别的方式进行蒽的去除,随着菌株与底物的接触,菌株自身产生的酶或者大分子活性物质开始参与蒽的降解,且6 h总去除率已超过吸附作用的去除率。前期测得该菌株72 h蒽的去除能力可达到70%左右(图 3),说明菌株AD-X-1去除蒽的方式主要还是以降解为主。
|
| 图 4 不同处理下菌株AD-X-1对蒽的吸附与降解 |
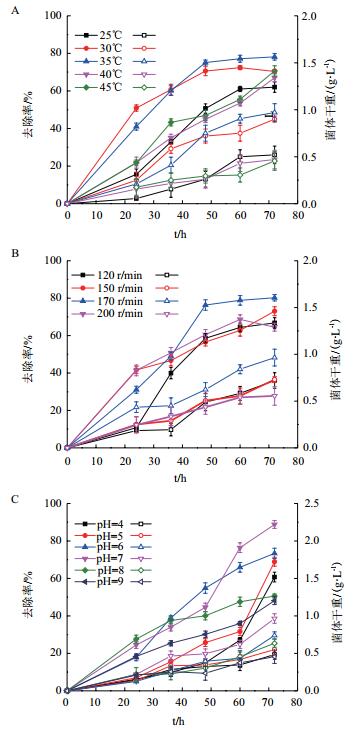
分别研究不同温度、转速、pH值下菌株AD-X-1对蒽的去除,结果显示,35℃培养72 h,去除率最高达76%,菌体干重为0.85 g/L(图 5-A)。45℃时菌株AD-X-1的去除率仍能维持在65%左右。
|
| 图 5 不同温度(A)、转速(B)、pH值(C)对菌株ADX-1去除率的影响 |
在35℃,转速为170 r/min培养72 h,菌株AD-X-1对蒽的去除率可达到78%(图 5-B),菌株生长较快,去除效果较好。
pH是影响微生物生长的关键因素,在极端pH下,微生物生长变慢,活性降低。在35℃,转速170 r/min,pH为7培养72 h,菌株AD-X-1的去除率最高(88%);然而在pH为9时,菌株AD-X-1的去除率还能维持在45%左右(图 5-C)。说明菌株在碱性环境(pH7-9)中具有一定的耐受性。
2.4 菌株AD-X-1的耐受性研究 2.4.1 菌株AD-X-1对蒽的耐受性在MSM培养基中添加不同浓度的蒽,考察菌株AD-X-1对蒽的耐受性。结果如图 6所示,随着蒽的浓度增加,菌株的去除率在72 h后逐渐降低,但蒽浓度为1 000 mg/L时仍有55%的去除率,说明该菌株对高浓度蒽的耐受性较强,可在高污染环境中生存。

|
| 图 6 不同浓度的蒽对菌株AD-X-1去除率的影响 |
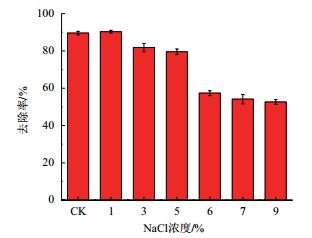
考察菌株AD-X-1对盐的耐受性,结果如图 7所示。菌株AD-X-1在1%-9%的盐度内对蒽均有一定的去除作用,当盐度为1%,对菌株去除蒽几乎无影响,72 h蒽的去除率可达90%;当盐度为3%-5%时,72 h菌株对蒽的去除率下降至78%左右;当盐度在6%-9%时,去除率下降较快,但还能维持在50%左右,表明该菌株对盐度的耐受力较强,但高盐度会引起细胞渗透压的升高,还是对菌株的生长和有机污染物的去除有一定抑制。
|
| 图 7 盐度对菌株AD-X-1去除率的影响 |
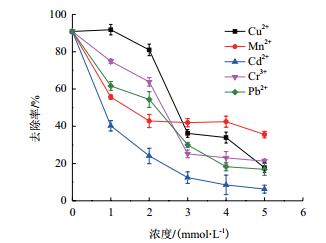
选择Cu2+、Mn2+、Cr3+、Cd2+和Pb2+几种常见重金属,考察重金属离子对菌株生长和污染物去除的影响。单独添加1 mmol/L各种重金属离子时,除Cu2+外,菌株AD-X-1对蒽的去除能力均受到一定抑制(图 8)。随着重金属离子浓度继续增加时,菌株对蒽的去除率大幅下降。对比5种金属离子,低浓度的Cu2+对菌株去除能力影响不大,其他重金属离子均对该菌株有一定影响,该菌株对五种重金属离子的耐受能力由大到小顺序为Cu2+、Cr3+、Pb2+、Mn2+和Cd2+。
|
| 图 8 不同金属离子对菌株AD-X-1去除率的影响 |
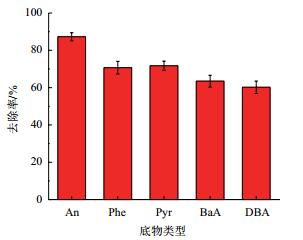
分别以不同环数的PAHs为底物,考察菌株AD-X-1对其去除能力。结果(图 9)显示,除蒽(An)以外,菌株AD-X-1还能去除菲(Phe)、芘(Pyr)、苯并蒽(BaA)、二苯并蒽(DBA)等多种PAHs。培养72 h后菌株AD-X-1对三环的蒽和菲去除率可达到70%以上,对于四环的芘和苯并蒽的去除率可达68%左右,对五环的二苯并蒽去除率仍可达到63%。说明菌株AD-X-1不仅能够去除低环的PAHs还可去除高环的PAHs,可去除的底物多样。
|
| 图 9 菌株AD-X-1对不同PAHs的去除率 |
本研究从新疆北部某化工厂周围的土样筛选获得一株具有广谱性多环芳烃降解菌株AD-X-1,通过鉴定为黄曲霉属。进一步考察温度、转速、pH值对蒽(50 mg/L)去除的影响,结果在最优条件(温度35℃,转速170 r/min,pH值为7)下,72 h后菌株AD-X-1对蒽的去除率可达到88%,是一株降解效果较高的真菌。由于真菌细胞壁上存在大量的功能基团,如羟基、羧基、氨基、磺酸盐和磷酸盐基团等,这些基团赋予真菌良好的吸附性能[26]。在吸附降解实验中失活菌丝在1 h即达到吸附平衡,去除率在前3 h相比于活菌丝吸附能力高,可能由于高温高压灭活过程中,菌丝内部结构被破坏,增大了其表面通透性和吸附性。而菌株AD-X-1的发酵液、活菌丝、发酵上清液的去除率随时间增加而增加,表明除吸附作用外,菌株自身所产生的酶类(实验中检测到胞外锰过氧化物酶、木质素酶活性,数据未显示)参与蒽的降解。所以菌株AD-X-1对多环芳烃的去除是以降解为主,菌丝体吸附也起到一定作用。
近年来,国内外对高分子量PAHs的微生物降解研究表明,能够同时降解多种高分子量PAHs(如四环和五环)的微生物资源较少[27]。王慧等[28]筛选出嗜盐菌Thalassospira sp.strain TSL5-2能够降解三环和四环的多环芳烃。段燕青等[29]筛选出的米曲霉以芘为单基质代谢时,降解率为33%;毛健等[27]筛选的菌株HPD-2在培养168 h后对芘和荧蒽的去除率分别达到47.2%和84.5%。朱婷婷等[30]筛选出的一株不动杆菌Bap30在20 d内才将40 mg/L的苯并[a]芘降解28.7%。本实验所筛选的菌株AD-X-1在72 h内对蒽(50 mg/L)和菲(50 mg/L)去除率分别为88%和70%,对四环的芘和苯并蒽的去除率可到71%和68%,菌株AD-X-1对五环的二苯并蒽降解能力也可达到63%。说明菌株AD-X-1具有高效、广谱的多环芳烃降解能力。
已有研究发现,适当的盐度可促进菌株的降解,而高盐度却会抑制降解菌的生长、降解和代谢[31]。王慧等[28]从石油污染土壤中富集分离出的嗜盐菌Thalassospira sp.strain TSL5-2最适盐度为5%,25 d内降解率达到53.3%。李修平[32]筛选出的蒽降解菌A1鞘氨醇单胞菌(Sphingomonas)在72 h,盐浓度为1.2%时的降解率最大为78%。而菌株AD-X-1在盐浓度为1%时,72 h的去除率最大可达90%,在5%的盐度下,菌株72 h的去除率可达78%。相比于上述两株菌,AD-X-1的降解效果较好而且降解时间短。也说明菌株AD-X-1对盐具有较高的耐受性。
研究发现,重金属可加剧多环芳烃对微生物细胞的毒害作用[29],然而在土壤环境中多存在重金属和多环芳烃的复合污染。考察菌株AD-X-1对重金属离子(1 mmol/L)的耐受性,72 h在Cu2+(249.69 mg/L)、Cd2+(308.48 mg/L)、Pb2+(331.21 mg/L)存在时,菌株的去除率就可达90%、40%和60%,对Cr3+(400.05 mg/L)和Mn2+(169.02 mg/L)的去除率可达54%和72%。当重金属离子浓度达到3 mmol/L时,菌株的去除率下降很快。相比较,菌株AD-X-1对Cu2+的耐受性最强,对Cd2+的耐受性最差(图 8)。顾平等[33]发现在Cu2+(50 mg/L)存在时菌株BF-1对B[a]P的降解作用略有下降,降解率为64.77%;Cd2+(100 mg/L)和Pb2+(300 mg/L)会明显降低菌株BF-1对B[a]P的降解效果,降解率分别为54.07%和49.59%。段燕青等[29]研究了米曲霉对重金属(铜和镉)的耐受浓度分别为500 mg/L和50 mg/L,菌株还能生长。相较而言,菌株AD-X-1对不同重金属的耐受能力较强。因此本研究筛选所获得的菌株AD-X-1具有广谱的多环芳烃降解能力,还具有很好的耐盐、耐重金属特性,说明该菌株能更好的适应较为恶劣的环境。
4 结论从受污染的土壤中筛选得到1株多环芳烃高效降解菌,经18S rRNA鉴定此菌株为黄曲霉属,命名为Aspergillus flavus. AD-X-1。
菌株AD-X-1对多环芳烃的去除以降解为主,菌丝体吸附也起到一定作用。通过优化蒽浓度为50 mg/L时,在温度35℃,转速170 r/min,pH值7时,72 h菌株AD-X-1对蒽的去除率可达到88%。
菌株有较好的耐受恶劣环境的特性,当盐度为9%时,菌株对蒽的去除率仍保持在50%;对重金属离子有较好的耐受性(Cu2+ > Cr3+ > Pb2+ > Mn2+ > Cd2+);且除蒽、菲外,该菌株还可去除四环的芘和苯并蒽、五环的二苯并蒽,底物多样。
| [1] |
Abdel-Shafy HI, Mansour MSM. A review on polycyclic aromatic hydrocarbons:Source, environmental impact, effect on human health and remediation[J]. Egyptian Journal of Petroleum, 2016, 25(1): 107-123. DOI:10.1016/j.ejpe.2015.03.011 |
| [2] |
Cerniglia CE. Biodegradation of polycyclic aromatic hydrocarbons[J]. Current Opinion in Biotechnology, 1992, 4(2-3): 351-368. |
| [3] |
Keith LH, Telliard WA. Telliard WA. Priority Pollutants:Ⅰ. A Perspective View[J]. Environmental Science & Technology, 1979, 13(4): 416-423. |
| [4] |
Ghosal D, Ghosh S, Dutta TK, et al. Current state of knowledge in microbial degradation of polycyclic aromatic hydrocarbons(PAHs):A review[J]. Front Microbiol, 2016, 7(386): 1369-1396. |
| [5] |
Lin M, Hu X, Chen W, et al. Biodegradation of phenanthrene by Pseudomonas sp. BZ-3, isolated from crude oil contaminated soil[J]. International Biodeterioration & Biodegradation, 2014, 94: 176-181. |
| [6] |
Finkelstein ZI, Baskunov BP, Golovlev EL, et al. Fluorene transformation by bacteria of the genus Rhodococcus[J]. Microbiology, 2003, 72(6): 660-665. DOI:10.1023/B:MICI.0000008365.53111.a4 |
| [7] |
李全霞, 范丙全, 龚明波, 等. 降解芘的分枝杆菌M11的分离鉴定和降解特性[J]. 环境科学, 2008, 29(3): 763-768. DOI:10.3321/j.issn:0250-3301.2008.03.037 |
| [8] |
Roy M, Khara P, Dutta TK. Meta-Cleavage of hydroxynaphthoic acids in the degradation of phenanthrene by Sphingobium sp. strain PNB[J]. Microbiology, 2012, 158(3): 685-685. |
| [9] |
陈静, 胡俊栋, 王学军, 等. 白腐真菌对土壤中多环芳烃(PAHs)降解的研究[J]. 环境化学, 2005, 24(3): 270-274. DOI:10.3321/j.issn:0254-6108.2005.03.010 |
| [10] |
丁洁, 王银善, 沈学优, 等. 白腐真菌体对菲和芘的吸附-脱附作用及影响因素[J]. 环境科学学报, 2010, 30(4): 825-831. |
| [11] |
刘世亮, 骆永明, 吴龙华, 等. 真菌对污染水稻土中苯并[J]. 土壤学报, 2011, 48(1): 54-61. |
| [12] |
Silva IS, Santos EC, Menezes CR, et al. Bioremediation of a polyaromatic hydrocarbon contaminated soil by native soil microbiota and bioaugmentation with isolated microbial consortia[J]. Bioresource Technology, 2009, 100(20): 4669-4675. DOI:10.1016/j.biortech.2009.03.079 |
| [13] |
Wu YR, Luo ZH, Vrijmoed LL. Biodegradation of anthracene and benz[a]anthracene by two Fusarium solani strains isolated from mangrove sediments[J]. Bioresource Technology, 2012, 101(24): 9666-9672. |
| [14] |
Wang S, Li X, Liu W, et al. Degradation of pyrene by immobilized microorganisms in saline-alkaline soil[J]. Journal of Environmental Sciences, 2012, 24(9): 1662-1669. DOI:10.1016/S1001-0742(11)60963-7 |
| [15] |
Chan SM, Luan T, Wong MH, et al. Removal and biodegradation of polycyclic aromatic hydrocarbons by Selenastrum capricornutum[J]. Environmental Toxicology & Chemistry, 2010, 25(7): 1772-1779. |
| [16] |
Ghasemi Y, Rasoul-Amini S, Fotooh-Abadi E. The biotransformation, biodegradation, and bioremediation of organic compounds by microalgae[J]. Journal of Phycology, 2011, 47(5): 969-980. DOI:10.1111/j.1529-8817.2011.01051.x |
| [17] |
Cerniglia CE, Sutherland JB. Degradation of polycyclic aromatic hydrocarbons by fungi[M]. Springer: Verlag Berlin Heidelberg, 2010.
|
| [18] |
陆李超, 贾青, 成卓韦, 等. 真菌降解挥发性有机化合物的研究进展[J]. 环境污染与防治, 2014, 36(8): 78-83. DOI:10.3969/j.issn.1001-3865.2014.08.014 |
| [19] |
贾洪柏, 曲丽娜, 王秋玉. 降解石油丝状真菌的筛选及其降解特性[J]. 环境科学研究, 2013, 26(6): 678-683. |
| [20] |
陈金媛, 沈洋洋, 李烜桢. 白腐真菌Ganoderma Sinense对镉和蒽的去除能力[J]. 环境工程学报, 2016, 10(2): 787-791. |
| [21] |
Mcerlean C, Marchant R, Banat IM. An evaluation of soil colonisation potential of selected fungi and their production of ligninolytic enzymes for use in soil bioremediation applications[J]. Antonie Van Leeuwenhoek, 2006, 90(2): 147-158. DOI:10.1007/s10482-006-9069-7 |
| [22] |
Bogan BW, Lahner LM, Sullivan WR, et al. Degradation of straight-chain aliphatic and high-molecular-weight polycyclic aromatic hydrocarbons by a strain of Mycobacterium austroafricanum[J]. Journal of Applied Microbiology, 2010, 94(2): 230-239. |
| [23] |
Harms H, Schlosser D, Wick LY. Untapped potential:exploiting fungi in bioremediation of hazardous chemicals[J]. Nature Reviews Microbiology, 2011, 9(3): 177-192. DOI:10.1038/nrmicro2519 |
| [24] |
王蕾, 聂麦茜, 王志盈, 等. 多环芳烃降解菌的筛选及其对芘的降解研究[J]. 环境科学与技术, 2010, 33(1): 43-47. DOI:10.3969/j.issn.1003-6504.2010.01.011 |
| [25] |
Bowman SM, Free SJ. The structure and synthesis of the fungal cell wall[J]. Bioessays, 2006, 28(8): 799-808. DOI:10.1002/(ISSN)1521-1878 |
| [26] |
毛健, 骆永明, 滕应, 等. 一株高分子量多环芳烃降解菌的筛选、鉴定及降解特性研究[J]. 微生物学报, 2008, 35(7): 1011-1015. |
| [27] |
王慧, 周海燕, 黄勇, 等. 一株高环多环芳烃降解嗜盐菌Thalassospira sp.的分离及降解特性[J]. 清华大学学报(自然科学版), 2015, 55(1): 87-92. |
| [28] |
段燕青, 岳秀萍, 白凡玉, 等. 耐受重金属的芘降解真菌的筛选及芘降解动力学研究[J]. 环境工程学报, 2015, 9(2): 977-982. |
| [29] |
朱婷婷, 倪晋仁, 彭盛华. 苯并[a]芘降解菌Acinetobacter sp. Bap30菌株的分离、鉴定及降解特性研究[J]. 北京大学学报:自然科学版, 2018, 54(1): 189-196. |
| [30] |
ArulazhaganP, VasudevanN. Role of nutrients in the utilization of polycyclic aromatic hydrocarbons by halotolerant bacterial strain[J]. 环境科学学报:英文版, 2011, 23(2): 282-287. |
| [31] |
李修平. 蒽降解菌的分离鉴定与降解条件优化[J]. 安徽农业科学, 2014, 10(10): 2998-3002. DOI:10.3969/j.issn.0517-6611.2014.10.066 |
| [32] |
顾平, 张倩茹, 周启星, 等. 一株苯并[a]芘高效降解真菌的筛选与降解特性[J]. 环境科学学报, 2010, 30(2): 354-360. |




