地衣是研究重金属元素大气沉降特征的良好材料,一直以来可作为监测大气及土壤重金属污染物的一种有效指示剂。由于地衣体不具有高等植物所具有的真皮层和蜡质层,环境中的污染物质很容易进入并聚集在地衣体内,并对其产生伤害。有些地衣种类的重金属浓度远高于外界环境,铜含量高达其干重的5%,对于其他生物而言,这个浓度远超于它们的耐受性[1-3]。1982年,Goyal等[4]发现2种地卷属地衣(Peltigera canina和Peltigera rufescens)以地衣体变小、假根变短、地衣体颜色变暗等方式适应富含重金属的生长环境;2006年,Monnet等[5]研究报道,0.25 mmol/L铜处理条件下,对地衣Dermatocarpon luridum活性没有影响,而且地衣抗氧化酶活性随时间的延长而增加,超量铜(大于0.50 mmol/L)处理条件下,Dermatocarpon luridum地衣抗氧化酶活性随时间的延长而降低;2006年Backor等[6]发现,较高浓度的Cu胁迫导致GSH显着降低,可能是由于重金属诱导的谷光甘肽(Glutathione,GSH)氧化为谷胱甘肽二硫化物(GSSG),因此表现出地衣Cladonia cristatella对铜胁迫下的响应;2007年Purvis等[7]研究发现Lecanora polytropa为铜超富集性地衣;2008年Dzubaja等[8]发现地衣Xanthoria parietina对重金属污染具有较高的耐性;Hauck等[9-10]研究报道,地衣体重金属胁迫下,地衣提取物的结合重金属的作用不是很明显;铜胁迫对地衣Evernia prunastri生理生化特征的影响,即随着铜浓度的增加地衣Evernia prunastri响应铜胁迫的抗氧化物含量增加,类胡萝卜素、叶绿素a、可溶性蛋白等含量减少[11]。2009年Backor等[12]通过对废弃铜矿周围富含铜基物表面生长的2种地衣(地卷Peltigera rufescens和鹿蕊Cladina arbusla)的元素含量、光系统活性、自由氨基酸及蛋白质含量等进行了研究,了解了这些地衣对富含铜基质的生理适应性的特点。在国内,2015年热依拉等[13]研究指出,不同浓度(1-4 mmol/L)Cu2+处理对地卷共生藻细胞结构无明显的影响,在所有处理条件下,地卷共生藻细胞壁、细胞膜均完整,且大多数共生藻细胞处于分裂状态,地卷对铜胁迫具有一定的耐性。
谷胱甘肽作为生物体内主要的还原肽之一,在生物体抵抗重金属胁迫中起着重要的调节作用,逆境条件下生物促进GSH的生物合成并保持较高的含量,通过增强膜蛋白的稳定性,发挥重要的抗氧化和整合重金属离子而起解毒作用,提高生物对逆境的耐性[14-17]。
随着工业化引起的重金属污染,生物重金属耐性及其机制研究以及耐性生物在环境重金属污染修复和治理中的应用引起国内外科研人员的广泛关注,其中,植物抗逆胁迫研究最多[18-21],与真菌相比,藻类的逆境胁迫研究报道较少[22-24],而地衣这类特殊生物的重金属胁迫及其机制研究报道更为罕见[25]。为了探讨菌藻共生的特殊生物地卷响应铜离子胁迫的差异及谷胱甘肽在低等生物地衣抗重金属胁迫中的作用,本研究以3种地卷为研究对象,首次对Cu2+胁迫下地卷GSH含量的变化进行研究,分析逆境胁迫环境条件下,地衣体诱导产生的GSH变化与地卷细胞内和细胞表面吸收铜之间的相关性,以探讨GSH缓解地衣重金属胁迫中的作用,为进一步探索地衣重金属胁迫耐性的机制提供参考依据。
1 材料与方法 1.1 材料3种地衣即地卷(Peltigera rufescens)、平盘软地卷(Peltigera elisabethae)和犬地卷(Peltigera canina),2014年10月采集于乌鲁木齐米泉林场哈熊沟,海拔高度为1 960-2 100 m。分类鉴定的地衣标本-20℃保存。
1.2 方法 1.2.1 Cu2+胁迫对地卷属3种地卷谷胱甘肽含量的影响以2种地衣即地卷和平盘软地卷为主要研究材料,用4种不同的方法(热水抽提法、乙醇抽提法、超声波乙醇抽提法和超声波水抽提法)提取地衣体的GSH进行测定[26]。
不同浓度CuSO4胁迫处理3种地卷,选最佳GSH提取方法分离提取GSH,研究Cu2+胁迫对3种地卷GSH含量的影响。具体操作如下:准备空培养皿放入滤纸,滤纸上喷洒不同浓度(1、2、3、4、5、6、7和8 mmol/L)的CuSO4溶液10 mL,每种质量浓度设3个重复,蒸馏水作为对照。从采集样本中筛选出新鲜、大小相等的地衣体材料(地卷、平盘软地卷和犬地卷)用蒸馏水清洗地衣体表面的杂物后,分别放入以上喷洒CuSO4的滤纸上,盖上培养皿盖,放入光照培养箱内,18-20℃放置6、12、18和24 h后,用蒸馏水洗涤地卷上的CuSO4溶液,滤纸吸干后放入烘箱烘干,然后研磨成粉末状态,分离提取GSH,λ412nm测定吸光度。
1.2.2 地卷Cu2+吸收性的研究将地衣体用10 mL的20 mmol/L Na2-EDTA反复冲洗20 min,然后10 mL的去离子水冲洗20 min,2次冲洗的溶液混合在一起用吸附于细胞表面的铜含量测定;外表面冲洗后的地衣体,90℃烘干12 h,用研磨体研磨成粉状备用。烘干的地衣体加入消化液(6 mL的65% HNO3加3 mL的30%过氧化氢后蒸馏水定容至10 mL)90℃消化12 h,定容至10 mL,离心过滤去处残渣,测定细胞内铜含量,每个质量浓度设3个重复。
1.2.3 测定指标采用DTNB法[26](分光光度计,λ412nm)进行GSH含量测定,用μg/mg表示。用火焰原子吸收原子吸收法[27]测定铜含量,用μg/mg表示。
1.2.4 数据处理采用Excel 2010及SPSS 22.0软件进行数据处理与方差分析和(0.05和0.01水平)多重比较。
2 结果 2.1 地衣体中GSH提取方法及GSH含量测定方法过量的DTNB溶液中最大吸收波长(λ412nm)处的吸光度与GSH浓度具有良好的线性关系,其标准方程为y=0.014 4x-0.003,相关系数为R2=0.999 5。
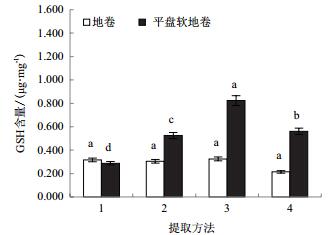
用4种方法分别从地卷和平盘软地卷提取GSH并测定含量(图 1),发现无论哪种方法,对地卷GSH含量的几乎无影响,差异不显著(P > 0.05);而平盘软地卷中,超声波乙醇提取法所提取的GSH含量最高(P < 0.01),此方法操作简单,适合实验室操作,因此,确定该方法为地衣体内提取GSH的首选方法。
|
| 图 1 各种提取方法的比较 1:热水提取法;2:乙醇提取法;3:超声波乙醇提取发;4:超声波水提取法。图中不同字母表示差异显著(P < 0.05)。下同 |
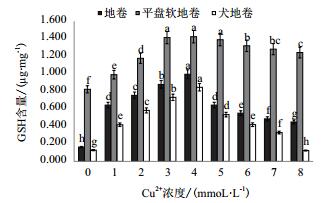
如图 2所示,3种地衣分别用不同浓度Cu2+(1-8 mmol/L)处理24 h后,GSH含量的变化具有一定的差异。Cu2+浓度≤4 mmol/L时,随着胁迫浓度的提高,3种地卷的GSH含量均逐步增加,4 mmol/L时到达最高值,地卷和犬地卷的GSH含量,与对照相比,分别增加了6.08和6.62倍,Cu2+浓度(≥5 mmol/L)时,才开始出现明显的下降,但GSH含量均高于对照组(P < 0.05)。平盘软地卷自身具有较高的GSH,Cu2+浓度为4 mmol/L时,与对照相比,仅增加了1.7倍,Cu2+浓度3-5 mmol/L范围内时,GSH含量变化差异不显著,Cu2+浓度(≥6 mmol/L)开始较明显的下降(P < 0.05)。基于本研究结果结合前期研究结果[13],可初步确定3种地卷的铜耐受性范围为4-5 mmol/L并在4 mmol/L Cu2+胁迫下,不同处理时间对GSH含量的影响进行进一步研究。
|
| 图 2 不同浓度Cu2+胁迫对3种地卷地衣体内GSH含量的影响 |
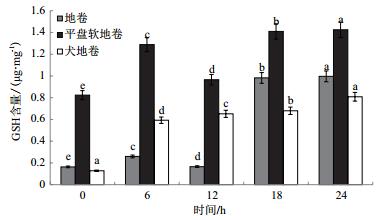
4 mmol/L Cu2+胁迫下处理不同时间时,地卷和平盘软地卷的GSH含量的变化趋势类似,出现波动性变化;处理时间为6 h时GSH含量略有增加,增加量分别为对照的1.58和1.56倍;处理时间延长到12 h时,GSH含量不再继续上升却出现一定量的下降;处理时间 > 16 h时,GSH含量重新又表现为逐步上升趋势,18-24 h含量基本稳定,24 h时达到最高值(分别为对照的6.07和1.73倍)。犬地卷中,4 mmol/L Cu2+胁迫处理时间6 h时,GSH增加量最明显并呈逐步增加趋势,24 h到最高值(为对照的6.32倍)(图 3)。3种地卷响应重金属胁迫使最高GSH含量的Cu2+浓度为4 mmoL/L,但处理时间的不同,GSH含量的变化趋势存在差异。
|
| 图 3 Cu2+胁迫下处理时间对几种地卷GSH含量的影响 |
通过对不同浓度Cu2+胁迫下3种地卷细胞表面铜含量的测定(表 1),其吸附能力随着浓度的提高而增加(P < 0.01),Cu2+浓度4 mmol/L时达最高值,与对照相比,分别增加了3568、55.27和4 413倍。3种地卷随浓度的增加细胞内所吸收铜含量的变化却有所差异:地卷中随Cu2+浓度的增加,细胞内所吸收铜含量的变化呈高-低-高的趋势,Cu2+浓度2 mmol/L时到最高值(为对照的381.4倍),3 mmol/L时稍微减少后继续增加。平盘软地卷中随Cu2+浓度的增加细胞内所吸收铜含量的变化呈高-低-高的趋势,2 mmol/L时略下降后继续增加,4 mmol/L到最高值(为对照的7.52倍)。犬地卷中随Cu2+浓度的增加细胞内所吸收铜含量的变化呈现先增加后下降的趋势,Cu2+浓度2 mmol/L时到最高值(为对照的6 528.7倍),3-4 mmol/L时细胞内所吸收铜含量有所下降,但仍高于对照组(P < 0.05)。平盘软地卷对照组细胞内就具有较高含量的铜,并且细胞内所吸收铜含量的变化不如地卷和犬地卷明显。
2 mmol/L Cu2+浓度胁迫处理条件下,随着胁迫处理时间的延长,3种地卷的细胞内所吸收的铜含量和吸附于细胞外表面的铜含量的变化存在一定的差异。
2.5.1 细胞内所吸附的铜含量变化地卷和平盘软地卷细胞内铜含量呈先升后下降趋势;12 h时地衣体吸收铜含量达到最高值,与对照相比较分别增加44.40倍和3.95倍;不同与其它两种地卷,犬地卷所吸收的铜含量变化呈现逐渐上升趋势,24 h时到最高值,与对照相比较增加6.52倍(P < 0.01)。
2.5.2 卷细胞外表面所吸附的铜含量变化平盘软地卷和犬地卷细胞外表面吸附铜含量随着处理时间的延长逐步上升,24 h时到最高值,与对照相比较分别增加41.64和71.67倍,增加量非常显著,地卷细胞外表面吸附的铜含量变化不同于前2种地卷呈先升高后下降趋势,6 h时就达最高值,且增加量非常显著,与对照相比较增加2 434倍(表 2)。
4 mmol/L Cu2+浓度胁迫条件下,随着胁迫处理时间的延长,3种地卷的细胞内所吸收的铜含量和吸附于细胞外表面的铜含量的变化也存在差异。
(1)细胞内所吸收的铜含量的变化趋势:随着胁迫时间的延长,地卷细胞内的铜含量呈先上升后下降趋势,12 h到最高值(为对照的442.20倍);平盘软地卷胞内铜含量表现为逐步增加,达12 h有一定下降后继续增加,24 h达最高值(为对照的7.52倍,P < 0.01);犬地卷的细胞内铜含量也逐步增加,24 h达最高值(为对照的5.77)。3种地卷中侵入细胞内的铜含量的变化出现先升高,后下降的趋势,很可能与细胞内的相关代谢途径或酶活性的铜离子解毒作用密切相关。Cu2+胁迫下,不同处理浓度和不同处理时间下,3种地卷谷胱甘肽含量的变化趋势(图 2,图 3)与细胞内铜含量的波动性变化较吻合,说明高等植物中参与重金属诱导有害物质清除的谷胱甘肽(生物抵御胁迫响应的重要指标之一),在地衣这种菌藻共生的地等生物中也发挥重金属解毒作用,以缓解重金属胁迫对生物体的毒害作用。
(2)吸附于细胞外表面的铜含量的变化趋势:地卷吸附于细胞外表面的铜含量6 h内迅速增加到最高值(为对照的5 017倍),6-12 h内有一定的下降后继续增加(P < 0.01);平盘软地卷细胞外表面铜含量随胁迫时间的延长呈逐步增加趋势,24 h到最高值(对照的41.69倍,P < 0.01);犬地卷中胁迫处理时间12 h时,吸附于细胞外表面的铜含量有一定下降后继续增加,24 h达最高值(为对照的139.21倍,P < 0.01)(表 2)。研究结果显示,铜离子胁迫条件下,地卷属3种地衣吸附于细胞外表面的铜含量显著高于细胞内所吸收的铜含量,可见地卷尽可能将重金属离子铜吸附于细胞外表面,而阻止其进入细胞内,响应重金属胁迫对生物体产生的伤害。
3 讨论铜是生物生长所需的微量元素之一,对绿色植物体的光合作用、细胞的呼吸作用、细胞代谢、细胞内的各种化学反应等方面起着主要的作用[28-29],但当生物铜含量一旦超过阈值就会对生物体产生毒害作用,也是造成生态环境污染的主要污染物。铜对植物造成毒害的同时,植物也会产生相应的解毒机制,如GSH和植物络合素(PCs),在植物对重金属解毒过程中合成的重要含巯基化合物[30]。GSH是植物金属螯合态(PCs)的直接前提,这些PCs可以与重金属形成螯合物转运到液泡内隔离[31-32];生物体在逆境条件下保持较高含量的GSH含量,有效地还原植物细胞中-S-S-键,加强膜蛋白的稳定性,提高植物对逆境的抗性和适应性[33]。GSH在地衣这类低等生物抗重金属胁迫中的作用罕见相关报道。因此,本研究以3种地卷为主要研究对象,主要对不同浓度铜胁迫处理不同时间下,吸附于地衣体细胞外表面的铜含量和细胞所吸收的铜含量与地衣体谷胱甘肽含量变化的相关性进行研究,以确定谷胱甘肽在地衣生物抵抗重金属胁迫的作用。研究结果发现,重金属胁迫下3种地卷属地卷铜吸附能力和GSH含量的变化之间确实存在一定的相关性;未经铜离子胁迫处理的对照组中,地卷和犬地卷中细胞内含有极微量铜(胞外铜含量为零),GSH含量也很低,1 mmol/L Cu2+胁迫条件下,地卷和犬地卷细胞内所吸收的铜含量迅速上升,GHS含量也出现迅速增加(分别为对照的3.92和3.28倍);随着胁迫浓度的增加(≥2 mmol/L),地卷和犬地卷细胞内铜含量没有出现继续增加,反而略有下降趋势并仍高于对照组,GSH含量却随着胁迫浓度的提高和处理时间的延长出现逐步增加的趋势,当4 mmol/L Cu2+胁迫处理时,地卷中细胞内铜含量和GSH含量6 h就迅速增加(分别为照的1 126和4.64倍),随后基本稳定,犬地卷随时间的延长进入细胞内的GSH含量和铜含量逐步增加,说明GSH可能与细胞所吸收铜的解毒密切相关。与同样生境采集的地卷和犬地卷不同,平盘软地卷对照组细胞内(245 µg/g)和胞外(75.5 µg/g)均具有较高含量的铜和细胞内的GSH含量(0.823 6 µg/mg),随着胁迫浓度的增加,平盘软地卷细胞内GSH含量也呈现逐步增加。研究表明,重金属胁迫下,植物GSH含量与还原酶活性显著升高[34],Cu2+浓度(1-4mmol/L)时,细胞内铜含量的增加会促进的GSH的诱导合成;浓度继续增加超过地衣体耐受能力时,虽然GSH含量逐步下降仍然高于对照组(P < 0.05),表明细胞内铜富集和GSH含量变化之间存在正相关性关系,在抵御逆境胁迫过程中,菌藻共生的特殊生物——地卷类似高等植物可诱导合成GSH缓解Cu2+胁迫对地衣体的毒害作用,因此不同地衣物种诱导合成GSH的能力和铜吸附性之间的相关性研究可作为评价其响应Cu2+胁迫差异的重要参考指标之一。
4 结论3种地衣体将重金属吸附于表面,阻止其进入地衣体内是地衣抗重金属胁迫的一种有效措施,分布于地衣体周围的地衣型真菌通过这种方式对其共生藻(位同时间内一定浓度Cu2+胁迫下处理,3种地于地衣体内部)提供保护,使共生藻避免了重金属铜的毒害作用;在抵御逆境胁迫过程中,菌藻共生的特殊生物——地卷类似高等植物可诱导合成GSH缓解Cu2+胁迫对地衣体的毒害作用,且地衣抵抗重金属铜的能力存在一定的差异。
| [1] |
Nieboer E, Richardson SH, Tomassini FD. Mineral uptake and release by Lichens:an overview[J]. Bryologist, 1978, 81(2): 226-246. DOI:10.2307/3242185 |
| [2] |
Garty J. Biomonitoring atmospheric heavy metals with lichens[J]. Theory and Application, Critical Reviews in Plant Sciences, 2001, 20(4): 309-317. DOI:10.1080/20013591099254 |
| [3] |
Yemets O, Gauslaa Y, Solhaug KA. Monitoring with lichens-Conductivity methods assess salt and heavy metal damage more efficiently than chlorophyll fluorescence[J]. Ecological Indicators, 2015, 55: 59-64. DOI:10.1016/j.ecolind.2015.03.015 |
| [4] |
Goyal R, Seaward M. Metal uptake in terricolous lichen[J]. New Phytol, 1982, 90(1): 85-98. DOI:10.1111/nph.1982.90.issue-1 |
| [5] |
Monnet F, Bordas F, Deluchat V, et al. Toxicity of copper excess on the lichen Dermatocarponluridum:Antioxidant enzyme activities[J]. Chemosphere, 2006, 65(10): 1806-1813. DOI:10.1016/j.chemosphere.2006.04.022 |
| [6] |
Backor M, Pawlik-Skowrnska B, Tomko J, et al. Response to copper stress in aposymbiotically grown lichen mycobiont Cladonia cristatella:uptake, viability, ergosterol and production of nonprotein thiols[J]. Mycol Res, 2006, 110(8): 994-999. DOI:10.1016/j.mycres.2006.05.007 |
| [7] |
Purvis OW, Pawlik-Skowronska B, Avery SV et al. Stress in yeasts and filamentous fungi[M]. Elsevier, Amsterdam, The Netherlands, 2008:175-200.
|
| [8] |
Dzubaja A, Backor M, Tomkob J, et al. Tolerance of the lichen Xanthoria parietina(L.)Th. Fr. to metal stress[J]. Ecotoxicology and Environmental Safety, 2008, 70(2): 319-326. DOI:10.1016/j.ecoenv.2007.04.002 |
| [9] |
Hauck M. Metal homeostasis in hypogym-niaphysodes is controlled by lichen substances[J]. Environmental Pollution, 2008, 153(2): 304-308. DOI:10.1016/j.envpol.2007.08.023 |
| [10] |
Hauck M, Jürgens SR, Willenbruch K, et al. Dissociation and metal-binding characteristics of yellow lichen substances suggest a relationship with site preferences of lichens[J]. Annals of Botany, 2009, 103(1): 13-22. DOI:10.1093/aob/mcn202 |
| [11] |
Vantová I, Klejdus M, Backor-ová M, et al. Copper uptake and copper-induced physiological changes in the epiphytic lichen Evernia prunastri[J]. Plant Growth Regulation, 2013, 69(1): 1-9. DOI:10.1007/s10725-012-9741-z |
| [12] |
Backor M, Klejdus B, Vantová I, et al. Physiological in the lichens Peltigera rufescens and Cladina arbuslavar mitis, and the moss Racomitrium lanuginosum to copper-rich substrate[J]. Chemosphere, 2009, 76(10): 1340-1343. DOI:10.1016/j.chemosphere.2009.06.029 |
| [13] |
热依拉·热合曼, 帕提古丽·依明, 阿布都拉·阿巴斯, 等. Cu2+胁迫对两种地衣细胞结构的影响[J]. 西北植物学报, 2015, 35(1): 7-64. |
| [14] |
Foyer CH, Lopez-Delgado H, Dat J F, et al. Hyd-rogen peroxide and glutathione-associated mech-anisms of acclamatory stress tolerance and signaling[J]. Plant Physiology, 1997, 100: 241-254. DOI:10.1111/ppl.1997.100.issue-2 |
| [15] |
Metwally A, Safronova VI, Belimov AA, et al. Genotypic variation of the response to cadmium toxicity in Pisum sativum L.[J]. J Exp Bot, 2005, 56: 167-178. |
| [16] |
Freeman JL, Salt DE. The metal tolerance profile of Thlaspi goesingense is mimicked in Arabidopsis thaliana heterologously expressing serine acetyl-transferase[J]. BMC Plant Biology, 2007, 7: 63-71. DOI:10.1186/1471-2229-7-63 |
| [17] |
Sun Q, Ye ZH, Wang XR, et al. Cadmium hyper-accumulation leads to an increase of glutathione rather than phytochelatins in the cadmium hyperaccumulator Sedum alfredii[J]. Plant Physiology, 2007, 164: 1489-1498. DOI:10.1016/j.jplph.2006.10.001 |
| [18] |
李娟, 全占军, 张春晖, 等. 植物铜耐性机理的研究进展[J]. 生态毒理学报, 2016, 11(3): 53-60. |
| [19] |
谭九洲, 黄迎波. 植物重金属耐受分子机理的研究进展[J]. 安徽农业科学, 2014, 42(35): 12782-12785. DOI:10.3969/j.issn.0517-6611.2014.35.142 |
| [20] |
薛亮, 刘建锋, 史胜青, 等. 植物响应重金属胁迫的蛋白质组学研究进展[J]. 草业学报, 2003, 22(4): 300-311. |
| [21] |
Grill E, Winnacker EL, Zenk MH. Phytochelatins:the principal heavy -metal complexing peptides of higher plants[J]. Science, 1985, 230(4726): 674-676. DOI:10.1126/science.230.4726.674 |
| [22] |
刘原志, 章强强. iTRAQ技术在真菌研究中的应用进展[J]. 中国真菌学杂志, 2015, 10(3): 185-189. DOI:10.3969/j.issn.1673-3827.2015.03.020 |
| [23] |
Wu JT, Chieh CShih, Chou Tl. Intracellular proline accumulation in some algae exposed to copper and cadmium[J]. Botanical Bulletin of Academia, 1995, 36(2): 89-93. |
| [24] |
Wu JT, Hsieh MT, Kow LC. Role of proline accumulation in response to toxic copper in Chlorella sp. (Chlorophyceae)cells[J]. Plant Growth, 1998, 34(1): 113-117. |
| [25] |
Backor M, Loppi S. Interactions of lichens with heavy metals[J]. Biol Plantarum, 2009, 53(2): 214-222. DOI:10.1007/s10535-009-0042-y |
| [26] |
范宗东, 王淼, 卫功元, 等. 谷胱甘肽测定方法研究进展[J]. 生物技术, 2004, 14(1): 3-15. DOI:10.3969/j.issn.1004-311X.2004.01.002 |
| [27] |
谢苏婧, 谢树莲, 谢宝妹. 藻类植物中钙、镁、铁、锰、铜和锌含量分析[J]. 光谱学与光谱分析, 2003, 23(3): 615-616. DOI:10.3321/j.issn:1000-0593.2003.03.058 |
| [28] |
Tomsett BA. Molecular biology of metal to tolerance of plants[J]. Plant Cell & Environment, 2010, 11(5): 383-394. |
| [29] |
王狄, 李锋民, 熊治廷, 等. 铜的植物毒性与植物蓄积的关系[J]. 土壤与环境, 2000, 9(2): 146-148. DOI:10.3969/j.issn.1674-5906.2000.02.017 |
| [30] |
Noctor G, Gomez L, Vanacker H, et al. Interacti-on between biosynthesis, compartmentation and transpot in the control of glutathione homeostasis and signaling[J]. Jornal of Experimental Botany, 2002, 53: 1283-1304. DOI:10.1093/jexbot/53.372.1283 |
| [31] |
Ha SB, Smith AP, Howden R, et al. Phytochela-tinsyntheas genes from Arabidopsis and the yeast Schizosac charomyces pombe[J]. The Plant Cell, 1999, 11: 1153-1164. DOI:10.1105/tpc.11.6.1153 |
| [32] |
Kim DY, Bovet L, Kushnir S, et al. AtATM3 is involved in heavy metal resistance in Arabidopsis[J]. Plant Physiology, 2006, 140: 922-932. DOI:10.1104/pp.105.074146 |
| [33] |
Parisy V, Poinssot B, Owsianowski L, et al. Identification of PAD2 as agamma-glutamylcysteine synthetase highlights the importance of glutathione in disease resistance of Arabidopsis[J]. Plant J, 2007, 49: 159-172. |
| [34] |
Noctor G, Foyer GH. Ascorbate and glutathione:Keeping active oxygen under control[J]. Annual Review of Plant Physiology and Plant Molecular, 1998, 49: 249-279. DOI:10.1146/annurev.arplant.49.1.249 |






