牡丹是中国的传统名贵木本花卉,其不但具有很好的观赏价值与药用作用,同时还有较高的油用价值,牡丹籽油中含有丰富的不饱和脂肪酸,亚麻酸、亚油酸和油酸,具有抗肿瘤、抗炎、改善心血管和调节免疫等医疗保健等功能[1-2]'凤丹'牡丹(Paeonia ostii 'Feng Dan')为牡丹野生种杨山牡丹的栽培品种,是中国油用牡丹主栽品种,占到目前油用牡丹栽培面积的90%以上。组织培养作为一种新型的育种方式能够加快繁殖速度并保持亲本的优良性状,更加有利于新品种的选育工作,并能在一定程度上克服传统繁殖方法存在的弊端[3]。在'凤丹'牡丹组织培养方面已经有许多学者进行了尝试并且取得了一定的成果,外植体涉及离体胚[4]、鳞芽[5-7]等,但是在实验过程中均发现组培材料褐变是'凤丹'牡丹快速繁殖的一大障碍,导致其产业化生产受限。该方面的研究相对匮乏,使得防褐剂在褐变过程中的作用机理还不够明确。
褐变现象是指在建立外植体时,切口附近的细胞受到伤害,分泌酚类化合物,在溢出过程中与外界氧气发生氧化反应被迅速氧化变成褐色,外植体也随之发生褐变进而死亡的现象[8-9]。本课题组在前期研究中发现,硝酸银作为防褐剂能够有效抑制'凤丹'牡丹组培过程中的褐变现象,并确定了以'凤丹'牡丹芽为材料最适的培养基为MS+1.0 mg/L 6-BA+0.2 mg/L NAA,成活率为64.32%[6]。另一方面,现有研究普遍认为酶促褐变是组织培养过程中引起褐变的主要原因,酚类物质作为该反应的底物,其存在直接影响着褐变发生的水平[10],已有研究表明,在培养基中添加硝酸银能够影响葡萄[11]和胡椒[12]愈伤组织中酚类物质的含量,进一步说明硝酸银作为防褐剂与柠檬酸的抗氧化能力以及活性炭的吸附方法不同,是通过影响酚类物质,进而从褐变的源头控制组培材料的褐变进程的。而类黄酮类化合物作为高等植物中一类次生代谢产物也是酚类物质中种类最丰富的分支,其含量与褐变息息相关[13]。综上所述,本次研究中选取了在多酚类物质合成途径中有着重要的生物学功能的转录因子和部分关键的酶类进行实时定量检测,通过分析硝酸银对愈伤组织中酚类物质含量极类黄酮合成路径相关基因的影响,探究硝酸银对牡丹组培苗愈伤组织褐变进程的影响,为'凤丹'牡丹褐变深层次原因分析以及新型防褐剂的开发和使用方法提供理论支持。
1 材料与方法 1.1 材料 1.1.1 材料选取同一时期培育的'凤丹'牡丹生长健壮、无褐化、生长量相同的组培苗。
标准样品:芦丁、绿原酸、香豆酸、根皮苷购自天津易方科技有限公司;儿茶素、表儿茶素、槲皮素,购自金测分析技术有限公司。
1.1.2 主要仪器和试剂Applied Biosystems StepOne Plus实时定量PCR仪(Applied,美国);紫外可见分光光度计(岛津UV-2450);高效液相色谱仪(日立L-2000,检测器为L-2490DAD)。
北京百泰克生物技术公司的通用植物总RNA提取试剂盒及其配套的除DNA酶试剂、TaKaRa公司生产的cDNA第一链合成试剂盒(PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)以及TaKaRa TaqTM Version 2.0聚合酶、PrimeSTAR HS DNA Polymerase聚合酶、以及实时荧光定量试剂SYBR® Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)。
1.1.3 实验处理选取生长健壮,无污染无褐化现象出现的组培苗接种至含有1.0、2.0、3.0、4.0、5.0 mg/L硝酸银的培养基(MS+1.0 mg/L 6-BA+0.2 mg/L NAA)中,以不加硝酸银的培养基为对照(CK),共6个组合,组合内设置3组重复,每组20个外植体,在常规条件下(温度25±1℃,光强36 μmol·m-2·s-1,光照时间12 h/d)进行诱导培养。在将材料转接至含有硝酸银的培养基后7 d左右切口处将逐渐长出愈伤组织,在转接后10 d、30 d、50 d取材统计测量相关数据。
1.2 方法在转接后10 d、30 d、50 d进行取材,实验过程中的褐变程度、总酚及单体酚含量测定阶段,对每个时期的对照组和5个处理组都进行统计。荧光实时定量阶段,只选取对照组和处理组中生长情况最佳的1组进行对比分析。
1.2.1 褐变分级褐变级别根据愈伤组织褐色颜色深浅划分为五个等级,用1、2、3、4、5分别表示(图 1)。对每组中的20个外植体进行打分,取加权平均值作为每组的最终褐化等级。
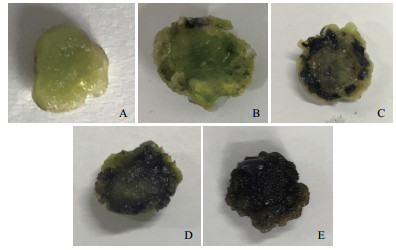
|
| 图 1 ‘凤丹’牡丹愈伤组织褐变程度的五个等级 A:褐化1级,无明显褐化现象;B:褐化2级,出现褐化斑点;C:褐化3级,边缘明显褐化;D:褐化4级,褐化蔓延至中部;E:褐化5级,完全褐化 |
粗提取液制备:取经处理的愈伤组织进行冷冻干燥;精确称取粉末0.03 g,用1.5 mL甲醇浸提,超声提取60 min,浸提结束后,4 000 r/min离心10 min,收集上清液备用。
多酚含量测定参考Yi等[14]方法并略作修改。将没食子酸用灭菌去离子水溶解成浓度为104 μg/mL的标准液,分别将标准液0、0.10、0.30、0.50、0.80与1.00 mL置于10 mL离心管中,然后依次加入1.70 mL 20%的Na2CO3·10H2O溶液以及500 μL稀释一倍的Folin-Ciocalteu试剂,蒸馏水定容。避光放置90 min后,测定吸光值(最大吸光值765 nm处),标曲为y=0.1196x(R2=0.9970),x的单位是μg/mL。吸取100 μL提取液,按标准曲线步骤反应后测吸光度,结果以每百克干样所含没食子酸的当量毫克数(mg/100 g DW)表示。
单体酚种类和含量测定:将上清液用0.22 μm微孔滤膜过滤,滤液为待测提取液,进样量为0.5 mL;利用高效液相色谱仪测定单体酚种类及含量,设定参数为Lachrom-C18柱,5 µm,250 mm×4.6 mm,进样量10 µL,柱温箱的温度40℃。流动相有两个,A:0.04%的甲酸水,B:乙腈(色谱级)。梯度洗脱(流速为0.5 mL/min):0到40 min,A为95%-0,B为5%-100%;40-60 min,B为100%。
1.2.3 实时荧光定量PCR(1) RNA的提取和cDNA第一链合成:参照北京百泰克生物技术公司生产的通用植物总RNA提取试剂盒说明书提取'凤丹'牡丹愈伤组织总RNA,对总RNA进行浓度、完整性等质量检验后将其浓度调整至1 µg/µL,-80℃保存备用。采用TaKaRa公司生产的试剂盒合成cDNA第一链。
(2) 类黄酮合成途径关键基因定量分析:根据Zhang等[15]和Zhao等[16]对牡丹类黄酮合成途径的研究,选取了在酚类物质合成过程中具有关键作用的转录因子和结构基因,使用软件Primer 5.0设计PCR引物(表 1)。荧光定量在Applied Biosystems StepOne Plus实时定量PCR仪中进行,以牡丹β-微管蛋白基因beta-Tubulin(登录号:EF608942)为内参,反应体系含2.0 µL浓度为50 ng/µL的cDNA、0.8 µL上下游引物(引物溶解浓度为10 µmol),6.0 µL的ddH2O和10 µL SYBR Premix Ex Taq Ⅱ。
反应程序为95℃预变性10 min,95℃变性5 s,60℃退火30 s,72℃延伸31 s,循环45次,每组处理3个重复。反应结束后采用2-ΔΔCT法[17]分析荧光值变化曲线和溶解曲线。
1.2.4 数据统计分析在探究硝酸银对'凤丹'牡丹愈伤组织褐化控制作用试验中,每组试验设不同处理,根据培养基中加入的硝酸银浓度的不同设不同处理组,共6个组合,每个组合中设置3组重复,每组20个外植体,获得的数据采用SPSS22.0统计分析软件,进行方差分析及差异性显著检验。
2 结果 2.1 硝酸银浓度对组培苗褐变程度的影响不同浓度的硝酸银处理下,通过对褐变程度的分级可以发现(表 2),添加硝酸银能够明显抑制牡丹组培苗的褐变,随着硝酸银浓度的增加,褐化抑制效果先有所提高,但超过3 mg/L后抑制效果开始明显下降,综合各方面表现,当硝酸银浓度为2 mg/L的处理组对褐化的抑制综合效果最好。并且随着培养时间的增加,不同浓度硝酸银处理组之间的褐变差异也逐渐明显。
紫外分光光度计检测结果(图 2)表明,在'凤丹'牡丹愈伤组织褐化过程中,其总酚含量随着培养时间的延长而逐渐升高。3个培养阶段对照组的总酚含量均高于处理组。培养10 d时不同处理的实验材料初步表现出一定的差异,随着培养时间延长差异逐渐增大,50 d时呈现出显著差异。各个取材阶段中随着AgNO3浓度的增加,总酚含量先减少后升高。其中,AgNO3浓度为2 mg/L时愈伤组织中的总酚含量在3个测试阶段均表现为各组最低。
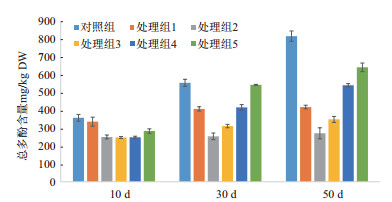
|
| 图 2 硝酸银浓度对‘凤丹’牡丹愈伤组织总酚含量的影响 对照组:培养基中不添加AgNO3;处理组1到5:培养基中AgNO3浓度分别为1.0、2.0、3.0、4.0、5.0 mg/L。下同 |
分析'凤丹'牡丹愈伤组织甲醇萃取液在280 nm波长下的高效液相色谱检测结果(图 3),可以鉴定出6种单体酚,分别是芦丁、绿原酸、对香豆酸、香豆酸、二氢槲皮素、表儿茶素。这些单体酚的含量随着培养时间的增加逐渐升高,其中芦丁含量最高且相较其他几种单体酚增幅也最大,说明芦丁在'凤丹'牡丹愈伤组织褐化过程中被氧化的最少。
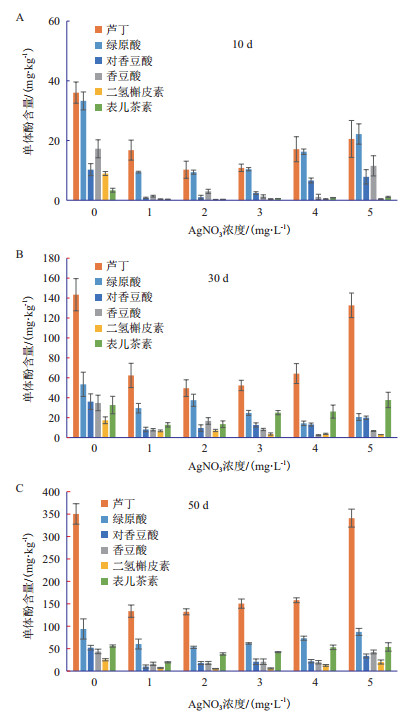
|
| 图 3 硝酸银对‘凤丹’牡丹愈伤组织单体酚含量的影响 A-C分别是:‘凤丹’组培苗在添加防褐剂的培养基上培养10 d、30 d、50 d |
与总酚含量测量结果一致的是,同一取材时间点对照组的6种单体酚含量均多于处理组,其中Ag-NO3浓度为2 mg/L时单体酚含量均表现为各组最低。
2.4 愈伤组织中类黄酮合成途径中关键基因表达分析荧光实时定量的分析结果(图 4)表明,'凤丹'牡丹愈伤组织中结构基因苯丙氨酸解氨酶(PAL)、黄烷酮醇还原酶(DFR)、查耳酮合酶(CHS)、查尔酮异构酶(CHI)、3-二氢黄酮羟化酶(F3H)、黄酮醇3'-羟化酶(F3'H),转录因子MYB2、WD40-1、WD40-2的表达量都随着培养时间的增加而增多,且在硝酸银处理的愈伤组织中的表达量明显低于对照组;转录因子bHLH1、bHLH3的表达量在3个取材时期没有清晰的变化趋势;花青素合成酶(ANS)的表达量在不同取材时期较为稳定。
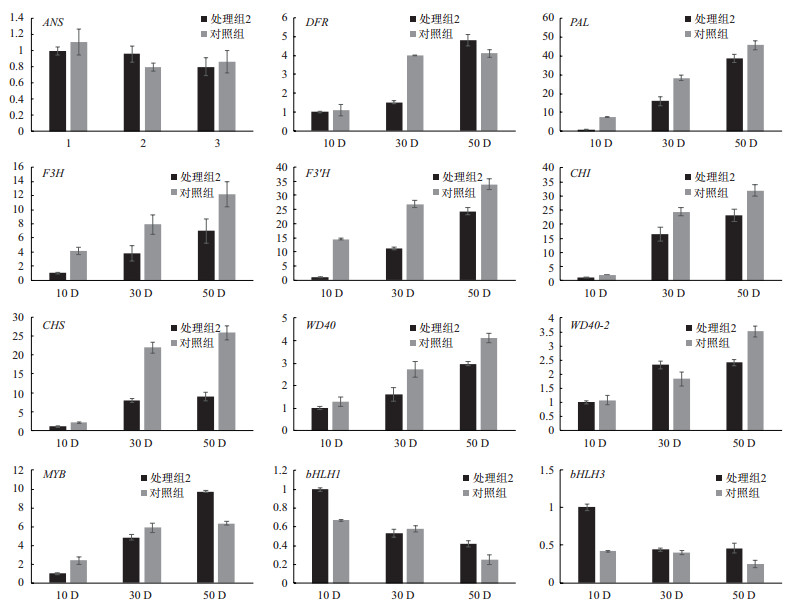
|
| 图 4 ‘凤丹’愈伤组织中类黄酮生物合成途径相关基因的相对表达量 采用Duncan's多重分析比较方法分析(P < 0.05,n=3) |
用SPSS22.0统计分析软件分析了本次试验测定的总酚含量、褐变等级与基因表达量的相关关系,结果表明,总多酚与褐变等级呈现极显著相关性(P < 0.01),转录因子MYB2、WD40-1、WD40-2与结构基因PAL、DFR、CHS、CHI、F3H、F3'H的表达量与褐变等级和总酚含量之间存在显著的相关性(P < 0.05)。ANS、bHLH1、bHLH3的表达量与褐变等级和总酚含量之间不存在相关性。
3 讨论'凤丹'牡丹是我国重要的油用牡丹栽培品种,牡丹籽油丰富的营养使其拥有很大的发展前景和市场需求,但是组织培养过程中的褐变问题严重影响了其产业化生产的进程。植物组织培养过程中发生的褐变主要是由酶促褐变引起的,而酚类物质作为酶促褐变反应中的底物,其含量与外植体褐变进程紧密相关[18-19]。硝酸银作为防褐剂在枇杷[20]、乌头[21]、葡萄[10]等材料的组织培养中已有应用。在设计的5个不同的硝酸银浓度处理中,当浓度为2.0 mg/L时对褐变的抑制效果最好,浓度持续升高反而会降低抑制效果,原因可能是,Ag+作为重金属浓度不断增加会破坏植物体内的酶蛋白结构,细胞的代谢活动因此受阻[22]。本实验结果表明,总多酚在褐变发生过程中与褐变程度呈正相关。这与许传俊等[23]在蝴蝶兰中研究结果一致。因此推测多酚含量应该是对'凤丹'牡丹愈伤组织褐变影响最大的因素。已有学者通过实验证明,减少酚类合成可以有效减轻褐变[24-25],本实验数据也反映出在培养基中加入硝酸银能够有效降低酚类物质合成,进而达到控制褐变的效果,验证了硝酸银能够影响酚类物质的合成[11-12]。实验中检测到的绿原酸、二氢槲皮素、香豆酸、对香豆酸、表儿茶素、芦丁的含量变化与材料的褐变水平相符合,同时这6种单体酚也曾在牡丹叶片中被检测出[26]。
在本次荧光实时定量选取的3个转录因子和6个结构基因的表达量都与实验材料的褐变程度呈现出显著的相关性。PAL(苯丙氨酸解氨酶)是类苯丙烷代谢途径的第一个酶,它调解植物初级代谢的碳流向类苯丙烷代谢途[27-28],是类黄酮合成的关键酶之一。Singh等[29]曾报道,PAL基因的表达与儿茶素类化合物的积累成正相关,本实验进一步验证了这一结论。CHS(查尔酮合成酶)是催化类黄酮生物合成的第一步反应,其催化合成的柚皮素查尔酮,经黄烷酮醇还原酶(DFR)、查尔酮异构酶(CHI)、3-二氢黄酮羟化酶(F3H)、黄酮醇3'-羟化酶(F3'H)催化生成各种不同的多酚类化合物[25-26]。本实验中,'凤丹'牡丹愈伤组织中随着褐变程度的加深CHS、CHI、DFR、F3H、F3'H这5个酶编码基因表达较对照组均呈现上调趋势,这与周天山等[30]在紫芽茶树中的实验结果一致,但是不同在于ANS在紫芽茶树中的两种叶色对比实验中也存在相关性变化,在本实验中不同褐变程度的愈伤组织中却没有体现出明显差异。这可能是因为选取的实验材料不同,与基因在不同的组织中存在特异性表达有关。另一方面,根据已有报道bHLH转录因子具有调节类黄酮生物合成的作用[31],但是本次实验结果中所定量的2个bHLH转录因子却没有表现出与褐变等级的相关性,分析原因可能是因为目前在已知范围内受bHLH转录因子调控的植物活性成分主要为花青素,据此可以推测花青素可能不属于引起牡丹愈伤组织的褐变的酚类化合物。
4 结论在'凤丹'牡丹初代培养基中添加不同浓度的硝酸银后,其组培苗愈伤组织的褐变均有不同程度降低,证实了硝酸银作为防褐剂能够在有效抑制褐变。当加入的硝酸银浓度为2.0 mg/L时组培材料的褐变程度为所有试验组中最低,且组培苗综合生长效果最好。硝酸银对组培苗褐变过程中产生影响的单体酚有绿原酸、芦丁、香豆酸、对香豆酸、表儿茶素、二氢槲皮素。荧光实时定量的检测结果表明,硝酸银通过影响转录因子MYB2、WD40-1、WD40-2和结构基因PAL、CHS、CHI、DFR、F3H、F3'H进而减少了酚类物质的合成,最终实现了减轻'凤丹'牡丹愈伤组织褐变的目的。
| [1] |
韩雪源, 张延龙, 牛立新, 等. 不同产地'凤丹'牡丹籽油主要脂肪酸成分分析[J]. 食品科学, 2014, 35(22): 181-182. DOI:10.7506/spkx1002-6630-201422034 |
| [2] |
陈慧玲, 杨彦伶, 张新叶, 等. 油用牡丹研究进展[J]. 湖北林业科技, 2013, 42(5): 42-44. |
| [3] |
曾端香, 尹伟伦, 赵孝庆, 等. 牡丹繁殖技术[J]. 分子植物育种, 2018, 16(2): 526-534. |
| [4] |
张子学, 丁为群, 时惟静, 等. 凤丹组织培养研究[J]. 现代中药研究与实践, 2004, 18(1): 18-21. |
| [5] |
王蒙蒙, 卜祥潘, 张倩, 等. '凤丹'离体快繁工厂化技术研究[J]. 分子植物育种, 2018, 16(2): 526-534. |
| [6] |
唐豆豆, 李厚华, 张延龙, 等. '凤丹'牡丹组织培养研究[J]. 西北林学院学报, 2016, 31(2): 160-166. DOI:10.3969/j.issn.1001-7461.2016.02.28 |
| [7] |
王新, 成仿云, 钟源, 等. '凤丹'牡丹鳞芽离体培养与快繁技术[J]. 林业科学, 2016, 52(5): 101-110. |
| [8] |
周俊辉, 周家容, 曾浩森, 等. 园艺植物组织培养中的褐化现象及抗褐化研究进展[J]. 园艺学报, 2000, 27(增): 481-486. |
| [9] |
Balakrishnamurthy G, Rao VNM. Changes in phenols during rhizogenesis in rose(Rosa bourboniana Desp.)[J]. Current Science, 1988, 57(17): 960-962. |
| [10] |
饶慧云, 邵祖超, 柳海宁, 等. 抗褐化剂对葡萄愈伤组织继代培养过程中酚类物质、相关酶及其基因表达的影响[J]. 植物生理学报, 2015, 51(8): 1322-1330. |
| [11] |
Sinan A, Cemil İ, Bengü TÜ. Effect of silver nitrate solvent on total protein, total phenolic and some antioxidant enzyme activities in cell suspension culture of capsicum annuum L.[J]. Turkish Journal of Agriculture, 2017, 5(12): 1544-1549. DOI:10.24925/turjaf.v5i12.1544-1549.1497 |
| [12] |
Treutter D. Significance of flavonoids in plant resistance:a review[J]. Environ Chem Lett, 2006, 4(3): 147-157. DOI:10.1007/s10311-006-0068-8 |
| [13] |
Yi OS, Meyer AS, Frankel EN. Antioxidant activity of grape extracts in a lecithin liposome system[J]. Journal of the American Oil Chemists Society, 1997, 74(10): 1031-1037. |
| [14] |
Zhang C, Wang W, Wang J, et al. Anthocyanin biosynthesis and accumulation in developing flowers of tree peony(Paeonia suffruticosa)'Luoyang Hong'[J]. Postharvest Biology and Technology, 2014, 97: 11-22. DOI:10.1016/j.postharvbio.2014.05.019 |
| [15] |
Zhao D, Tang W, et al. Identification of flavonoids and expression of flavonoid biosynthetic genes in two coloured tree peony flowers[J]. Biochem Biophys Res Commun, 2015, 459: 450-456. DOI:10.1016/j.bbrc.2015.02.126 |
| [16] |
Livaka KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25: 402-408. DOI:10.1006/meth.2001.1262 |
| [17] |
Asmus B, Hamme H. Enzymatic browning of vegetables Cali-Bration and Analysis of variance by Mutiway Methods[J]. Chemometrics Intelligent Laboratory Systems, 1996, 34(1): 85-102. DOI:10.1016/0169-7439(96)00019-6 |
| [18] |
Luo X, Tian Y, Yao H. Polyphenol oxidase activities and phenol contents in tissue culture[J]. Journal of Beijing Forestry University, 1999, 21: 92-95. |
| [19] |
郭倩. 不同培养基对'洛阳红'牡丹试管苗生长的影响[D]. 郑州: 河南科技大学, 2014.
|
| [20] |
崔文宁, 路培, 等. 防褐剂对枇杷叶片组织培养中褐化现象的抑制效应[J]. 中国南方果树, 2017, 46(5): 38-41. |
| [21] |
刘霞, 余马, 舒晓燕, 等. 乌头子根芽眼组织培养中抗褐化剂的筛选[J]. 中药材, 2015, 38(10): 2035-2037. |
| [22] |
许传俊, 李玲. 蝴蝶兰外植体褐变发生与总酚含量、PPO、POD和PAL的关系[J]. 园艺学报, 2006, 33(3): 671-674. DOI:10.3321/j.issn:0513-353X.2006.03.047 |
| [23] |
Hisaminato H, Murata M, Homma S. Relationship between the enzymatic browning and phenylalanine ammonialyase activity of cut lettuce, and the prevention of browning by inhibitors of polyphenol biosynthesis[J]. Biosci Biotechnol Biochem, 2001, 65(5): 1016-1021. DOI:10.1271/bbb.65.1016 |
| [24] |
Murata M, Nishimura M, et al. A transgenic apples callus showing reduced polyphenol oxidase activity and lower browning potential[J]. Biosci Biotechnol Biochem, 2001, 65(2): 383-388. DOI:10.1271/bbb.65.383 |
| [25] |
唐豆豆, 李厚华, 张延龙, 等. 变异紫斑牡丹红色叶色素与抗氧化活性分析[J]. 北方园艺, 2015(23): 79-86. |
| [26] |
Matsumoto S, Takeuchi A, Hayatsu M, et al. Molecular cloning of phenylalanine ammonium-lyase cDNA and classification of varieties and cultivars of tea plants(Camllia sinensis)using a tea PAL cDNA probe[J]. Theor Appl Genet, 1994, 89: 671-675. |
| [27] |
Olsen KM, Lea US, Slimestad R, et al. Differential expression of four Arabidopsis PAL genes:PAL1 and PAL2 have functional specialization in abiotic environmental-triggered flavonoid synthesis[J]. J Plant Physiol, 2008, 165: 1491-1499. DOI:10.1016/j.jplph.2007.11.005 |
| [28] |
Singh K, Kumar S, Rani A, Ph, et al. enylalanine ammonia-lyasa(PAL)and cinnamate 4-hydroxylase(C4H)and catechins(flavan-3-ols)accumulation in tea[J]. Funct Integr Genomic, 2009, 9: 124-134. |
| [29] |
周天山, 王新超, 余有本, 等. 紫芽茶树类黄酮生物合成关键酶基因表达与总儿茶素、花青素含量相关性分析[J]. 作物学报, 2016, 42(4): 525-531. |
| [30] |
张鑫, 宋经元, 等. bHLH转录因子调控植物活性成分生物合成的研究进展[J]. 药学学报, 2014, 49(4): 435-442. |