2. 中国农业科学院生物技术研究所,北京100081;
3. 中国农业科学院植物保护研究所/植物病虫害生物学国家重点实验室,北京 100193;
4. 东北农业大学生命科学学院,哈尔滨 150030
2. Biotechnology Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081;
3. Institute of Plant Protection, Chinese Academy of Agricultural Sciences/State Key Laboratory for Biology of Plant Diseases and Insect Pests, Beijing 100193;
4. Northeast Agricultural University, School of Life Science, Harbin 150030
玉米是我国三大农作物之一,种植面积和产量居三大作物之首[1]。2016年玉米播种面积为3.677×107 hm2,年产量约为2.2亿吨。我国虽然能实现主粮的基本自给,但农产品缺口较大,2013年玉米籽粒进口326.42万吨,2014年玉米籽粒进口259.90万吨。病虫害是造成玉米减产的重要因素之一,玉米每年受螟虫危害的面积超过2.335×107 hm2,约占种植总面积的70%,2013年造成减产639万吨、2014年造成减产544.78万吨。害虫危害不仅直接造成减产,还常引发玉米穗腐病,进而使籽粒中真菌毒素含量增高,品质下降[2]。因此,迫切需要安全有效的措施控制虫害,减少农业生产投入,增加农民收入。
传统防治虫害是在生长过程中喷施化学杀虫剂和生物防治。但前者不仅能杀死害虫,也能杀死害虫的天敌,农药残留问题还会造成部分农民中毒伤亡,害虫的耐药性增加,也导致农药用量增加,破坏生态平衡、污染环境;后者释放赤眼蜂等方法受气候条件影响较大,防治效果不理想[3]。而将外源抗虫基因转入玉米中为培育抗虫玉米新品种提供了新的思路。1995年瑞士先正达公司通过基因枪法将来源于苏云金芽胞杆菌的cry1Ab转入玉米中获得的BT176转化事件,以bar作为筛选标记,这是世界第一例商业化种植转基因抗虫玉米。1996年美国孟山都公司将改良后的cry1Ab基因利用基因枪法转入玉米中,获得抗玉米螟的MON810转基因玉米[4]。在转基因作物应用的20多年间,全球农药使用量大幅减少,为可持续发展作出了重要贡献,1996-2015年,节约了6.2亿kg的农药用量,同比减少8.1%,使环境影响商数(EIQ)降低了19%。同时转基因作物的种植为全球粮食产量带来大幅增长,1996-2015年,作物产量增加5.74亿t,产值增加1 678亿美元[5]。而在欧洲玉米螟(European Corn Borer,ECB)危害严重的情况下,转Bt基因的杂交玉米品种比非转基因杂交品种增产12%-23%[6];在自然ECB发生情况下,转Bt基因杂交种比非转基因杂交种增产5.5%[7]。Elisa等[8]通过分析21年的同行文献得出转基因玉米杂交种的玉米产量比其近等基因系要高5.6%-24.5%。Wang等[9]对比了转基因杂交玉米12-5×IE034和2个亲本转基因玉米以及6个常规玉米品种中的转录谱和代谢谱的差异,发现转基因玉米育种基因叠加所带来的基因表达和代谢物的变化数量介于常规玉米品种间的变异范围之内。到目前为止,市场中的转基因抗虫玉米品种全部为国外公司所拥有。近年来,我国虽然在转基因工作中取得重大进展,但尚未有一例商业化抗虫转基因玉米品种上市。本研究使用的cry1Ah是从国内筛选的BT8菌株中鉴定克隆的新型Bt基因,具有自主知识产权[10],其编码的杀虫蛋白的杀虫活性优于目前使用的cry1Ab和cry1Ac[11]。前期的研究结果表明转Bt cry1Ah玉米在温室和田间具有良好的抗虫效果,证明cry1Ah可作为培育商业化抗虫玉米的候选基因[12-13]。标记基因选用2 m G2-epsps,该基因来源于荧光假单胞菌G2,编码5-烯醇式丙酮酰莽草酸-3-磷酸合酶(EPSPS),具有草甘膦耐受性[14]。为了获得满足商业化需求的转基因抗虫玉米品种,前期通过大规模遗传转化进行群体筛选,获得一个Bt蛋白表达量高且对亚洲玉米螟有显著抗性的转化事件HGK60[15]。本研究对HGK60及其杂交种进行了两地连续三代的分子检测及农艺性状分析,证明HGK60转基因抗虫玉米中外源基因能够稳定的遗传和表达,对亚洲玉米螟具有很好的抗性,农艺性状与对照材料相比无显著差异。这将推动HGK60转基因抗虫玉米的产业化应用。
1 材料与方法 1.1 材料 1.1.1 植物材料玉米自交系郑58(轮回亲本)、转Bt cry1Ah基因抗虫玉米材料HGK60的BC5F2(与郑58回交5代,自交2代,下同,2016年海南)、BC6F2(2017年廊坊)、BC7F2(2017年海南)及HGK60的BC5F2(2016年海南)、BC6F2(2017年廊坊)、BC7F2(2017年海南)分别与昌7-2的杂交种郑单958H,杂交种郑单958,由中国农业科学院生物技术研究所郎志宏课题组保存。
1.1.2 供试虫源亚洲玉米螟由北京美延农业科技有限公司购买。
1.2 方法 1.2.1 PCR检测转基因植株取长至3叶期的玉米幼苗叶片采用CTAB法提取基因组DNA,选用cry1Ah特异性引物和筛选标记基因2mG2-epsps特异性引物对其进行PCR检测,留存阳性植株。cry1Ah特异性引物序列为F1:5'-ATGGGCAAGAACTCCAT-CAA-3'和R1:5'-TCAGTCGATGTGGTAGTCGGTAA-C-3',扩增产物长度为2 007 bp。反应条件为94℃ 5 min;95℃ 20 s,55℃ 30 s,72℃ 1 min,32个循环;72℃ 5 min。2mG2-epsps特异性引物序列为F2:5'-ATGGCGTGCCTCCCTGACGA-3'和R2:5'-TCATCAGTCGTTGAGGTGAA-3',扩增产物长度为1 338 bp,反应条件与上述一致。
1.2.2 实时荧光定量PCR检测转基因植株为了比较不同生长发育阶段阳性植株在转录水平的差异,对PCR阳性植株进行实时荧光定量PCR(quantitative RT-PCR)检测。取玉米不同生长时期(抽穗期、灌浆期)的展开叶、雄穗、穗轴、花丝、苞叶和籽粒组织,提取总RNA,利用反转录试剂盒(Thermo公司,美国)合成cDNA,采用SYBR GreenⅠ定量PCR试剂盒(Roche公司,瑞士)。反应体系为2×FastStart Universal SYBR Green Master(Rox)10 μL、上游引物(10 μmol/L)0.4 μL、下游引物(10 μmol/L)0.4 μL、cDNA模板2 μL,加水补至20 μL。反应条件为95℃ 10 min;95℃ 15 s,60℃ 60 s(采集荧光信号),共40个循环。将SYBR GreenⅠ的扩增产物从60℃缓慢而均匀地以0.3℃/s的速率升温到95℃,记录荧光信号的变化,绘制出扩增产物的溶解曲线。内参基因为玉米内参actin,引物为F3:5'-CGAATGCCCAGCAATGTA-3'和R3:5'-TTAGGTGGTCGGTGAGGT-3',扩增产物长度为188 bp。
1.2.3 转基因玉米Cry1Ah蛋白表达含量分析取玉米不同生长时期(六叶期、大喇叭口期、抽穗期、灌浆期)的心叶、展开叶、茎、雄穗、花丝、穗轴、苞叶、根和籽粒组织,提取可溶性总蛋白,利用酶联免疫吸附测定(Enzyme-linked immunosorbent assay,ELISA)转基因植株的Cry1Ah蛋白表达量,以纯化的Cry1Ah蛋白制作标准曲线。蛋白提取及ELISA检测方法均按试剂盒说明书进行,ELISA检测试剂盒购自美国Envirologix公司。
1.2.4 转基因玉米高代自交系和杂交组合的主要农艺性状考察2016年12月-2018年3月,对转基因抗虫玉米进行了两地连续三代田间试验,地点为河北省中国农业科学院国际农业高新技术产业园生物技术示范基地和海南省中国农业科学院南繁基地。试验地分小区种植,设3次重复,重复内各材料随机排列。按照郑58、HGK60、郑单958及郑单958H分4个小区,每个小区种植10行,行长5 m,行宽0.60 m,每行种植20株。试验地不进行任何虫害的治理,其他(如水、肥以及除草等)完全与常规大田管理一样。生长期间调查出苗期、吐丝期等生育期。在每个品种内随机选取100株,吐丝后测量株高、穗位高,收获后考种,于室内测量穗长、穗粗、秃尖长、穗行数、行粒数等农艺指标,果穗干燥后脱粒称重,并求千粒重。
1.2.5 玉米种子发芽率检测对收获的玉米种子进行发芽率检测,按GB/T 3543.3规定的方法进行。采用纸床纸间发芽方法,先将玉米种子表面消毒(2%的次氯酸钠溶液浸泡10 min),然后将滤纸放在培养皿内,用水将滤纸湿润,将消毒后的种子均匀放置在湿润的滤纸上,再用另一张同样大小的滤纸覆盖在种子上,盖上培养皿,放入25℃光照培养箱内。每个培养皿摆放13粒种子,每个品种3皿为一组(统计单位),重复3次,每个品种共计9皿,117粒种子。发芽过程中,逐日统计正常发芽种子的粒数,4 d统计发芽势,7 d统计发芽率。
1.2.6 玉米螟室内外生测 1.2.6.1 玉米螟田间生测按照农业部953号公告-10-2007在大田进行随机区组设计。对小喇叭口期的郑58、HGK60、郑单958及郑单958H,以每株40-60头玉米螟初孵幼虫的用量接于心叶中,3 d后重复接虫一次,吐丝期除接虫部位为玉米花丝外其他同上。在接虫14-21 d后,按照公告标准进行等级判定。
1.2.6.2 玉米螟室内生测按照宋苗等[15]方法,采集生长至小喇叭口期玉米心叶,用细毛笔轻轻将亚洲玉米螟初孵幼虫接入放有玉米心叶的24孔生测皿中,每24 h调查幼虫存活数,每个试验材料重复3次。
1.2.7 数据分析利用Excel软件进行数据整理,用SPSS数据处理软件对试验数据进行分析,对不同处理间平均数的差异显著性比较均采用t检验。
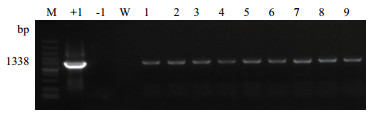
2 结果 2.1 转基因玉米外源基因cry1Ah和标记基因2mG2-epsps的PCR检测对每一代的转Bt cry1Ah抗虫玉米材料HGK60自交系中的cry1Ah和2mG2-epsps进行PCR检测,留取阳性植株与昌7-2杂交,收获的郑单958H种子种植至六叶期,取叶片检测阳性率。以cry1Ah和2mG2-epsps特异性引物分别检测目的基因和标记基因,以表达载体为模板作为阳性对照,以郑58玉米基因组DNA为模板作为阴性对照。结果显示,含目的基因cry1Ah的转基因HGK60和郑单958H扩增片段为2 007 bp,与阳性对照片段大小一致,阴性对照郑58未扩增出目的条带,2017廊坊样品HGK60均有阳性条带,郑单958H也都有阳性条带(图 1);图 2显示,含目的基因2mG2-epsps的转基因HGK60扩增出片段为1 338 bp,与阳性对照片段大小一致,阴性对照郑58未扩增出目的条带,2017海南样品HGK60均有阳性条带,与昌7-2的杂交种均有阳性条带。初步判断转Bt cry1Ah抗虫玉米中cry1Ah和2mG2-epsps均能稳定遗传给子代个体。

|
| 图 1 以cry1Ah为引物扩增部分2017廊坊HGK60和郑单958H材料PCR电泳图 M:marker;+1:阳性对照;-1:阴性对照;1-4:2017廊坊HGK60样品;5-9:2017廊坊郑单958H样品 |
|
| 图 2 以2mG2-epsps为引物扩增部分2017海南HGK60和郑单958H材料PCR电泳图 M:marker;+1:阳性对照;-1:阴性对照;1-4:2017海南HGK60样品;5-9:2017海南郑单958H样品 |
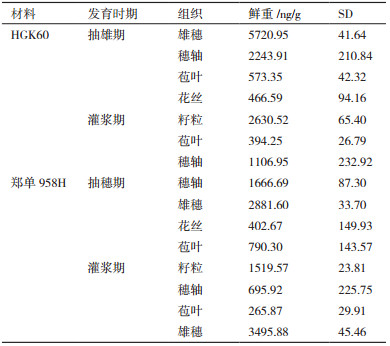
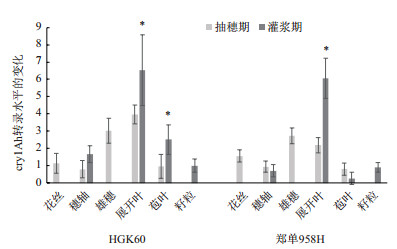
分别取2017年海南生长至抽雄期、灌浆期的HGK60阳性植株及其杂交种郑单958H各组织进行荧光定量PCR检测(图 3),以灌浆期HGK60籽粒中的cry1Ah转录水平为参照,HGK60和郑单958H均为灌浆期的展开叶(穗上叶)中cry1Ah转录水平最高,而穗轴和籽粒的转录水平较低;抽穗期郑单958H中cry1Ah转录水平最高的部位是雄穗,而HGK60中的转录水平最高部位为展开叶。将灌浆期与抽穗期相同组织中cry1Ah转录水平进行比较,结果显示,HGK60的展开叶与苞叶在这两个时期中cry1Ah转录水平差异显著;而郑单958H仅有展开叶中cry1Ah转录水平差异显著。
|
| 图 3 2017海南HGK60与郑单958H不同时期不同组织cry1Ah的转录水平 *:表示抽穗期和灌浆期相同组织中cry1Ah转录水平存在显著差异(P < 0.05) |
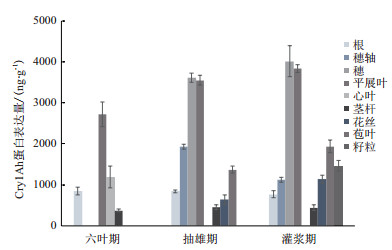
利用ELISA方法检测两地连续三代HGK60及其杂交种不同时期不同部位的Cry1Ah蛋白表达量。结果(图 4)显示,在2016年海南、2017年廊坊、2017年海南HGK60及其杂交种同一生长期同一部位的Cry1Ah蛋白表达量趋于稳定,不同生长期不同部位的Cry1Ah蛋白表达量存在差异。在抽穗期叶片中Cry1Ah蛋白表达比六叶期增加30.71%,在灌浆期雄穗中Cry1Ah蛋白表达量最高,为4 017 ng/g(鲜重,下同)。在灌浆期中苞叶及花丝的Cry1Ah蛋白表达量比抽雄期分别增加41.62%和77.05%。灌浆期籽粒所含Cry1Ah蛋白表达量为1 467 ng/g。表 1所示,2017海南HGK60抽穗期中雄穗Cry1Ah表达量最高,为5 720 ng/g,灌浆期中籽粒和穗轴表达量分别为2 630和1 106 ng/g;杂交种郑单958H与自交种HGK60都是在抽穗期雄穗表达量处于最高水平,而穗轴表达量在灌浆期显示下降的趋势。杂交种的Cry1Ah表达量要比自交种HGK60低。
|
| 图 4 2017廊坊HGK60不同时期不同组织Cry1Ah蛋白表达 |
ELISA与实时荧光定量PCR结果相比较,在抽穗期HGK60的雄穗Cry1Ah蛋白表达量最高,而抽穗期的展开叶的转录水平最高,其杂交种中的cry1Ah雄穗转录水平最高。这种差异可能与环境差异有关,Miluse Trtikova通过比较2种的转MON810品种发现由于遗传背景和环境差异能造成转基因表达量和Bt蛋白含量的显著差异[16]。而苞叶和花丝中的蛋白表达水平和转录水平均偏低。灌浆期中展开叶的Bt蛋白表达水平与转录水平均比抽穗期要高,自交系和杂交种均如此,而籽粒中的蛋白表达水平和转录水平均偏低。
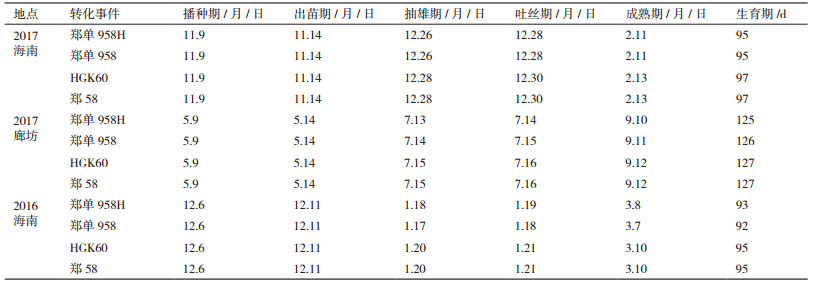
2.4 转基因玉米高代自交杂交系的主要农艺性状结果 2.4.1 转基因对玉米生育期的影响从表 2可以看出,转基因抗虫玉米郑单958H与郑单958在同一世代出苗期一致,抽雄期、吐丝期及生育期略有差异,但只有1-2 d,差异不大。播种到抽雄时间2017年海南、2017年廊坊和2016年海南分别为47、65-66和42-43 d。生育期各代分别是95、125-126和92-93 d。各世代从播种到抽雄时间以及生育期不同,这主要是因为河北廊坊及海南三亚在不同时期的有效积温及土壤类型不同造成的。转基因抗虫玉米HGK60与郑58亦如此。
从3个世代的物候期调查结果可以得出转入Bt cry1Ah对玉米生育期的影响不大。
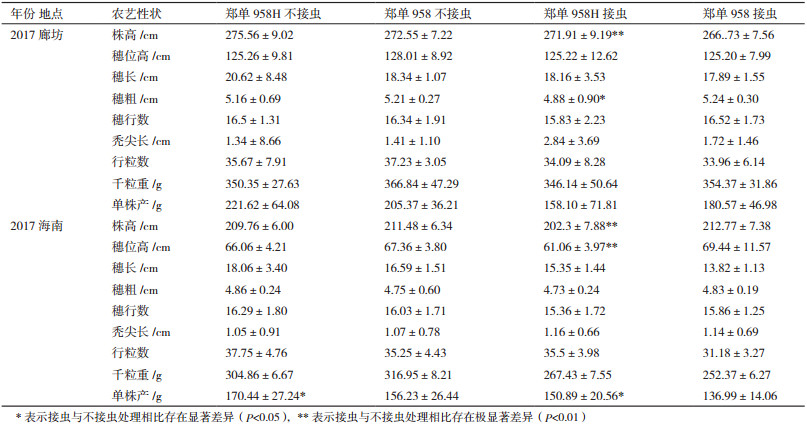
2.4.2 转基因对玉米株高、穗部及产量性状的影响对2个世代的转cry1Ah抗虫玉米的农艺性状进行了田间跟踪调查及实验室考种工作。由表 3可知,郑单958H与郑单958在不接玉米螟时,在同一世代株高、穗位高、穗长、穗粗、穗行数、秃尖长、行粒数、千粒重虽有差异,但差异不大,经检验差异不显著;但郑单958H的产量与郑单958的差异比较大,除了2017廊坊的产量差异不显著,在2017廊坊和2017海南郑单958H比郑单958分别增产7.91%和9.1%。在小喇叭口期和吐丝期接玉米螟后,郑单958H与郑单958同一世代穗长、穗行数、秃尖长、行粒数、千粒重虽有差异,但差异不大,经检验差异不显著;但郑单958H的株高在2个世代比郑单958均差异较大,达极显著水平;在2017海南郑单958H的产量比郑单958增产10.15%,经检验差异显著。
不同世代间同一性状的差异主要是由于试验地点的土壤气候条件不同造成的,总体趋势为,在海南种植的植株株高和穗位高度比在廊坊种植的低,接虫后的产量要比不接虫的产量低,接虫后的转基因植株产量要比非转基因产量要高,且差异显著。随着育种代数的增高,田间单株间已经变化不大,即各群体的农艺性状随着世代的增加更加趋于稳定。为转Bt基因玉米自交系能够直接用于育种提供了有力证据。
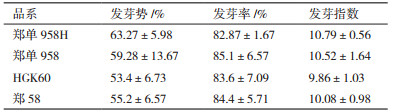
2.5 转基因对玉米种子发芽率的影响由图 5及表 4可以得出,转基因玉米郑单958H与非转基因玉米郑单958进行比较,在发芽势、发芽率和发芽指数上存在一定的差异,经t检验,进行差异显著性分析,P值分别为0.330 2、0.217 4和0.395 8均大于0.05,因此差异不显著。转基因玉米HGK60与非转基因玉米郑58也在发芽势、发芽率和发芽指数上存在一定的差异,经t检验,进行差异显著性分析,P值分别为0.314 3、0.429 3和0.351 8均大于0.05,因此差异不显著。说明转基因玉米郑单958H与非转基因玉米郑单958及HGK60与郑58在发芽势、发芽率和发芽指数上没有显著差异,外源基因Bt cry1Ah的导入对玉米发芽活力方面没有影响。
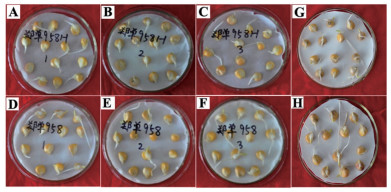
|
| 图 5 种子发芽4 d试验 A-C:郑单958H;D-F:郑单958;G:HGK60;H:郑58 |
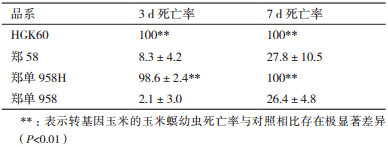
室内接虫3 d后(图 6),转基因玉米中玉米螟幼虫全部死亡,叶片鲜嫩,基本无危害,且虫孔只有针孔大小。第7天时阴性对照郑58活虫个体较大,有较强的爬行活力,叶片受玉米螟危害较严重,有较多虫孔。室内接虫3 d后,咬食HGK60和郑单958H死亡率如表 5所示,取食转基因玉米心叶的玉米螟幼虫死亡率显著高于阴性对照,经t检验,差异极显著(P < 0.01),表明转Bt cry1Ah玉米材料HGK60和郑单958H对玉米螟幼虫有显著杀虫效果,该结果与宋苗等[15]结果一致。
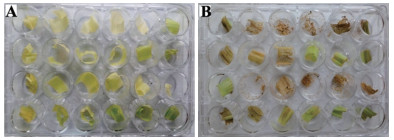
|
| 图 6 取食HGK60叶片的亚洲玉米螟室内生测 A:3 d转基因玉米室内生测图;B:7 d郑58室内生测图 |
由图 7可知,转基因玉米的叶片在接虫两周后基本无玉米螟危害,只有少量针孔大小的虫孔,而阴性对照叶片受害严重,有多个超过火柴头大小的虫孔。按照判定标准,HGK60田间抗性等级是1.27±0.61级,为高抗级别,相同处理的阴性对照平均抗性等级为6.59±1.43级,为感虫级别。玉米吐丝期将玉米螟幼虫接于玉米花丝,HGK60和郑单958H玉米的雄穗和雌穗受害微小,按照判定标准抗性级别为1.74±0.52级,属高抗级别,而阴性对照的雄穗和雌穗受害较严重,抗性级别为7.58±1.95级,属感虫级别。证明HGK60及其杂交种对玉米螟有很强的抗性,此结果与室内抗虫性鉴定结果一致。田间生测结果同时也与宋苗等[15]生测结果一致,证明该材料具有良好的田间抗虫稳定性。室内和田间虫测结果与荧光定量PCR、ELISA结果一致。

|
| 图 7 转基因玉米的田间生测 A:郑58叶期虫测;B:HGK60叶期虫测;C:郑单958穗期生测;D:郑单958H穗期生测 |
采用农杆菌介导法获得的转基因植株,整合到植物基因组中的外源基因一般遵循孟德尔遗传分离规律并能够稳定遗传和表达[17]。Paz等[18]将已经商业化17年的3种MON810转基因玉米进行Southern杂交,在插入序列和侧翼序列均未发现序列重排,进一步分析28个不同的MON810品种基因组侧翼序列中存在的点突变和插入缺失,得出转入的基因突变率与玉米内源基因的突变率相同的结论。两地连续三代种植转基因玉米HGK60及其杂交种郑单958H经过PCR检测、实时荧光定量PCR检测结果显示能稳定遗传与表达Bt cry1Ah基因。新表达蛋白Cry1Ah表达量在同一生长期同一部位趋于稳定,不同生长期不同部位存在差异。研究发现雄穗中Cry1Ah表达量在玉米抽穗期和灌浆期均居于最高水平,叶片的表达量次之,而苞叶和花丝的蛋白表达量在灌浆期增高。玉米螟在抽穗期取食幼嫩的雄穗,雄穗中高表达的Bt蛋白能有效防治玉米螟的危害。玉米螟在灌浆期咬食花丝、苞叶和籽粒,苞叶和花丝的表达量提升能减少授粉期间玉米螟对苞叶和花丝的危害。田间生测HGK60和郑单958H雄穗没有出现折断及被咬食的情况,而大部分郑58和郑单958的雄穗在玉米吐丝期被咬食严重甚至被折断。HGK60和郑单958H的苞叶、花丝和籽粒玉米螟均无危害,而郑58和郑单958的苞叶有大量虫孔,花丝被咬食严重,籽粒有部分发霉。本研究表明2个材料均表现较好的抗螟性。在抽穗期和灌浆期,HGK60和郑单958H在雄穗、展开叶和苞叶均有较高的转录水平,这与蛋白表达水平基本吻合。造成郑单958H在抽穗期叶片的转录水平比雄穗低,与自交系HGK60的结果相反,而蛋白水平是雄穗的要比叶片的高,造成RNA转录水平和蛋白质表达水平不一致的原因还未做深入研究。Makarevitch等[19]研究认为特定品种的遗传背景可以影响转基因的表观遗传调控,DNA甲基化[20]、组蛋白修饰[21]、非编码RNA调控[22]等可以造成基因序列不发生改变而转录水平产生差异,其是否与表观遗传调控相关,还有待进一步研究。
从3个世代的物候期调查结果可以得出转入Bt cry1Ah对玉米生育期的影响不大。而玉米生育期与纬度变化及种植当地的积温相关,有研究统计显示随着纬度的北移,播种-出苗和出苗-吐丝的时间显著增加,纬度每增加1°,播种-出苗和出苗-出吐丝的时间分别延长0.7 d和1.25 d,吐丝-出成熟的时间缩短0.8 d,玉米营养生长期占总生育期的比值随着纬度的北移显著增加,纬度每增加1°,比值增加1.34[23]。海南的积温比廊坊积温要高,纬度比廊坊低,在海南玉米的生育期要比在廊坊玉米的生育期短。因此,统计的3个世代物候期的差异是由于积温和纬度等因素造成的,与转入的Bt cry1Ah基因无关。
康领生等[24]将cry1F转入玉米获得转基因玉米SW12-859,接虫与不接虫小区和郑单958不接虫小区比较,玉米株高、穗位高、产量无显著差异,玉米株型、生育期都一致。玉米SW12-859与郑单958通过接虫区测产、考种比较,玉米穗长、穗粗、百粒重、产量存在显著差异。本研究中郑单958H与郑单958相比,不接玉米螟时,在同一世代株高、穗位高、穗长、穗粗、穗行数、秃尖长、行粒数、千粒重无显著差异,接虫后的产量要比不接虫的产量低,接虫后的转基因植株产量要比非转基因产量要高,且差异显著。接虫后的郑单958H和郑单958产量都降低,这可能与田间模拟大量虫害爆发有关,叶片被咬食严重,受害叶片丧失功能,直接影响玉米光合作用,导致玉米植株生长发育受阻,株高和产量受损。研究表明,培育出的郑单958H杂交种有较好的育种价值。
从玉米种子上来看,本研究中转基因玉米郑单958H与非转基因玉米郑单958及HGK60与郑58在发芽势、发芽率和发芽指数上没有显著差异,外源Bt cry1Ah基因的导入对玉米发芽活力方面没有影响。这与王延锋[25]将转基因玉米与受体X90进行比较得出外源cry1Ah的导入对玉米发芽活力没有影响结果一致。
无论是自交种HGK60还是杂交种郑单958H,都显示出比郑58及郑单958较强的抗虫优势。在农艺性状等基本保持稳定的前提下,还具有能稳定遗传的良好抗虫性,具有较强的育种前景。
4 结论转基因抗虫玉米自交种HGK60及杂交种郑单958H具有良好的遗传稳定性和抗虫性,农艺性状趋于稳定。
| [1] |
齐涛. 中国玉米国际竞争力研究[D]. 杨凌: 西北农林科技大学, 2011.
|
| [2] |
沈平, 章秋艳, 林友华, 等. 推进我国转基因玉米产业化的思考[J]. 中国生物工程杂志, 2016, 36(04): 24-29. |
| [3] |
康岭生, 王玉民, 姜昱, 等. 转Bt基因玉米的抗螟性及产量分析[J]. 玉米科学, 2009, 17(1): 62-64, 70. |
| [4] |
陈化榜. 美国转基因玉米的生产概况和发展趋势[J]. 玉米科学, 2008, 16(3): 1-3. |
| [5] |
Brookes G, Barfoot P. Environmental impacts of genetically modified(GM)crop use 1996-2015: Impacts on pesticide use and carbon emissions[C]. GM Crops & Food, 2017, 8(2): 117-147.
|
| [6] |
Mungai NW, Motavalli PP, Nelson KA, et al. Differences in yields, residue composition and n mineralization dynamics of Bt and Non-Bt maize[J]. Nutrient Cycling in Agroecosystems, 2005, 73(1): 101-109. DOI:10.1007/s10705-005-8850-8 |
| [7] |
Dillehay BL, Roth GW, Calvin DD, et al. Performance of Bt corn hybrids, their near isolines, and leading corn hybrids in pennsylvania and maryland[J]. Agronomy Journal, 2004, 96(3): 818-824. DOI:10.2134/agronj2004.0818 |
| [8] |
Pellegrino E, Bedini S, Nuti M, et al. Impact of genetically engineered maize on agronomic, environmental and toxicological traits:a meta-analysis of 21 years of field data[J]. Scientific Reports, 2018, 8(1): 2045-2322. DOI:10.1038/s41598-018-20473-3 |
| [9] |
Wang X, Zhang X, Yang JT, et al. Effect on transcriptome and metabolome of stacked transgenic maize containing insecticidal cry and glyphosate tolerance epsps genes[J]. The Plant J, 2018, 93(6): 1007-1016. DOI:10.1111/tpj.2018.93.issue-6 |
| [10] |
Xue J, Liang G, Crickmore N, et al. Cloning and characterization of a novel Cry1A toxin from Bacillus thuringiensis with high toxicity to the Asian corn borer and other lepidopteran insects[J]. FEMS microbiology letters, 2008, 280(1): 95-101. DOI:10.1111/fml.2008.280.issue-1 |
| [11] |
Xue J, Zhou ZS, Song FP, et al. Identification of the minimal active fragment of the Cry1Ah toxin[J]. Biotechnology letters, 2011, 33(3): 531-537. DOI:10.1007/s10529-010-0452-0 |
| [12] |
Li XY, Lang ZH, Zhang J, et al. Acquisition of insect-resistant transgenic maize harboring a truncated cry1Ah gene via agrobacterium-mediated transformation[J]. Journal of Integrative Agriculture, 2014, 13(5): 937-944. DOI:10.1016/S2095-3119(13)60531-6 |
| [13] |
戴军, 李秀影, 朱莉, 等. 转Bt cry1Ah基因抗虫玉米的分子检测及农艺性状分析[J]. 生物技术通报, 2014(5): 62-68. |
| [14] |
刘柱. 可变盐单胞菌中草甘膦抗性EPSP合酶新基因克隆、大肠杆菌表达及其抗性机制的研究[D]. 雅安: 四川大学, 2004.
|
| [15] |
宋苗, 汪海, 张杰, 等. 转Bt cry1Ah基因抗虫玉米对亚洲玉米螟、棉铃虫和黏虫的抗性评价[J]. 生物技术通报, 2016, 32(6): 69-75. |
| [16] |
Trtikova M, Wikmark OG, Zemp N, et al. Transgene expression and Bt protein content in transgenic Bt maize(MON810)under optimal and stressful environmental conditions[J]. PLoS One, 2015, 10(4): e0123011. DOI:10.1371/journal.pone.0123011 |
| [17] |
吴乃虎. 基因工程原理(下册)[M]. 北京: 科学出版社, 2001, 278-290.
|
| [18] |
Paz J, Pla M, Papazova N, et al. Stability of the MON 810 transgene in maize[J]. Plant Molecular Biology, 2010, 74(6): 563-571. DOI:10.1007/s11103-010-9696-2 |
| [19] |
Makarevitch I, Stupar RM, Iniguez AL, et al. Natural variation for alleles under epigenetic control by the maize chromomethylase Zmet2[J]. Genetics, 2007, 177(2): 749-760. DOI:10.1534/genetics.107.072702 |
| [20] |
Sigman MJ, Slotkin RK. The first rule of plant transposable element silencing:location, location, location[J]. The Plant Cell, 2016, 28(2): 304-313. DOI:10.1105/tpc.15.00869 |
| [21] |
Oka R, Zicola J, Weber B, et al. Genome-wide mapping of transcriptional enhancer candidates using DNA and chromatin features in maize[J]. Genome Biology, 2017, 18(1): 137. DOI:10.1186/s13059-017-1273-4 |
| [22] |
Liu HJ, Luo X, Niu LY, et al. Distant eQTLs and non-coding sequences play critical roles in regulating gene expression and quantitative trait variation in maize[J]. Molecular Plant, 2017, 10(3): 414-426. DOI:10.1016/j.molp.2016.06.016 |
| [23] |
刘月娥. 玉米对区域光、温、水资源变化的响应研究[D]. 北京: 中国农业科学院, 2013.
|
| [24] |
康领生, 姜志磊, 刘洋, 等. 转基因玉米SW12-859的抗螟性及农艺性状评价[J]. 玉米科学, 2017, 25(5): 45-48. |
| [25] |
王延锋. 转Bt基因抗虫玉米田间试验与遗传稳定性分析[D]. 哈尔滨: 东北农业大学, 2010.
|