2. 植物生物学黑龙江省高校重点实验室,哈尔滨 150025;
3. 哈尔滨市第六中学,哈尔滨 150036
2. Key Laboratory of Plant Biology in Colleges of Heilongjiang Province, Harbin 150025;
3. Harbin No.6 High School, Harbin 150036
水杨酸(SA)是植物产生过敏反应(Hypersen-sitive Reaction,HR)和系统获得抗性(Systemic Acquired Resistance,SAR)的内源信号分子,可以诱导抗病基因表达,在植物的SAR信号转导中起关键作用[1]。有很多研究证实SA介导的HR是一个程序性细胞死亡(Programmed cell death,PCD)过程[2-3]。植物发生HR时,常伴随着特异性信号分子ROS和SA的积累以及染病相关基因(PR)的表达,激发邻近组织的特异性防御反应和植株的SAR[4]。线粒体在PCD中扮演重要角色[5]。线粒体通透性转运孔(Mitochondria permeability transition pore,MPTP)的开放是PCD中发生的最早事件[6]。MPTP的开放引起线粒体膜电位下降,进一步导致氧化磷酸化作用的解偶联,膜内外离子浓度趋于平衡,进而导致线粒体外膜被破坏和细胞色素C(Cytochrome C,Cyt C)的释放,释放到胞质内的Cyt C可以激活Caspase等下游关键酶类,使信号级联放大而触发PCD[7-8]。Efthimios[9]研究发现盐胁迫处理烟草植株,短时间盐胁迫出现线粒体膜去极化、Cyt C释放和Caspase蛋白含量变化。Janneke[10]研究发现黄瓜子叶在55℃高温处理,出现DNA梯状条带现象,且通过Western blot技术检测发现Cyt C从线粒体释放到细胞质中[8]。线粒体中新发现的PCD组分揭示了线粒体在植物中触发和执行PCD的功能。李家洋研究组通过对mod1抑制基因的研究发现,植物的程序性细胞死亡途径中存在叶绿体到线粒体的信息交流,苹果酸-草酰乙酸穿梭途径在其中发挥关键作用。ROS可以作为诱导线粒体膜透化或线粒体通透性转换孔(MPTP)形成的诱导PCD的信号分子,通过Cyt C的释放和线粒体电子传递链(mETC)执行PCD[11]。
目前在水稻、玉米、拟南芥等植物中分离出一些与PCD相关的基因,如与玉米性器官原基退化有关的Ts2基因,大麦中的抗白粉病Mlo基因,拟南芥调控PCD的LSD1基因和与HR反应有关的3个基因AP22A,AP33A和AP43A[12-13]。但植物PCD的研究开展较晚,PCD相关基因的研究远没有动物深入,需要分离更多的基因来揭示植物PCD的机制。RNA-seq测序技术是一种转录组测序手段,在已完成基因组测序的物种中,通过将RNA-seq结果与基因组DNA序列数据进行比对,从而得到差异表达基因、新基因等[14]。
利用10 mmol/L SA诱导处理黄瓜叶片,检测到黄瓜发生了PCD,并伴随着ROS的积累和H2O2产生。获取黄瓜受SA诱导的PCD相关基因,研究受SA诱导的PCD相关基因与黄瓜抗病的相关性,从中获取黄瓜抗病相关线粒体基因,为揭示SA诱导黄瓜PCD和提高黄瓜抗病性的分子机制提供基础。本文根据对RNA-seq测序得到1 759个差异表达基因(DEGs)结果进行筛选[15-16],得到16个与线粒体相关的DEGs。通过qRT-PCR技术分析该16个基因在SA和霜霉病处理下的表达特征,为获取介导PCD的关键基因奠定基础。
1 材料与方法 1.1 材料实验于2016年5月哈尔滨师范大学植物分子生物学实验室进行。供试黄瓜自交系9930由中国农业科学院蔬菜花卉研究所黄三文教授实验室赠送。幼苗在光照培养箱内用Hoagland营养液蛭石培养,光照28℃/14 h,黑暗24℃/10 h。
1.2 方法 1.2.1 RNA提取第4片真叶长出时选长势良好的黄瓜幼苗在第3片真叶的叶脉间滴加10 mmol/L的SA(每叶4滴,每滴50 μL),并于滴加前(0 h)和滴加后3 h、12 h、24 h取材4次,每次随机选取3株植株,摘取滴加SA的第3片真叶无菌水洗净揩干,剪取滴加SA部位混合均匀,提取RNA。
选取霜霉病发病的新鲜叶片,用蒸馏水清洗干净,放入密封袋,20℃下放置24 h,用毛笔刷取叶片上新长出的孢子囊于无菌水中,制成霜霉菌菌液,浓度为5×105-10×105个孢子囊/mL。采用滴加法接种病菌,选取长势良好的四叶期黄瓜植株,在第3片真叶的叶脉间滴加菌液,每叶9滴,每滴50 μL,保湿24 h。于滴加前(0 h)和滴加后36 h、72 h和96 h取材4次,每次随机选取3株植株摘取滴加菌液的第3片真叶无菌水洗净揩干,剪取接菌部位混合均匀,提取RNA。
1.2.2 qRT-PCR测定上述保存材料的总RNA提取采用天根生化科技有限公司的RNAprep Pure植物总RNA提取试剂盒(离心柱型),详细方法见试剂盒说明书。cDNA合成采用宝生物公司的PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit试剂盒。
根据基因注释中是否含有mitochondrial,从1 759个DEGs中[12]筛选出16个基因(表 1)。根据公布的黄瓜基因组基因系列设计出qRT-PCR引物如表 1,以18S为内参基因(引物为ATGATAACTC-GACGGATCGC和CTTGGATGTGGTAGCCGT),进行qRT-PCR测定。qRT-PCR采用大连宝生物SYBR Premix Ex TaqTM(Tli RNaseH Plus)试剂盒,采用2-∆∆CT法分析数据,确定基因的相对表达量。
16个被分析基因的qRT-PCR表达如表 2描述,按照基因响应SA和霜霉菌的一致性,可以将这些基因划分为3类。
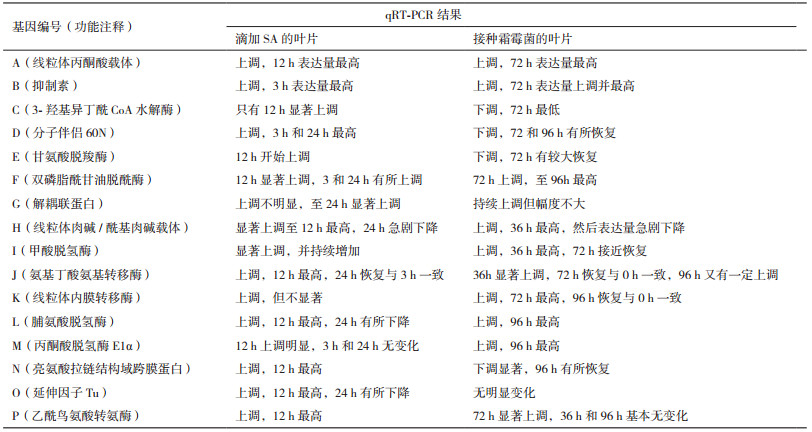
第一类基因的表达量在响应SA和霜霉菌上基本一致,都是随处理时间延长,表达量持续上调,或上调至一定程度后下调,个别下调至处理前水平,且上调幅度都比较大(500%以上)。属于这类的基因有A、B、F、H、J、L(图 1)。在表达时间段上,H上调响应SA和霜霉菌集中在早期,特别是响应霜霉菌。J上调响应SA在12 h达到最高,响应霜霉菌在36 h最高。L是逐步上调响应SA和霜霉菌,响应SA是12 h达到最大,响应霜霉菌是96 h达到最大。
|
| 图 1 qRT-PCR检测A、B、F、H、J和L基因在滴加SA(A)和接种霜霉菌(B)的叶片中的表达分析 |
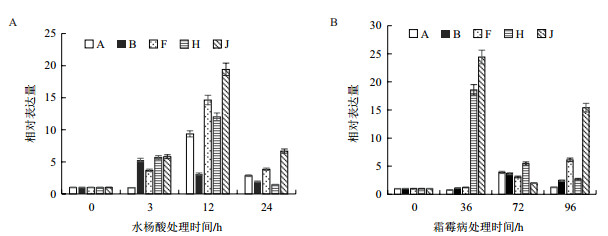
第二类基因的表达量在响应SA和霜霉菌时虽然一致,但表达量差别很大(图 2)。G和P基因都是上调,但上调幅度都很小,最大为处理前的3倍。I基因显著响应SA,但上调响应霜霉菌较微弱,而K基因正好相反,上调响应SA很微弱,但响应霜霉菌很强烈,上调幅度最大达到17倍。M基因与K基因相似。
|
| 图 2 qRT-PCR检测G、I、K、M和P基因在滴加SA(A)和接种霜霉菌(B)的叶片中的表达分析 |
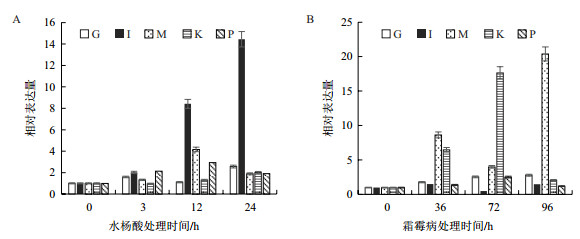
第三类基因在响应SA和霜霉菌上不一致,基本是上调响应SA,下调响应霜霉菌,属于这类是基因是C、D、E、N和O(图 3)。其中只有N和O基因响应SA的上调表达量较高,最大表达量高于处理前10倍,N响应霜霉菌显著下调约5倍,而O基本不响应霜霉菌。C、D、E虽然都上调响应SA或下调响应霜霉菌,但响应幅度都不大,约2-3倍。
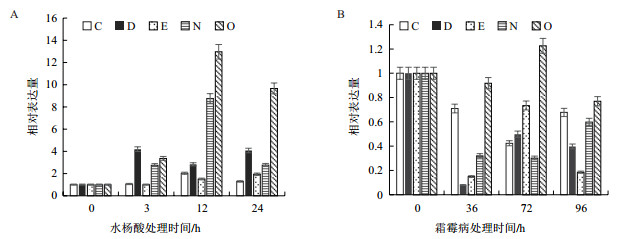
|
| 图 3 qRT-PCR检测C、D、E、N和O基因在滴加SA(A)和接种霜霉菌(B)的叶片中的表达分析 |
通过实时荧光定量技术分析SA处理和霜霉病处理下,黄瓜叶片的16个线粒体相关基因呈现相似或相悖的表达趋势,说明SA诱导的PCD相关基因在霜霉病诱导的PCD信号通路中也行使功能。SA与霜霉病对基因表达量的影响具有一定的相似性。其中线粒体丙酮酸载体2(A)、抑制素3(B)、双磷脂酰甘油脱酰酶(F)、解耦联蛋白5(G)、线粒体肉碱/酰基肉碱载体(H)、甲酸脱氢酶1(I)、氨基丁酸氨基转移酶1(J)线粒体内膜转移酶亚家族(K)、脯氨酸脱氢酶2(L)、丙酮酸脱氢酶E1α(M)和乙酰鸟氨酸转氨酶(P)11个基因在霜霉病处理中结果与SA处理相似皆为上调。SA与霜霉病对基因表达量的影响也具有一定的差异性,其中3-羟基异丁酰CoA水解酶(C)、分子伴侣60N-2(D)、甘氨酸脱羧酶(E)、延伸因子Tu(O)和亮氨酸拉链结构域跨膜蛋白1(N)5个基因在SA处理中为上调表达,在霜霉病处理过程中也为下调表达。按照基因响应SA和霜霉菌的一致性,又可以将这些基因划分为3类。第一类基因的表达量在响应SA和霜霉菌上基本一致,属于这类的基因有A、B、F、H、J、L。第二类基因的表达量在响应SA和霜霉菌时虽然一致,但表达量差别很大,属于这类的基因有G、I、M、K、P。第三类基因在响应SA和霜霉菌上不一致,基本是上调响应SA,下调响应霜霉菌,属于这类是基因是C、D、E、N和O。说明SA处理下和霜霉病处理下基因的表达存在差异,可能由于SA和霜霉病引发的黄瓜叶片PCD发生方式不同有关。植物类病变(Lesion mimic,LM)又称类病斑,指在正常生长条件下,即无明显机械损伤、逆境和外界病原菌侵染,植物的局部或整株上自发产生坏死斑点。这种现象最早在玉米中被发现,随后大麦、拟南芥、水稻等植物中也相继报道了该表型的突变体。近年来,随着多个水稻类病变突变体的陆续发现,水稻类病变基因的定位、克隆及作用机理等方面的研究取得了较大进展。SA参与类病斑的产生,SA诱导的PCD就是一种类病斑,因此研究黄瓜的类病斑或者SA诱导的类病斑,分离和鉴定相关基因,对揭示黄瓜的抗病机制和遗传育种都有积极意义[17-18]。病原体侵害引发抗病信号途径有很多种也存在差异,SA处理黄瓜叶片,被侵染部位发生局部坏死(即Hypersensitive response,HR),细胞内ROS的爆发引起PCD的发生,以抵抗病原菌的的进一步扩散;非染病部位则长期保持一种抵抗这种病原和其他病原的抗性即系统获得抗性[19]。HR和SAR相互作用发生的病原相关蛋白(Patho-genesis related proteins,PRs)基因的表达中增强,引发植物的多种信号转导途径。霜霉病是一种病原体的侵害,可以引发植物一系列的防御机制,可以识别损伤细胞的信号分子,引发植物多种信号转导途径,最终激活抗胁迫基因的表达[20]。
3.2 16个线粒体相关基因功能分析根据基因在SA诱导的黄瓜PCD中的不同表达情况,推测各基因编码蛋白的功能分为以下5类:参与线粒体信号转导(甲酸脱氢酶、氨基丁酸氨基转移酶、抑制素、脯氨酸脱氢酶和丙酮酸脱氢酶);参与蛋白质合成、折叠和转运(延伸因子Tu和分子伴侣);参与线粒体跨膜转运(线粒体丙酮酸转运体、解耦联蛋白、线粒体肉碱/酰基肉碱载体和亮氨酸拉链结构域跨膜蛋白1);参与线粒体呼吸作用的基因(3-羟基异丁酰CoA水解酶和甘氨酸脱羧酶、双磷脂酰甘油);乙酰鸟氨酸转氨酶目前未发现关于在植物线粒体中的研究报道。
脯氨酸脱氢酶ProDH基因在SA和霜霉病处理下均为上调表达,且是随处理时间延长逐步上调响应,该基因在依赖SA的HR反应,立枯丝核菌侵染绿豆时,脯氨酸积累[21]。研究发现其与SA诱导有关,通过降低ROS含量和增加对病原体的敏感性从而降低拟南芥的细胞死亡率[22]。这证实该基因参与SA和霜霉病诱导的信号途径,对植物的抗病性起重要作用,可能为诱导植物PCD发生的关键基因。
延伸因子Tu和分子伴侣在SA和霜霉病的处理下呈相反的趋势,说明在植物PCD的过程中,参与蛋白质合成折叠和转运的基因表达呈复杂变化趋势,可能抑制或促进。延伸因子Tu(EF-Tu)存在于及植物的线粒体细胞内,是在mRNA翻译时促进多肽链延伸的蛋白质因子。高温、干旱、低温以及病原菌侵入等因素可以诱导EF-Tu基因的表达,提高植物的耐热、耐旱及抗病性。研究发现在非生物胁迫下,植物体中EF-Tu的表达上调,表明在胁迫过程中EF-Tu基因有重要作用[23]。在高温和干旱胁迫下,玉米的EF-Tu合成和积累增加。
线粒体内膜转移酶基因在SA中呈上调趋势,而在霜霉病处理下呈下降趋势。该基因在胁迫处理下可以通过基因的调控减小植物在胁迫下的损伤,说明研究在植物PCD过程中线粒体跨膜转运的基因作用有重要意义。线粒体丙酮酸转运体(MPC)存在于线粒体内膜,可以介导丙酮酸由细胞质内进入线粒体,是其进行三羧酸循环的重要一步;为脂肪酸、酮类和胆固醇的合成提供醋酸盐[24]。现已发现在干旱胁迫下烟草MPC基因通过调节ABA的释放,影响保卫细胞跨膜离子转运及气孔运动,提高烟草的抗旱性[25]。
3-羟基异丁酰CoA水解酶(HIBCH)和甘氨酸脱羧酶(GLDC),在SA和霜霉病处理下呈相反的趋势,而双磷脂酰甘油(CL)基因呈相似的上调表达趋势。双磷脂酰甘油(CL)是一种二聚的磷脂,可以参与线粒体呼吸作用和电子传递链,与线粒体的功能和结构有关[26]。研究发现线粒体中的CL基因可以参与细胞氧化磷酸化和细胞凋亡过程[27]。
综上,被研究的16个基因中线粒体丙酮酸载体2(A)、抑制素3(B)、双磷脂酰甘油脱酰酶(F)、线粒体肉碱/酰基肉碱载体(H)、氨基丁酸氨基转移酶1(J)、脯氨酸脱氢酶2(L)等6个基因在响应SA和霜霉病处理时都是上调表达,显示这些基因在SA诱导的PCD过程中承担一定的功能;而3-羟基异丁酰CoA水解酶(C)、分子伴侣60N-2(D)、甘氨酸脱羧酶(E)、延伸因子Tu(O)和亮氨酸拉链结构域跨膜蛋白1(N)等5个基因在SA处理中为上调表达,在霜霉病处理中却是下调表达,可以推断这些基因在响应SA时所起的作用与霜霉菌引起的病变关系不密切;另外5个基因解耦联蛋白5(G)、甲酸脱氢酶1(I)、线粒体内膜转移酶亚家族(K)、丙酮酸脱氢酶E1α(M)、和乙酰鸟氨酸转氨酶(P)等虽然响应SA和霜霉菌比较一致,但表达量的上调幅度很小,难以说明在黄瓜SA诱导的PCD过程中与霜霉菌引起的HR反应中起相似的作用。
4 结论本文通过qRT-PCR技术分析16个线粒体相关基因的表达动态,在SA和霜霉病处理均表达,其中11个基因在响应SA和霜霉菌上一致,5个基因不一致。说明SA和霜霉病诱导PCD具有相似性和差异性。16个基因参与线粒体膜转运、细胞呼吸作用、蛋白质合成、折叠和转运、线粒体信号转导等过程。证实了在线粒体发生PCD过程中与这16个基因有密切关系。
| [1] |
Malamy J, Carr JP, Klessig DF, et al. Salicylic Acid:A likely endogenous signal in the resistance response of Tobacco to viral infection[J]. Science, 1990, 250(4983): 1002-1004. DOI:10.1126/science.250.4983.1002 |
| [2] |
Greenberg JT, Guo A, Klessig DF, et al. Programmed cell death in plants:a pathogen-triggered response activated coordinately with multiple defense functions[J]. Cell, 1994, 77(4): 551-563. DOI:10.1016/0092-8674(94)90217-8 |
| [3] |
Heath MC. Hypersensitive response-related death[J]. Plant Molecular Biology, 2000, 44(3): 321-334. DOI:10.1023/A:1026592509060 |
| [4] |
Greenberg JT, Yao N. The role and regulation of programmed cell death in plant pathogen interactions[J]. Cellular Microbiology, 2004, 6(3): 201-211. DOI:10.1111/cmi.2004.6.issue-3 |
| [5] |
Reape TJ, Kacprzyk J, Brogan N, et al. Mitochondrial markers of programmed cell death in Arabidopsis thaliana[J]. Methods Mol Biol, 2015, 1305(10): 211-221. |
| [6] |
Green DR, Reed JC. Mitochondria and apoptosis[J]. Science, 1998, 281(5381): 1309-1312. DOI:10.1126/science.281.5381.1309 |
| [7] |
Jiang X, Wang X. Cytochrome C-mediated apoptosis[J]. Annual Review of Biochemistry, 2004, 73(73): 87-106. |
| [8] |
Balk J, Leaver CJ, Mccabe PF. Translocation of cytochrome c from the mitochondria to the cytosol occurs during heat-induced programmed cell death in cucumber plants[J]. FEBs Letters, 1999, 463(1-2): 151-154. DOI:10.1016/S0014-5793(99)01611-7 |
| [9] |
Andronis EA, Roubelakis-Angelakis KA. Short-term salinity in tobacco plants leads to the onset of animal-like PCD hallmarks in planta in contrast to long-trem stress[J]. Planta, 2010, 231(2): 437-448. DOI:10.1007/s00425-009-1060-x |
| [10] |
Van AO, Van BF. Licensed to kill:mitochondria, chloroplasts, and cell death[J]. Trends Plant Sci, 2015, 20(11): 754-766. DOI:10.1016/j.tplants.2015.08.002 |
| [11] |
Zhao Y, Luo L, Xu J, et al. Malate transported from chloroplast to mitochondrion triggers production of ROS and PCD in Arabidopsis thaliana[J]. Cell Research, 2018, 1(28): 448-461. |
| [12] |
吴俊华. 植物细胞程序性死亡的研究进展[J]. 生命科学仪器, 2006, 4(10): 37-41. |
| [13] |
李杰, 朱碧岩, 张铭光. 植物发育过程中的细胞程序性死亡[J]. 植物学通报, 2005, 22(s1): 22-28. |
| [14] |
岳桂东, 高强, 罗龙海, 等. 高通量测序技术在动植物研究领域中的应用[J]. 中国科学, 2012, 42(2): 107-124. |
| [15] |
刘双, 乔禹, 王芳, 等. 基于数字基因表达谱筛选黄瓜中水杨酸诱导基因[J]. 核农学报, 2015, 29(5): 874-884. DOI:10.11869/j.issn.100-8551.2015.05.0874 |
| [16] |
刘双. 水杨酸(SA)诱导的黄瓜超敏反应相关基因的筛选和表达分析[D]. 哈尔滨: 哈尔滨师范大学, 2016.
|
| [17] |
Liu S, Fu C, Gou J, et al. Simultaneous Downregulation of MTHFR and COMT in switch grass affects plant performance and induces Lesion-Mimic cell death[J]. Front Plant Sci, 2017, 7(8): 1-15. |
| [18] |
Kaurilind E, Kaurilind E, Brosché M. Stress marker signatures in lesion mimic single and double mutants identify a crucial leaf age-dependent salicylic acid related defense signal[J]. PLoS One, 2017, 12(1): 1-17. |
| [19] |
丁秀英, 苏宝林, 张军, 等. 水杨酸在植物抗病中的作用[J]. 植物学报, 2001, 18(2): 163-168. |
| [20] |
Li CW, Bonnema G, Che D, et al. Biochemical and molecular mechanisms involved in monogenic resistance responses to Tomato powdery mildew[J]. Molecular Plant-microbe Interactions, 2007, 20(9): 1161-1172. DOI:10.1094/MPMI-20-9-1161 |
| [21] |
Soleimani MJ. Possible effects of pathogen inoculation and salicylic acid pre-treatment on the biochemical changes and proline accumulation in Green bean[J]. Archives of Phytopathology and Plant Protection, 2015, 48(3): 212-222. DOI:10.1080/03235408.2014.884826 |
| [22] |
Cecchini NM, Alvarez ME. Proline dehydrogenase contributes to pathogen defense in Arabidopsis[J]. Plant Physiology, 2011, 155(4): 1947-1959. DOI:10.1104/pp.110.167163 |
| [23] |
Fu J, Momcilovi I, Prasad PVV. Roles of protein synthesis elongation factor EF-Tu in heat tolerance in plants[J]. Journal of Botany, 2012, 6(3): 835836-835844. |
| [24] |
Jacoby RP, Li L, Huang S, et al. Mitochondrial composition, function and stress response in plants[J]. Journal of Integrative Plant Biology, 2012, 54(11): 887-906. |
| [25] |
Aken OV, Pecenkova T, et al. Mitochondrial type-I prohibitins of Arabidopsis thaliana are required for supporting proficient meristem development[J]. Plant J, 2007, 52(5): 850-864. DOI:10.1111/tpj.2007.52.issue-5 |
| [26] |
Beranek A, Rechberger G, Knauer H, et al. Identification of a cardiolipin-specific phospholipase encoded by the gene CLD1(YGR110W)in yeast[J]. J Biol Chem, 2009, 284(17): 11572-11578. DOI:10.1074/jbc.M805511200 |
| [27] |
Yan Y, Kang B. The Role of Cardiolipin remodeling in mitochondrial function and human diseases[J]. Journal of Molecular Biology Researcah, 2012, 1(1): 1-11. |