马铃薯(Solanum tuberosum L.)是全球第四大粮食作物,粮菜兼用,具有营养丰富、生长季节短、储运方便等特点[1-3]。马铃薯以无性繁殖为主,在繁殖中病毒积累会导致产量和品质下降,但随着植物组织培养技术的发展,利用组织培养脱毒试管薯技术从根本上解决了马铃薯的品种退化问题[4-5]。在马铃薯试管薯诱导研究中已发现光周期[6]、大量元素组合[7]、多种激素[8]、蔗糖浓度[9]和培养基类型[10]都对马铃薯试管薯的形成有影响。马铃薯块茎的形成是匍匐茎的生长及其顶端的膨大,以及块茎内淀粉的合成和贮藏蛋白的积累的结果,所以培养基内的糖类物质和激素水平成为研究试管薯形成的重要原因。
蔗糖是植物叶片光合作用的主要产物,在成熟叶片合成以后除了供应自身代谢以外还运输到植物的各种异养组织利用与贮藏[11]。蔗糖除了为植物生长过程中提供必要的能源物质外,同时也是参与植物生长发育的一种重要的信号分子,例如参与调节植物的细胞周期、基因表达[12-13]。蔗糖对马铃薯块茎形成的影响之前已经有了一些研究成果。将马铃薯种植在大棚中装有河沙的桶内,分别用0、4%、8%蔗糖浇灌,发现8%蔗糖浇灌条件下马铃薯植株的结薯数量以及块茎干物质量明显高于0%蔗糖的处理和4%蔗糖处理[14];霍凤玲等[15]在马铃薯试管苗的培养基中添加高浓度的蔗糖诱导会使马铃薯结薯增多。由此表明高浓度外源蔗糖对马铃薯田间培养和试管培养均具有促进块茎形成的作用。
早在20世纪50年代,就有人对外源添加GA对马铃薯生长和块茎形成的影响进行了研究。几乎所有报道都一致认为,GA促进了马铃薯整株或离体茎、叶和匍匐茎的生长,但抑制或延缓了块茎的形成[16],认为光周期与温度对结薯的影响其实是对马铃薯内源GA水平的调控的结果[17-18],并且其他激素对于马铃薯块茎形成的影响也是由于改变了GA的水平造成的[9]。本实验选取蔗糖浓度,GA浓度和培养基类型三种因素进行正交试验,研究马铃薯试管薯结薯的最优培养基。
1 材料与方法 1.1 材料植物材料:马铃薯“Desiree”。试剂:MS粉末(Phyto Technology),蔗糖(科密欧),琼脂(Solarbio),赤霉素(北京振泰),葡萄糖(科密欧),果糖(阿拉丁)。
基本MS培养基配方:MS粉末:4.43 g/L,蔗糖:30 g/L,琼脂:10 g/L。
1.2 方法 1.2.1 试管苗的培养用MS+3%蔗糖+1%琼脂(MS3)的培养基培养马铃薯茎段,将脱毒马铃薯苗剪段插瓶培养至马铃薯苗生长良好,一株可继代出5-6株,为后续实验做准备。
1.2.2 不同糖类对马铃薯组培的影响基本培养基为MS培养基,分别添加3%的葡萄糖、果糖和蔗糖。将马铃薯剪成5 cm长的茎段,每种培养基接种15株马铃薯。45 d后统计马铃薯的结薯个数和薯重。
1.2.3 蔗糖、GA与培养基种类对马铃薯的影响基本培养基为MS培养基,利用蔗糖浓度,GA浓度,培养基类型3种因素制作正交实验表格如表 1。将马铃薯剪成5 cm长的茎段,每种培养基接种30株马铃薯。在第35天、60天和95天分别统计马铃薯的结薯个数和95 d的单薯重。
利用SPPS软件对数据进行分析,利用GraphPad Prism 6作图。
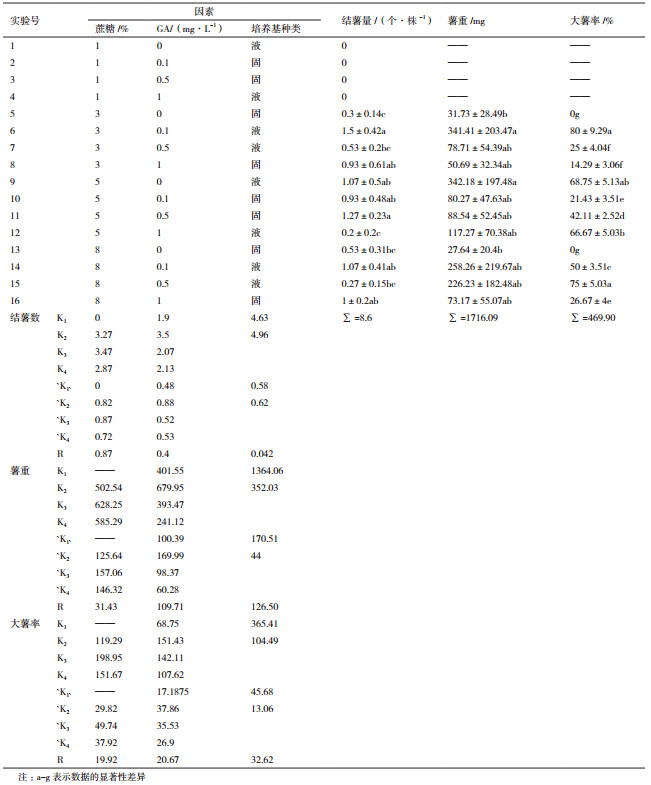
2 结果 2.1 糖的种类对马铃薯结薯的影响培养基中添加3种不同的碳源、葡萄糖、果糖和蔗糖,45 d后统计结薯数量,蔗糖结薯量最高,达到0.46个/株,葡萄糖最低,只有0.2个/株(图 1-A)。称量收获的马铃薯重量,均重最大的是添加葡萄糖的培养基,达到89 mg(图 1-B),但3组数据没有显著性差异。
|
| 图 1 不同糖的种类对马铃薯结薯的影响 A:碳源对马铃薯结薯个数的影响;B:碳源对马铃薯均重的影响 |
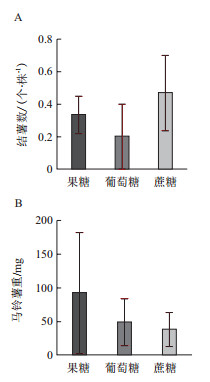
在培养基中添加不同浓度的蔗糖和GA会使马铃薯的外形受到影响,随着蔗糖浓度的升高,马铃薯植株的株高逐渐变矮(图 2-A)。培养基类型对马铃薯培养基中的匍匐茎有影响,在液体培养基中马铃薯的匍匐茎较粗大,呈膨大状态,但很少形成成熟的马铃薯(图 2-B)。

|
| 图 2 同培养基中马铃薯的不同部位的外形比较 1:1%蔗糖+0 mg/L GA+液体培养基;5:3%蔗糖+0 mg/L GA+固体培养基;6:3%蔗糖+0.1 mg/L GA+液体培养基;7:3%蔗糖+0.5mg/L GA+液体培养基;9:5%蔗糖+0 mg/L GA+液体培养基;10:5%蔗糖+0.1 mg/L GA+固体培养基;11:5%蔗糖+0.5 mg/L GA+固体培养基;13:8%蔗糖+0 mg/L GA+固体培养基;14:8%蔗糖+0.1 mg/L GA+液体培养基;A:马铃薯的地上茎段;B:马铃薯的地下茎段;C:马铃薯的种薯 |
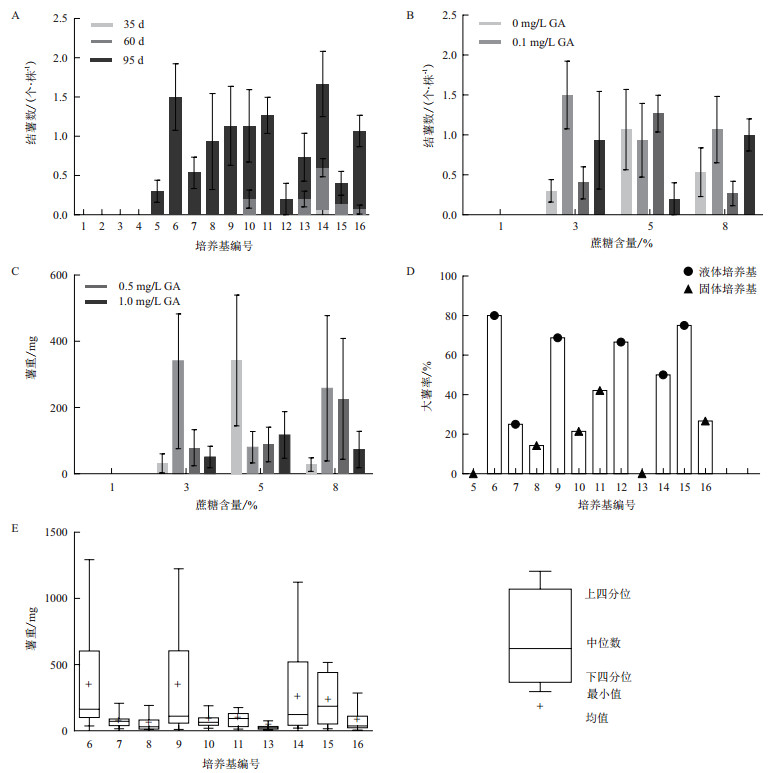
如图 3-A,在35 d、60 d、95 d分别统计结薯量,发现最早结薯的是14号8%蔗糖+0.1 mg/L GA+液体培养基,在35 d时结一颗马铃薯。
|
| 图 3 不同培养基对马铃薯结薯的影响 A:不同培养基对马铃薯结薯时间的影响;B:不同培养基对马铃薯结薯个数的影响;C:不同培养基对马铃薯薯重的影响;D:不同培养基对马铃薯大薯率的影响;E:马铃薯薯重的数据分布情况 |
在60 d时添加8%蔗糖的4组培养基都有不同程度的结薯,最多的还是14号结薯0.53个/株;添加5%蔗糖的培养基只有10号5%蔗糖+0.1 mg/L GA+固体培养基结薯0.2个/株;添加3%和1%蔗糖的所有培养基均未有成熟的马铃薯。
第95天时,添加3%、5%和8%蔗糖的培养基均有不同程度的结薯,但添加1%蔗糖的4组培养基均未结薯,由于培养基营养有限,植物无法继续生长,故停止统计。
2.2.3 对马铃薯结薯个数的影响在第95天时统计各组培养基马铃薯结薯的情况,无论GA浓度如何,添加1%蔗糖的培养基均未结薯。其他组都有结薯,其中结薯最多的是6号3%蔗糖+0.1 mg/L GA+液体培养基,平均1.5个/株。11号5%蔗糖+0.5 mg/L GA+固体培养基,14号8%蔗糖+0.1 mg/L GA+液体培养基,16号8%蔗糖+1.0 mg/L GA+固体培养基都达到1个/株以上(图 3-B)。
2.2.4 对马铃薯薯重的影响对马铃薯的单薯重和均重进行统计,如图 3-C,均重最大的是6号3%蔗糖+0.1 mg/L GA+液体培养基以及9号5%蔗糖+0 mg/L GA+液体培养基,分别是341 mg和342 mg;其次是14号8%蔗糖+0.1 mg/L GA+液体培养基和15号8%蔗糖+0.5 mg/L GA+液体培养基,分别重258 mg和226 mg;其他均在120 mg以下。
马铃薯薯重的数据比较集中和薯重的均数的趋势基本符合(图 3-E),6号3%蔗糖+0.1 mg/L GA+液体培养基,9号5%蔗糖+0 mg/L GA+液体培养基,14号8%蔗糖+0.1 mg/L GA+液体培养基和15号8%蔗糖+0.5 mg/L GA+液体培养基薯重均重大,数据均匀。
统计每组的大薯率(重量大于100 mg),大薯率在60%以上的有:6号3%蔗糖+0.1 mg/L GA+液体培养基;9号5%蔗糖+0 mg/L GA+液体培养基;12号5%+1.0 mg/L GA+液体培养基;和15号8%蔗糖+0.5 mg/L GA+液体培养基。5号3%蔗糖+0 mg/L GA+固体培养基和13号8%蔗糖+0 mg/L GA+固体培养基没有薯重大于100 mg的马铃薯。当蔗糖的含量相同时,无论施加GA的含量,液体培养基的薯重都大于固体培养基的薯重(图 3-D)。
3 讨论马铃薯块茎形成的过程是一个十分复杂的过程,据研究有几种可能的调控途径都会影响马铃薯的结薯过程[6-10],蔗糖的调控途径与GA调控途径的关系也有很多人在探索,Xu[9]和郭春华等[19]认为蔗糖通过影响GA水平来影响马铃薯块茎的形成,郭春华等人提出在试管薯诱导的过程中必须添加高浓度的蔗糖,因为蔗糖会降低赤霉素活性从而促进结薯,而这种赤霉素活性的降低是通过蔗糖与赤霉素结合形成配糖体来实现的。而Ou等[20]发现GA可以影响马铃薯液泡酸性转化酶(vacuolar acid invertase,vacINV)基因启动子活性,并推测GA可以促进vacINV的表达,促进蔗糖分解从而达到抑制结薯的目的。García等[21]认为蔗糖可能通过调控ABA应答元件结合蛋白(AREB/ABF)类转录因子的表达而参与ABA-GA信号交联途径促进结薯。Chincinska等[22]则认为光周期和GA会影响蔗糖运输蛋白stSUT4的表达,从而影响可能的下游基因stCOL3和stFT的表达和蔗糖的运输来影响块茎的形成。由此可见,马铃薯块茎的调控过程是各种调控途径相互关联的结果。
本实验通过蔗糖、GA以及培养基类型的三因素的正交试验选出马铃薯试管薯结薯的最优培养基。对实验结果进行极差分析(表 2),3个因素对马铃薯结薯数的影响程度大小分别是蔗糖浓度>GA浓度>培养基种类,其中培养基种类对马铃薯的结薯数几乎无影响。液体培养基中马铃薯在培养基中的匍匐茎呈现膨大状态(图 1-B),但没有发育成完整的成熟马铃薯。这可能是由于培养瓶空间和培养基营养有限造成的,所以结薯期晚的液体培养基中大多形成膨大的匍匐茎,而未形成马铃薯。
对马铃薯薯重的影响程度大小分别是培养基种类>GA浓度>蔗糖浓度,由于添加1%的蔗糖的培养基未结薯,所以在计算极差时不考虑在内。在图 2-C中,可以明显的看到液体培养基6号、9号和14号形成的马铃薯大于固体培养基5号、10号和13号形成的马铃薯。
对马铃薯的大薯率的影响程度大小分别是培养基种类>GA浓度>蔗糖浓度,但GA浓度和蔗糖浓度对大薯率的影响几乎无差别。从图 3-D中可以看到,液体培养基的大薯率明显高于固体培养基。由于在晚结薯的液体培养基中,如7号培养基匍匐茎膨大很明显但未能形成成熟的马铃薯(图 2-B),所以未能得到数量多的马铃薯,但是如果给与更多的营养与空间是有可能产生更多的马铃薯。
通过对实验结果的分析发现蔗糖、GA和培养基种类都能影响马铃薯的块茎形成过程。高浓度的蔗糖能够促使马铃薯结薯,这与胡云海[23],霍凤兰等[15]的研究结果一致,但本实验发现高浓度蔗糖只是缩短了马铃薯结薯的时间,并不能增加结薯的总量。液体培养基能够显著地提升马铃薯的薯重,增大马铃薯的大薯率,这与霍凤兰[15],刘玲玲等[24]的结果相同。GA对马铃薯结薯的抑制[25]过程也不是绝对的,在蔗糖浓度相同时,在液体培养基中施加低浓度的GA比固体培养基中不添加GA的马铃薯结薯多,这可能是由于GA能够增加马铃薯匍匐茎数目,促使匍匐茎伸长,而马铃薯块茎是匍匐茎膨大形成的;液体培养基可能促进了匍匐茎的膨大,所以液体培养基中的匍匐茎数量多,发生膨大,也可以解释收获的马铃薯大多呈长条状,所以GA与液体培养基的组合对马铃薯块茎的形成十分有利。但蔗糖和GA在马铃薯块茎形成的具体分子机制还需要进一步研究证明。
通过本实验的研究得到了使试管薯结薯增多薯重增大的培养基,加快了试管薯的繁育速度,增加了试管薯的体积,解决了利用块茎作为外植体的马铃薯的遗传转化的外植体获得时间长的问题,对马铃薯种薯的繁育也有一定的积极意义。
4 结论本实验通过设计蔗糖浓度、GA浓度及培养基类型的正交实验,对马铃薯的结薯时间、结薯数量、薯重和大薯率进行统计,得到添加8%蔗糖和0.1 mg/L GA的液体MS培养基能够使马铃薯提前结薯并且得到的马铃薯数量多,薯重大。
| [1] |
盖钧镒. 作物育种各论[M]. 北京: 中国农业出版社, 1997, 330-352.
|
| [2] |
梁蕴睦, 孟建明, 虎岷, 等. 张掖加工型马铃薯生产中存在的问题及建议[J]. 甘肃农业科技, 2008(12): 43-45. DOI:10.3969/j.issn.1001-1463.2008.12.016 |
| [3] |
郭利康, 高强. 天水市马铃薯产业现状及发展对策[J]. 甘肃农业科技, 2008(12): 46-48. DOI:10.3969/j.issn.1001-1463.2008.12.017 |
| [4] |
何伯伟. 如何进一步发展试管薯工程[J]. 浙江现代农业, 1996(6): 20-23. |
| [5] |
Vander Zaag DE. Recent trends in development, production and utilization of the potato crop in the world[J]. Asian Potato Journal, 1990, 12-19. |
| [6] |
吕长文, 王季春, 唐道彬, 等. 马铃薯试管结薯的光周期诱导效应研究[J]. 中国马铃薯, 2004, 18(2): 68-72. |
| [7] |
王谧, 王西瑶, 刘帆, 等. 大量元素不同浓度组合对试管马铃薯结薯的影响[J]. 中国农学通报, 2007, 23(2): 65-69. |
| [8] |
郭得平, 应振土, ShanGA. 植物激素与马铃薯块茎形成[J]. 植物生理学报, 1991(2): 130-133. |
| [9] |
Xu X. The role of gibberellin, abscisic acid, and sucrose in the regulation of potato tuber formation in vitro[J]. Plant Physiology, 1998, 117(2): 575-584. DOI:10.1104/pp.117.2.575 |
| [10] |
杨文玉. 不同组织培养条件对马铃薯试管微型薯的诱导[J]. 马铃薯杂志, 1996, 10(1): 20-22. |
| [11] |
黄德宝, 唐朝荣. 高等植物蔗糖转运的分子调控[J]. 生物技术通报, 2010(4): 1-6. |
| [12] |
Sheen J, Zhou L, Jang JC. Sugars as signaling molecules[J]. Current Opinion in Plant Biology, 1999, 2(5): 410-418. DOI:10.1016/S1369-5266(99)00014-X |
| [13] |
Raíces M, Ulloa RM, Macintosh GC, et al. StCDPK1 is expressed in potato stolon tips and is induced by high sucrose concentration[J]. Journal of Experimental Botany, 2003, 54(392): 2589. DOI:10.1093/jxb/erg282 |
| [14] |
王迎男, 秦永林, 苏亚拉其其格, 樊明寿. 外源蔗糖供应对马铃薯块茎形成的影响[C]. 北京: 2015年中国马铃薯大会, 2015: 339-343.
|
| [15] |
霍凤兰, 栾清业, 尹玉花. 蔗糖浓度和光照对马铃薯试管薯诱导的影响[J]. 甘肃农业科技, 2009(11): 3-5. DOI:10.3969/j.issn.1001-1463.2009.11.001 |
| [16] |
Menzel CM. Tuberization in potato at high temperatures:responses to gibberellin and growth inhibitors[J]. Ann Bot, 1980, 46(3): 259-265. DOI:10.1093/oxfordjournals.aob.a085916 |
| [17] |
刘梦芸, 蒙美莲, 门福义, 等. 光周期对马铃薯块茎形成的影响及对激素的调节[J]. 中国马铃薯, 1994(4): 193-197. |
| [18] |
全锋, 张爱霞, 曹先维. 植物激素在马铃薯块茎形成发育过程中的作用[J]. 中国马铃薯, 2002(1): 29-32. |
| [19] |
郭华春, 林满. 马铃薯块茎诱导中高浓度蔗糖对内源赤霉素活性的影响[C]//张家口: 中国作物学会马铃薯专业委员会2002年年会论文集. 2002.
|
| [20] |
Ou Y, Song B, Liu X, et al. Promoter regions of potato vacuolar invertase gene in response to sugars and hormones[J]. Plant Physiology & Biochemistry, 2013, 69(8): 9. |
| [21] |
García MNM, Stritzler M, Capiati DA. Heterologous expression of Arabidopsis ABF4, gene in potato enhances tuberization through ABA-GA crosstalk regulation[J]. Planta, 2014, 239(3): 615. DOI:10.1007/s00425-013-2001-2 |
| [22] |
Chincinska IA, Liesche J, Krügel U, et al. Sucrose transporter StSUT4 from potato affects flowering, tuberization, and shade avoidance response[J]. Plant Physiology, 2008, 146(2): 515. |
| [23] |
胡云海, 蒋先明. 不同糖类和BA对马铃薯(S. Tuberosum)试管薯的影响[J]. 中国马铃薯, 1989(4): 203-206. |
| [24] |
刘玲玲. 光照和培养基类型对马铃薯微型薯诱导结薯的影响[J]. 黑龙江农业科学, 2004(6): 21-23. |
| [25] |
Yamaguchi S. Gibberellin metabolism and its regulation[J]. Annual Review of Plant Biology, 2008, 59(4): 225-251. |