马铃薯(Solanum tuberosum L.)属于茄科多年生草本植物,块茎可供食用,是全球第四大重要的粮食作物,仅次于小麦、稻谷和玉米。由于马铃薯在生产中长期采用无性繁殖,病毒积累危害,造成马铃薯产量和质量下降。利用植物茎尖分生组织培养技术获得马铃薯脱毒苗,将脱毒苗进行组织培养获得的种薯为脱毒试管薯[1]。试管薯因其无病毒感染,不受季节影响,易储存等优点已成为继脱毒试管苗之后保存种质和生产无毒种薯的一种新形式。但是目前脱毒试管薯的应用面积比例并不大,主要是存在试管薯诱导效率低,成本较高,结薯小不能满足生产需要等问题。
马铃薯块茎形成受到诸如光照、温度、氮素等多种外界因子的影响,其中短日照(Short day,SD)对诱导马铃薯块茎形成有非常重要的影响[2],实验证明SD诱导植株产生的块茎形成刺激物质可通过嫁接传递[3],所以植物生长调节物质成为探究马铃薯种薯生长发育的重要组成部分。胡云海等[4]发现生长素IAA和NAA能促进微型薯个数和重量的增加。众多研究表明赤霉素(Gibberellin,GA)对马铃薯块茎形成有抑制作用,内源GA水平的降低是马铃薯匍匐茎膨大的重要因素[5]。由于马铃薯组培苗继代之后容易出现弱化、丛生等现象,多效唑、丁酰肼等植物生长抑制剂被广泛用于马铃薯组培苗的壮苗。丁酰肼(B9),为低毒性植物生长抑制剂,化学式C6H12N2O3,是GA的生化合成抑制剂[6]。实验表明,B9对马铃薯种薯的生长发育有促进作用[7],说明GA的抑制剂可以促进马铃薯种薯形成。但是2017年Ševčíková等[8]利用UHPLC-MS/ MS分析马铃薯自发结薯突变体内的GAS含量,结果表明,在突变体结薯期间GAS的含量远高于普通马铃薯,并对GA抑制马铃薯块茎形成的作用提出怀疑。因为组织培养实验结果也证明GA会抑制马铃薯试管薯形成,所以并未对此结果下定论。但是Yamaguchi[5]、宿飞飞[7]、Ševčíková等[8]的组织培养方法是单独施加GA或者B9来探究激素对于马铃薯的影响,此实验方法只能单一的探究GA含量增长或者降低对马铃薯的影响,所以得出的结论不能准确反映GA对于马铃薯种薯生长发育过程的影响。本研究通过在培养基中同时添加不同浓度的GA与B9,并观察测量马铃薯薯种的变化,来探究GA和B9对马铃薯生长发育的影响。
1 材料与方法 1.1 材料植物材料:马铃薯“Desiree”。试剂:MS粉末(Phyto Technology),蔗糖(科密欧),琼脂(Solarbio),Ca(NO3)2(SIGMA),可溶性淀粉(科密欧),I2(麦克林),IK(国药)。
1.2 方法 1.2.1 试管苗的培养用MS+3%蔗糖+1%琼脂(MS3)培养马铃薯茎段,将脱毒马铃薯苗剪段插瓶培养至马铃薯苗生长良好,一株可继代出5-6株,为后续实验做准备。
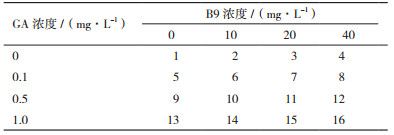
1.2.2 激素的施用基本培养基为MS培养基,使用不同浓度的GA和不同浓度的B9做成4×4的正交实验(表 1)。将马铃薯剪成5 cm长的茎段,每瓶5个茎段,1株顶芽,4株侧芽(每株侧芽带一片叶一个腋芽点),每种培养基一共栽种40株。
每周统计每株马铃薯的株高,侧芽数,叶片数(除顶芽部分),第4周以后由于株高生长到培养瓶顶端,会影响测量的准程度,所以停止对株高的测量。第8周开始对马铃薯侧芽,马铃薯结薯数,薯重进行统计。
1.2.3 淀粉含量的测定利用徐昌杰等[9]的方法绘制淀粉含量标曲,测定16种培养基中马铃薯块茎的淀粉含量。
1.2.4 数据分析利用SPSS软件对数据进行分析,利用GraphPad Prism 6作图。
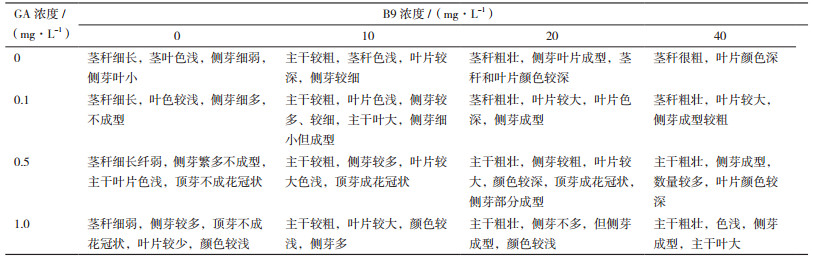
2 结果 2.1 GA与B9对马铃薯外形的影响马铃薯植株栽种进培养基到长成植株的8周后,观察每种培养基中的马铃薯植株的外观,进行统计(表 2)。
添加B9的马铃薯植株叶片宽大,茎秆粗壮,但是株高较矮,添加GA的马铃薯株高较高,侧芽较多,但是叶片细小,茎秆细弱,GA与B9同时添加时,马铃薯叶片宽大,茎秆粗壮,株高正常,侧芽较多但是侧芽粗壮成型(图 1)。

|
| 图 1 不同培养基对马铃薯外形的影响 1号:0 mg/L GA+0 mg/L B9;3号:0 mg/L GA+20 mg/L B9;11号:0.5 mg/L GA+20 mg/L B9;13号:1.0 mg/L GA+0 mg/L B9 |
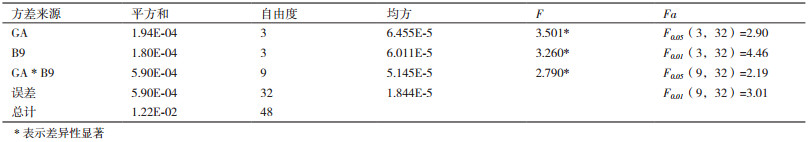
GA会促进马铃薯植株长高,GA浓度为1.0 mg/L,B9浓度为0 mg/L时马铃薯苗最高。B9对马铃薯株高的影响则正好相反,B9浓度为40 mg/L,GA浓度为0 mg/L最矮。GA与B9对马铃薯的共同作用则显示(图 2-A),在GA浓度相同时,B9的浓度越高株高越矮;B9浓度相同时,GA浓度越高,株高越高。
|
| 图 2 GA与B9对马铃薯株高,侧芽,叶片的影响 A:GA与B9对马铃薯株高的影响;B:GA与B9对马铃薯侧芽顶芽差值的影响;C:GA与B9对马铃薯叶片数的影响;D:GA与B9对马铃薯茎段高的影响;E:GA与B9对马铃薯侧芽数的影响;F:GA与B9对马铃薯侧芽发生率的影响 |
GA对马铃薯株高有促进作用,但是GA对于顶芽和侧芽的影响却存在差异,在施加相同浓度的GA时,马铃薯侧芽高度要大于顶芽,施加0.1 mg/L GA+0 mg/L B9的培养基中,侧芽与顶芽的差值最高。在GA浓度相同时,施加B9的培养基上生长会缩短顶芽高度的差距(图 2-B)。
2.2.3 GA与B9对马铃薯每段茎节高度的影响根据对马铃薯叶片数(除顶芽)的统计,不同培养基之间的叶片数相差不大(图 2-C),但是由于总株高有差异,所以每一段茎节的高度[茎节高度(cm)=株高(cm)/叶片数(除顶芽)]就有差异,可见随着GA浓度的增高,每一茎节的高度逐渐增高。添加B9可以缩短马铃薯每段茎节高度(图 2-D)。
2.3 GA与B9对马铃薯侧芽的影响当B9浓度为0 mg/L时,各种GA浓度下侧芽数都高于同组的其他值。其中施加GA浓度为0.5 mg/L时,侧芽数最高。施加B9之后侧芽数就会显著降低(图 2-E)。当B9浓度为0 mg/L时,在各种GA浓度下侧芽的发生率[侧芽发生率(%)=侧芽数/叶片数(除顶芽)×100%]都达到80%以上,其中当施加GA浓度为0.5 mg/L时,侧芽发生率达到91.67%。而对照组的侧芽发生率只有56.06%。在同一个GA浓度下,施加B9会减少侧芽的发生率(图 2-F)。
2.4 GA与B9对马铃薯结薯的影响马铃薯试管苗在生长后期会产生种薯,不同部位的种薯形状与长势不同。根部长出的种薯数量多,全部在培养基中发育,但是颗粒小,无法长大,也没有芽点;茎部长出的种薯数量偏少,部分在培养基中发育,部分在空气中发育,颗粒大,有芽点可以再生成马铃薯植株,所以对茎部长出的马铃薯进行统计。
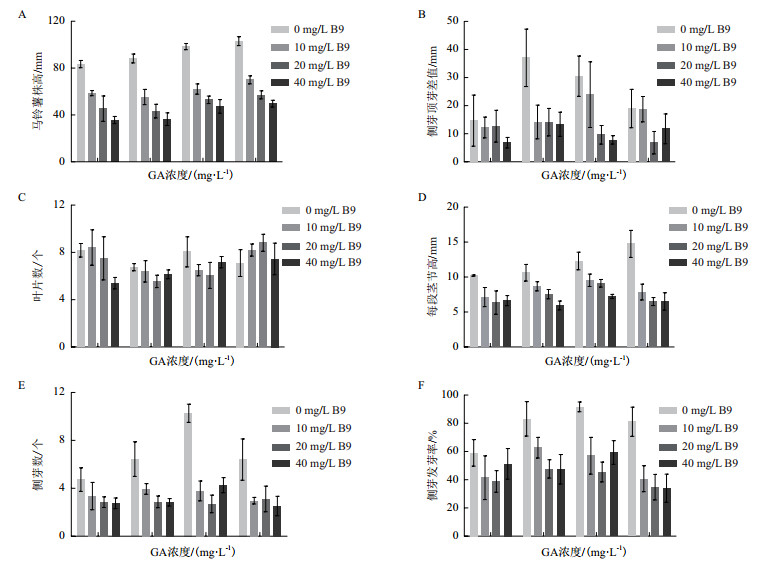
在第80天统计马铃薯茎部的结薯情况,随着B9浓度的增加,马铃薯的结薯率逐渐增加,但是最高不超过0.5个/株,单独添加GA的培养基中结薯率都在0.2个每株上下,但是GA和B9同时添加时,马铃薯的结束率增大到0.8个/株,最高能达到1.33个/株。其中,第6,7,10号培养基的马铃薯结薯率达到了1.2个马铃薯每株,远高于对照组0.2个/株(图 3-A)。
|
| 图 3 GA与B9对马铃薯结薯的影响 A:GA与B9对马铃薯结薯率的影响;B:GA与B9对马铃薯块茎均重的影响 |
将所的的所有马铃薯进行重量统计,只添加GA的马铃薯块茎均重在GA浓度为0.5 mg/L时最大,为180.19 mg;只添加B9的马铃薯块茎均重在浓度为20 mg/L时最大,为131.75 mg;GA和B9同时添加时,培养基中激素组合为0.1 mg/L GA+20 mg/L B9,0.1 mg/L GA+40 mg/L和0.5 mg/L GA+40 mg/L B9时,马铃薯块茎均重达到200 mg以上,其中0.1 mg/L GA+20 mg/L B9的激素浓度组合马铃薯均重最大达到351 mg(图 3-B)。
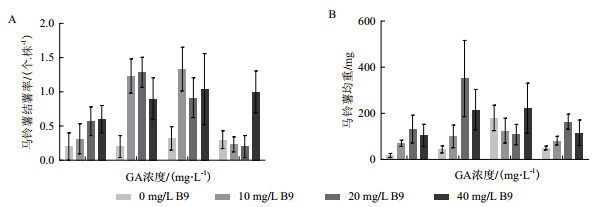
将马铃薯薯重做成箱图(图 4)显示,部分数据离散程度很大,不够集中,如6号、7号培养基所得的马铃薯薯重;而5号、16号培养基马铃薯薯重虽然集中但均重不大。
|
| 图 4 GA与B9对马铃薯薯重离散程度的影响 A:低重量马铃薯薯重离散分布图;B:中等重量马铃薯薯重离散分布图;C:高重量马铃薯薯重离散分布图 |
用可溶性淀粉制作淀粉含量的标准曲线,得到标准曲线y = 0.162 1x-0.002 7,R2=0.999 02。通过对不同激素组合的培养基中收取的马铃薯进行淀粉含量的测量,利用标曲和计算公式计算出马铃薯中的淀粉含量(mg/g)。对数据的单因素方差分析显示,施加0.5 mg/L GA时,马铃薯淀粉含量最高,但与0 mg/L和0.1 mg/L GA没有显著性差异,但是1.0 mg/L GA会对马铃薯淀粉含量有抑制作用,且与其他组有显著性差异。
施加40 mg/L B9会降低马铃薯中的淀粉含量(图 5-A)。对16种培养基中马铃薯种薯淀粉含量测定表明添加0.5 mg/L GA+0 mg/L B9时马铃薯种薯淀粉含量最高,1.0 mg/L GA+40 mg/L B9马铃薯种薯淀粉含量最低(图 5-B)。
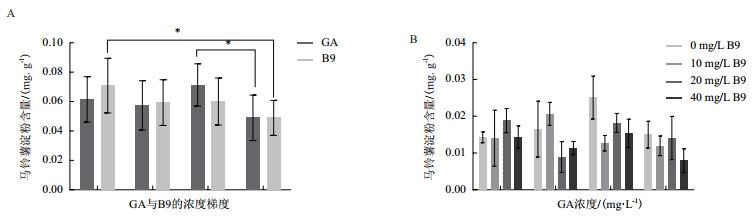
|
| 图 5 马铃薯淀粉含量的测定 A:GA与B9对马铃薯块茎淀粉含量的单因素方差分析,分析GA与B9对淀粉含量的单独影响。GA的4个浓度梯度为0、0.1、0.5、1.0 mg/L;B9的4个浓度梯度为0、10、20、40 mg/L。*表示两者之间有显著性差异;B:不同培养基培养的马铃薯种薯中的淀粉含量 |
研究表明,多种激素参与调控马铃薯种薯的形成[4-5, 7],GA在马铃薯种薯生长发育中的作用很早就被发现,Vreugdenhil[10]和连勇等[11]认为GA3对马铃薯的块茎形成有抑制作用。且GA被认为在马铃薯种薯形成过程起着主导作用,其他植物生长调节剂是改变GA的水平来影响种薯的生长发育[12],SD诱导块茎形成的作用也被认为是与其调节植株组织中GA含量降低有关[13]。但在对SD诱导种薯形成机制的探究过程中发现GA对马铃薯块茎形成也可能有促进作用[14]。
本实验通过施加GA与B9探索这两种植物生长调节物质对马铃薯种薯生长发育的影响,发现GA与B9同时使用对马铃薯种薯的形成有显著的影响。在结薯率方面,当GA与B9同时使用时,马铃薯结薯数明显大于单独使用GA和B9(图 3-A)。当只施加低浓度的GA时,马铃薯块茎形成会受到抑制,但同时施加B9后块茎形成会被促进,说明马铃薯块茎形成需要一定量的GA参与,也需要GA的抑制剂抑制其功能。这一结果看似矛盾,但是却反映出GA对马铃薯块茎形成的影响不是单一的促进或者抑制,而是一个必要的且作用量存在峰值的过程。这可以印证许珍等[14]提出的GA对马铃薯块形成可能有促进作用,也印证了Ševčíková等[8]发现的在自发结薯马铃薯突变体结薯期GAs含量会明显增多的现象。在薯重方面,不同的培养基得到的马铃薯薯重也不同,由于1号、15号培养基只收到3个马铃薯无法制作箱图舍去。其中7号,8号,12号马铃薯薯重明显大于其他培养基(图 3-B),但是马铃薯薯重的数据离散程度很大,其中7号培养基结的马铃薯最大达到1 000.3 mg,但其他马铃薯重量偏低,所以虽然7号培养基马铃薯均重大,但数据不集中(图 4-C)。这可能是由于马铃薯植株之间的变异程度大,同一品种的马铃薯植株之间可能存在差异[15]。
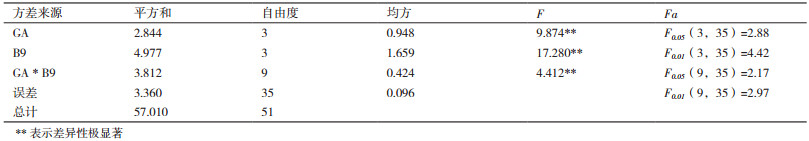
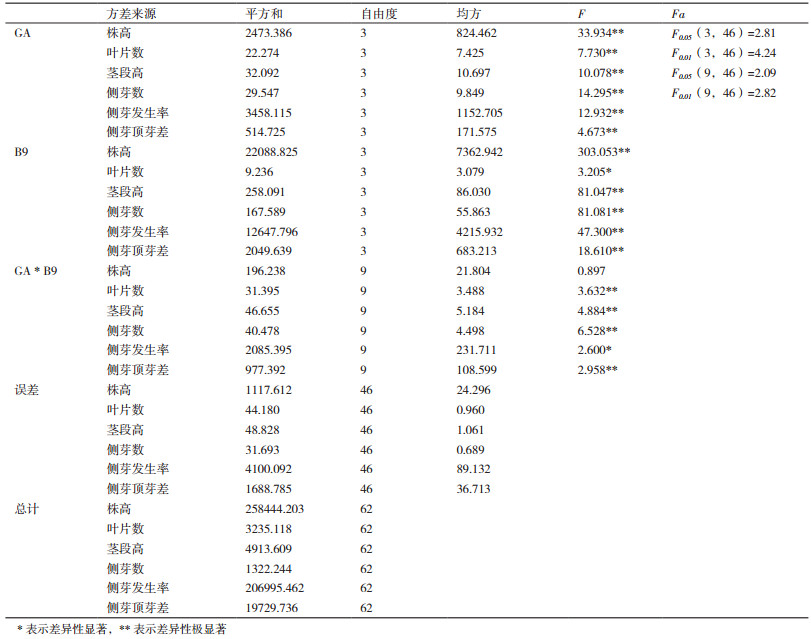
除了马铃薯的结薯率和薯重,实验中也探究了GA与B9对马铃薯植株株高、侧芽及叶片的影响,发现GA对马铃薯株高,叶片数,茎段高,侧芽数,侧芽发生率,侧芽顶芽差都有极显著的影响;B9对叶片数的影响不如GA显著;GA与B9的交互作用对马铃薯的株高是没有影响的,对叶片数,茎段数,侧芽数,侧芽发生率,侧芽顶芽高度差都有极显著的影响的(表 4)。表明GA会促进马铃薯茎秆的伸长,侧芽的增多,马铃薯块茎的形成是马铃薯匍匐茎茎段膨大的结果,所以侧芽数多可能是提高马铃薯结薯率的因素,但是,添加GA的马铃薯植株后期叶片弱小,茎秆细弱,这可能会影响马铃薯的光合作用,影响马铃薯的生长,从而影响马铃薯的结薯率。添加B9会使马铃薯茎秆粗壮,叶片宽大,但是会减少侧芽的发生率,所以这也可能是单独添加B9的促进效果不如B9和GA同时添加的效果显著的原因。
马铃薯块茎中约有20%的干物质,大部分由淀粉组成[16],所以淀粉含量是评价马铃薯质量的重要指标。马铃薯淀粉在工业加工、食品行业、房屋筑造等行业都有广泛的应用[17]。并且马铃薯淀粉的许多特性指标都已成为行业内的参考标准[18]。已有研究证明GA3处理的葡萄果实前期会有淀粉的累积[19],施用GA会增加小麦中的淀粉含量[20],提高ABA与GA的比值,有助于灌浆初期水稻籽粒中淀粉的累积[21]。说明GA对植物中淀粉含量的累积是有影响的。通过实验发现一定浓度的GA会促进马铃薯块茎淀粉含量的累积,但是高浓度的GA会降低马铃薯块茎的淀粉含量(表 5),这有可能是由于GA会提升α-淀粉酶的活性,高浓度的GA促使α-淀粉酶将淀粉转换成可溶性糖,将马铃薯块茎中的淀粉合成和降解的平衡打破,加速淀粉降解[22-23]。
马铃薯种薯的生长发育是一个复杂的过程,受多种调控途径调控。本实验对GA与B9对马铃薯种薯生长发育的影响进行了探究发现,同时施用两种激素会大幅度提高马铃薯的结薯率,但是GA对马铃薯结薯影响的分子机制仍需要进一步探究。
4 结论通过在马铃薯培养基中添加不同浓度的GA3和B9,对马铃薯的生长过程中茎,叶,芽,种薯进行观察统计,发现0.5 mg/L GA与20-40 mg/L B9同时作用时马铃薯植株生长良好,马铃薯种薯结薯最多,淀粉含量最高。
| [1] |
Vander Zaag DE. Recent trends in development, production and utilization of the potato crop in the world[J]. Asian Potato Journal, 1990, 12-19. |
| [2] |
Jackson SD. Multiple signaling pathways control tuber induction in potato[J]. Plant Physiology, 1999, 119(1): 1-8. DOI:10.1104/pp.119.1.1 |
| [3] |
Gregory LE. Some factors for tuberization in the potato plant[J]. American Journal of Botany, 1956, 43(4): 281-288. DOI:10.1002/ajb2.1956.43.issue-4 |
| [4] |
胡云海, 蒋先明. 植物激素对微型薯形成的影响[J]. 中国马铃薯, 1992(1): 14-22. |
| [5] |
Yamaguchi S. Gibberellin metabolism and its regulation[J]. Annual Review of Plant Biology, 2008, 59(4): 225-251. |
| [6] |
张一宾. 植物激素的激动剂和拮抗剂及其生理作用——乙烯、赤霉素、茉莉酸[J]. 世界农药, 2014, 36(2): 14-19. |
| [7] |
宿飞飞. B9对脱毒马铃薯试管苗生长及移栽结薯数的影响[J]. 黑龙江农业科学, 2010(2): 7-8. |
| [8] |
ŠevčíkováH, MaškováP, TarkowskáD, 等. Carbohydrates and gibberellins relationship in potato tuberization[J]. Journal of Plant Physiology, 2017, 214: 53-63. |
| [9] |
徐昌杰, 陈文峻. 淀粉含量测定的一种简便方法——碘显色法[J]. 生物技术, 1998(2): 41-43. |
| [10] |
Vreugdenhil D, Boogaard Y, Visser RGF, et al. Comparison of tuber and shoot formation from in vitro cultured potato explants[J]. Plant Cell Tissue & Organ Culture, 1998, 53(3): 197-204. |
| [11] |
连勇. 马铃薯块茎发育与休眠[M]//陈伊里, 屈冬玉. 高新技术与马铃薯产业. 哈尔滨: 哈尔滨工程大学出版社, 2002.
|
| [12] |
Xu X, van Lammeren AA, Vermeer E, et al. The role of gibberellin, abscisic acid, and sucrose in the regulation of potato tuber formation in vitro[J]. Plant Physiology, 1998, 117(2): 575. DOI:10.1104/pp.117.2.575 |
| [13] |
Yamaguchi S. Gibberellin metabolism and its regulation[J]. Annual Review of Plant Biology, 2001, 20(4): 317-318. |
| [14] |
许真, 徐蝉, 郭得平. 光周期调节马铃薯块茎形成的分子机制[J]. 中国细胞生物学学报, 2008, 30(6): 731-736. |
| [15] |
陈兆贵, 曾庆鸿, 林若徐. 马铃薯不同株系之间的DNA甲基化变异研究[J]. 作物杂志, 2014(1): 63-67. |
| [16] |
王彦宏, 刘福刚, 廉华, 等. 马铃薯高淀粉栽培研究进展[J]. 中国马铃薯, 2010, 24(1): 50-53. |
| [17] |
姚新灵. 内源淀粉特性比较研究[J]. 世界科技研究与发展, 2001, 23(3): 48-51. |
| [18] |
谢碧霞, 钟秋平, 谢涛, 等. 淀粉的特性与应用研究现状及发展对策[J]. 经济林研究, 2004, 22(4): 61-64. |
| [19] |
李鹏程, 李铭, 郁松林, 等. GA3对葡萄果实淀粉积累及代谢相关酶活性的影响[J]. 北方园艺, 2011(11): 17-20. |
| [20] |
于安玲. 芸薹素(BR)和赤霉素(GA)对小麦籽粒淀粉积累、粒度分布及加工特性的影响[D]. 泰安: 山东农业大学, 2011.
|
| [21] |
杨建昌, 苏宝林. ABA与GA对水稻籽粒灌浆的调控[J]. 作物学报, 1999(3): 341-348. |
| [22] |
王永章, 张大鹏. 果糖和葡萄糖参与诱导苹果果实酸性转化酶翻译后的抑制性调节[J]. 中国科学:, 2002, 32(1): 30-39. |
| [23] |
柳洪卫, 马国达, 刘声远, 等. 赤霉素(GA)对马铃薯微型薯形成影响的研究[J]. 中国马铃薯, 2002, 16(3): 141-143. |