大丽轮枝菌(Verticillium dahliae Kleb.)是一种土壤传播的植物病原真菌,通过根部侵染宿主微管组织,引发植物黄萎病[1]。其寄主范围广泛,可危害400多种经济作物,已成为严重影响棉花、茄子、马铃薯、向日葵等作物生产的重要病原之一[2-3]。
大丽轮枝菌因其分生孢子便于收集,以分生孢子作为转化材料在功能基因组的研究中取得了很大的进展,如致病性相关基因VMK1和VGB[4-5],与微菌核生长发育相关的基因VDH1、VdPKAC1和VdPR3[6-8],以及效应子蛋白基因VdSCP7和LysM的功能鉴定[9-10],均以分生孢子作为遗传转化材料通过农杆菌介导的转化方法完成的。农杆菌介导的遗传转化技术以其操作简便、转化效率高、转化子稳定和插入位点无序列特异性等优点,已经广泛用于丝状真菌的功能基因的遗传操作。但对于一些特殊基因,如真菌细胞壁合成相关基因的鉴定,则需要以原生质体作为研究材料,通过再生细胞壁的过程进行鉴定[11],但是目前可供参考的有关大丽轮枝菌原生质体制备及再生体系的研究报道还很缺乏。
原生质体是去掉细胞壁的活体细胞,它既可以作为一个单细胞系统来研究细胞分裂与分化、细胞器涉入、细胞壁再生、信号转导机制、病毒侵染机理、离子转运等基础理论,又能通过破碎细胞膜分离出大量完整的细胞器如线粒体、核糖体等,为细胞器的功能、结构、生理生化研究奠定基础[12-13]。原生质体作为重要的遗传转化材料通过PEG-CaCl2转化在植物病原丝状真菌稻瘟病菌(Magnaporthe oryzae)、禾谷镰刀菌(Fusarium graminearum)和刺盘孢菌(Colletotrichum spp.)的功能基因组研究中也得到广泛应用[14]。由于不同种类的真菌及同一种真菌处于不同菌龄,其细胞壁结构、组成及代谢组分存在差异[15],因此在真菌原生质体的制备过程中,温度、时间、酶浓度、渗透压稳定剂和pH等都会影响酶促反应,造成原生质体制备条件存在差异[16]。虽然原生质体的制备过程比较简单,但获得浓度较高、活性较高的原生质体比较困难。本研究针对大丽轮枝菌原生质体的制备,对菌龄、酶浓度、酶解温度、酶解时间、渗透压稳定剂等影响因素进行了优化;针对原生质体再生,对培养基种类、培养基中的Agar浓度及菌丝酶解时间进行了优化;并对优化条件下获得的原生质体进行了遗传转化,通过GFP瞬时表达,对原生质体的活性和转化体系进行了确定,旨在建立原生质体的制备和再生体系,为大丽轮枝菌的遗传转化及功能研究奠定基础。
1 材料和方法 1.1 材料 1.1.1 菌株及质粒大丽轮枝菌(Verticillium dahliae)落叶型强致病力菌株V592,由本实验室从棉花上分离、鉴定并保存;含GFP基因的重组质粒p1300-Trpc-HPT-PoliC-GFP-Nubter,由本实验室构建并保存。
1.1.2 主要试剂和培养基裂解酶(Lysing enzyme)购自美国Sigma公司,用渗透压稳定剂溶解配置,0.22 μm过滤器过滤灭菌。Miracloth滤布(22-25 µm,)购自美国Calbiochem公司。
TB3培养基:Yeast extract 3 g,casamino acid 3 g,sucrose 200 g,agar 7 g定容至1 L;SR培养基:Yeast extract 1 g,Enzymatic casein hydrolysate 1 g,Sucrose 342 g,Agar 15 g,定容至1 L。
1.2 方法 1.2.1 菌丝摇培时间对原生质体释放的影响将1 mL浓度为1×108个/mL的分生孢子加入100 mL YEPD中[17],于26℃,200 r/min分别摇培12、14、16、18和20 h收集菌丝,先用单层灭菌的Mirocloth滤布过滤菌液,再分别用100 mL无菌水和30 mL 1.2 mol/L的KCl冲洗菌丝;用镊子轻轻夹取菌丝,称取0.5 g放入50 mL的三角瓶中,加入10 mL浓度为5 mg/mL的酶解液,28℃、150 r/min酶解3 h;再用2层灭菌的Mirocloth滤布过滤收集原生质体。每个摇培时间设置3个重复,每个重复取样3次,利用血球计数板统计原生质体数量,以确定最佳的摇培时间。
1.2.2 酶浓度对原生质体释放的影响按照上述已确定的最佳摇培时间培养分生孢子并收集菌丝,然后在菌丝中分别加入不同浓度的酶解液,28℃、150 r/min酶解3 h。酶解液浓度梯度设置为1、2.5、5、10、20和25 mg/mL。酶解完成后,过滤收集原生质体。每个浓度梯度设置3个重复,每个重复取样3次,利用血球计数板统计原生质体个数,以确定最佳的酶浓度。
1.2.3 酶解温度和酶解时间对原生质体释放的影响以上述最佳摇培时间培养分生孢子并收集菌丝,然后加入上述确定的最佳浓度的酶解液,分别在不同温度下150 r/min酶解3 h,过滤收集原生质体并计数,以确定最佳的酶解温度。温度梯度设置为24、26、28、30、32和34℃[16, 18],每个温度设置3个重复,每个重复取样3次,用血球计数板统计原生质体个数。
以上述最佳摇培时间培养分生孢子并收集菌丝,再以上述确定的最佳酶浓度和最适温度将菌丝分别酶解2、3、4、5、6、7和8 h,然后过滤收集原生质体并计数,以确定最佳的酶解时间。每个酶解时间设置3个重复,每个重复取样3次,用血球计数板统计原生质体个数。
1.2.4 渗透压稳定剂及浓度对原生质体释放的影响本实验所用渗透压稳定剂为原生质体制备中常用的7种稳定剂(NaCl、KCl、MgSO4、蔗糖、葡萄糖、甘露醇和山梨醇),最初的浓度设定为0.6 mol/L[19-24]。以上述最佳摇培时间培养分生孢子并收集菌丝,先用100 mL无菌水冲洗菌丝,再分别用30 mL上述7种渗透压稳定剂冲洗菌丝;然后分别用7种渗透压稳定剂配置的酶解液(10 mg/mL)在上述优化的酶解条件下酶解菌丝体,再按照前面的方法收集原生质体并计数。
KCl和NaCl最适浓度的确定。KCl的浓度分别设置为0.4、0.6、0.7、0.8、1.0、1.2和1.4 mol/L;NaCl的浓度分别设置为0.4、0.5、0.6、0.7、0.8、0.9、1.0和1.2 mol/L。其他条件不变,按照上述方法制备原生质体并计数。每个浓度设置3个重复,每个重复取样3次。
1.2.5 pH对原生质体释放的影响将上述确定的渗透压稳定分别设置7个不同的pH条件,以上述明确的最佳摇培时间、酶浓度、酶解温度和酶解时间制备原生质体,以确定最适的pH值。pH分别设置为3、4、5、6、7、8、9;每个3个重复,每个重复取样3次原生质体个数。
1.2.6 再生培养基对原生质体再生的影响选择3种培养基PDA、TB3、SR[17, 25],采用双层覆盖法[18, 23]对原生质体进行再生培养。吸取0.1 mL浓度为1.0 × 102个/mL的原生质体悬液分别均匀涂布在Agar浓度1.5%的上述3种培养基平板上,再向其中分别倒入温度低于55℃的Agar浓度为1%的同样的培养基,摇匀覆盖。待上层培养基凝固后置于26℃黑暗培养60-80 h,取出统计再生菌落数并计算原生质体的再生率。同时将对照组原生质体用无菌双蒸水低渗裂解15 min,以同样方法均匀涂布并倒入再生培养基,以消除非原生质体形成的菌落所产生的误差。每种培养基设3个重复。原生质体再生率的计算公式如下:
再生率(%)=(原生质体再生菌落数-对照组再生菌落数/原生质体总数)×100%
1.2.7 Agar浓度对原生质体再生的影响选定合适的再生培养基后,设置7个Agar浓度(0.4%、0.5%、0.6%、0.7%、0.8%、0.9%和1.0%),按照上述描述的双层覆盖法对上层覆盖培养基中的Agar浓度进行选择。每个浓度设3个重复,统计再生菌落数,并计算原生质体的再生率。
1.2.8 酶解时间对原生质体再生的影响将菌丝体分别酶解2、3、4、5、6、7和8 h,然后将收集的原生质体稀释到1.0 × 102个/mL,按上述描述的双层覆盖法在选定的再生培养基上及最佳的Agar覆盖浓度中26℃下暗培养60-80 h,统计再生菌落数,并计算原生质体的再生率,以确定适宜原生质体再生的最适酶解时间。每个酶解时间设3个重复。
1.2.9 原生质体的转化将-80℃保存的原生质体取出于冰上解冻10 min或将刚制备的原生质体置于冰上,加入1-2 μg质粒轻轻混匀,对照加入相应体积的1×STC轻轻混匀,于冰上静置20 min。按照每管2 mL的量,逐滴加入1×PTC,滴完后冰上静置20 min。然后将25 mL预冷的1×STC缓慢倒入离心管中,4 000 r/min,4℃离心15 min,去上清;再加入3 mL温度低于55℃的再生培养基,混匀后置于26℃恒温箱中黑暗放置12-13 h进行细胞壁再生[17]。
1.2.10 计数及数据分析工具光学显微镜下原生质体的计数为10个视野中统计的平均数,每个样品为3个重复;采用SPSS软件对数据进行统计分析、用origin 8.0对数据进行图片制作。
2 结果 2.1 原生质体的制备 2.1.1 摇培时间对原生质体释放的影响将分生孢子分别摇培不同时间收集菌丝,摇培时间对原生质体释放量的影响如图 1-A所示,从12 h开始,原生质体的释放量随着摇培时间的延长而逐渐增加,18 h时释放量达到最大,20 h开始急剧下降;摇培18 h时原生质体释放量分别是16 h的4.1倍,是20 h的3.7倍,说明分生孢子摇培18 h是菌丝体释放原生质体的最佳摇培时间。

|
| 图 1 菌龄和酶浓度对原生质体释放的影响 A:菌龄对原生质体释放的影响;B:酶浓度对原生质体释放的影响;*代表差异极显著(P < 0.05),下同 |
为了确定裂解酶浓度和底物菌丝量之间的关系,将分生孢子摇培18 h收集菌丝,用不同浓度的裂解酶酶解4 h,统计原生质体的释放量。如图 1-B所示,随着酶浓度的升高,原生质体的释放量随之增加,当酶浓度为10 mg/mL和20 mg/mL时,原生质体的释放量无明显差异,均达到最大值,分别为2.05×107个/mL和2.04×107个/mL,是酶浓度为5 mg/mL的1.6倍,酶浓度为25 mg/mL的1.5倍,表明10-20 mg/mL的酶浓度是酶解菌丝释放原生质体的最适酶浓度。
2.1.3 酶解温度对原生质体释放的影响在一定温度范围内,提高酶解温度,有利于加速酶促反应。收集摇培18 h的菌丝,以10 mg/mL的酶浓度酶解4 h,比较不同酶解温度对原生质体释放的影响。由图 2-A看出,酶解温度30℃时,原生质体的释放量最大,但当超过32℃时,原生质体的量急剧下降,表明30℃的酶解温度最有利于原生质体的释放。
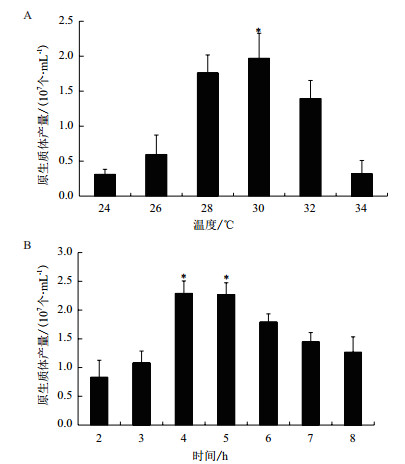
|
| 图 2 酶解温度和时间对原生质体释放的影响 A:酶解温度对原生质体释放的影响;B:酶解时间对原生质体释放的影响 |
在上述确定的最适条件下,即收集培养18 h的菌丝,加入10 mg/mL的裂解酶,在酶解温度为30℃的情况下对酶解时间进行确定。结果如图 2-B所示,随着酶解时间的延长,原生质体的释放量逐渐增加,酶解4-5 h时达到最大,分别为3.29×107个/mL和3.27×107个/mL,是酶解3 h的2倍,是酶解6 h的1.2倍。表明酶解4-5 h是菌丝体释放原生质体的最适酶解时间,且酶解时间明显影响原生质体的释放,时间过长或过短都不利于原生质体的释放。
2.1.5 渗透压稳定剂及浓度对原生质体释放的影响在上述确定的最适条件下,对原生质体制备中常用的7种渗透压稳定剂进行筛选,先以0.6 mol/L的常规浓度对7种稳定剂进行初步筛选,结果如图 3-A所示,KCl和NaCl作为渗透压稳定剂对原生质体的释放作用最强;山梨醇次之;MgSO4、甘露醇、葡萄糖和蔗糖对原生质体的释放几乎不起作用。因此,KCl和NaCl均可作为大丽轮枝菌原生质体制备过程中的渗透压稳定剂。为了确定渗透压稳定剂的浓度对原生质体释放的影响,对KCl和NaCl发挥作用的最适浓度进行了测定,结果如图 3-B和3-C所示,1.2 mol/L的KCl或0.7 mol/L的NaCl作为渗透压稳定剂对原生质体的释放效果最佳。

|
| 图 3 渗透压稳定剂及浓度对原生质体释放的影响 A:不同渗透压稳定剂对原生质体释放的影响;B:KCl的浓度对原生质体释放的影响;C:NaCl的浓度对原生质体释放的影响 |
缓冲体系的pH值是影响酶活的一个主要因素。在上述确定的最适条件下,即收集培养18 h的菌丝,加入10 mg/mL的裂解酶,30℃酶解4 h,以1.2 mol/L的KCl作为渗透压稳定剂,比较不同pH条件下原生质体释放情况。结果如图 4-A表明,当pH为6.0时,原生质体的释放量最大,每毫升酶液释放的原生质体产量可达3.3×107个/mL,在其他pH条件下,原生质体的释放量都比较少。此时通过显微观察,菌丝裂解后释放出密集的原生质体,原生质体多数为规则的圆球形,大小不一,质膜完整(图 4-B)。
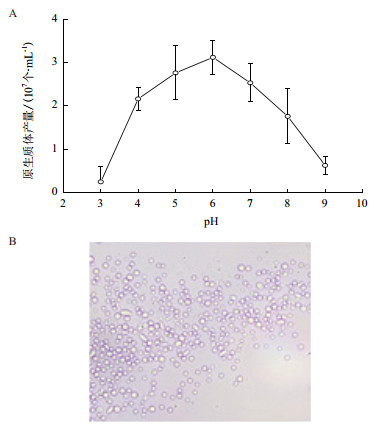
|
| 图 4 pH对原生质体释放的影响及原生质体形态观察 A:pH对原生质体释放的影响;B:原生质体形态观察(×400) |
采用双层覆盖法,对PDA、TB3和SR 3种培养基对原生质体再生情况进行了比较,结果(图 5-A)显示,原生质体在TB3、SR和PDA上的再生率分别为19.72%、18.56%和13.41%,表明TB3和SR作为再生培养基,其作用明显优于PDA培养基。

|
| 图 5 再生培养基、浓度和酶解时间对原生质体再生的影响 A:再生培养基对原生质体再生的影响;B:Agar浓度对原生质体再生的影响;C:酶解时间对原生质体再生的影响 |
以TB3作为再生培养基,对不同Agar浓度的覆盖培养基进行比较,结果(图 5-B)显示,Agar浓度为0.5%时,原生质体的再生率最高,达到22%;随着Agar浓度的增大,原生质体再生率随之降低,当Agar浓度高于1.0%时,原生质体再生率低于2%;由于Agar浓度低于0.5%时,培养基不易凝固,因此适于原生质体再生的上层覆盖培养基的Agar浓度为0.5%。该实验结果表明,双层覆盖法中上层覆盖培养基的浓度对原生质体的再生具有明显的影响。
2.2.2 酶解时间对原生质体再生的影响菌丝体的酶解时间明显影响原生质体的释放量,当菌丝体酶解4-5 h时原生质体的释放量最大(图 5-C)。为了明确酶解时间是否影响原生质体的再生,在上述明确的最佳条件下,确定酶解时间对原生质体再生的影响。结果表明,将菌丝体酶解4 h,原生质体再生率最高,达到22.45%;菌丝体酶解5 h时,再生率开始下降;当酶解时间延长到7 h时,原生质体再生率仅为5.28%,由此说明酶解时间也影响原生质体的再生。综合考虑原生质体的释放和再生,菌丝体的最适酶解时间是4 h。
2.3 原生质体的转化为了直观地观察以上制备的原生质体是否可以用于转化,将构建好的含GFP基因的重组质粒p1300-Trpc-HPT-PoliC-GFP-Nubter通过PEG-CaCl2介导对原生质体进行了转化。蓝色激发光下,未经载体转化的原生质体没有观察到绿色荧光,而经过载体转化的3个重复都有明显的绿色荧光,且原生质体结构完整,呈绿色小球型。并且经过重组质粒转化的原生质体与未经转化的对照一样,通过细胞壁再生都能萌发形成菌丝体(图 6),表明本研究所制备的原生质体具有活性,可用于遗传转化。由于本实验构建的重组质粒只能在真核细胞中瞬时表达GFP,因此当原生质体再生分化出菌丝体以后GFP绿色荧光逐渐减弱直至消失。
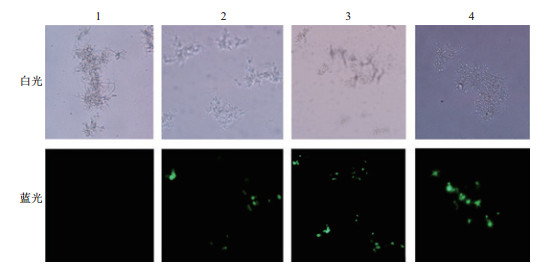
|
| 图 6 原生质体转化GFP的观察(×400) 1:未转化质粒的空白对照;2、3、4:转化质粒的3个重复 |
虽然大丽轮枝菌的功能研究通常以分生孢子作为重要的遗传转化材料,但对于一些特殊基因的功能鉴定仍然需要对原生质体进行遗传转化。由于原生质体的优劣直接影响转化效率,因此获得高质量的原生质体和再生体系对研究大丽轮枝菌非常重要。对于不同种类的真菌来讲,菌龄是影响原生质体制备的一个关键因素。甘蓝枯萎病菌(Fusarium oxysporum f.sp. conglutinans)摇培菌丝的时间为36 h时原生质体释放量达到最高[25],黑曲霉(Aspergillus niger)在培养4 d时释放的原生质体的量最多[26]。本实验发现,大丽轮枝菌分生孢子摇培时间少于18 h,由于分生孢子萌发产生的菌丝量较少,所以影响菌丝体的收集及原生质体的释放;当分生孢子摇培18 h时,此阶段由于分生孢子萌发产生的菌丝量较多,且处于生长旺盛期,所以更适合原生质体的制备;继续延长摇培时间,由于菌丝体分化产生了更多的分生孢子,也不利于原生质体的制备,因此获得更多新鲜的菌丝体对制备原生体非常重要。
由于不同种类真菌其细胞壁结构及组分不同,所需裂解酶浓度和酶解时间差异较大。弭宝彬对制备尖孢镰刀菌辣椒专化型(Fusedum oxysporum f.sp.capsicum)原生质体的条件进行优化时发现,当酶浓度为15 mg/mL时原生质体的产量最高,张丽霞等[27]发现使用2 mg/mL溶壁酶酶解猪苓菌丝得到原生质体的效果较好。本实验结果表明,20 mg/mL的酶和10 mg/mL的都能较好地释放原生质体,结合后面再生率的实验,表明10 mg/mL的酶液浓度为原生质体释放和再生的体系。酶解过程中,在一定范围内,裂解酶浓度越高,原生质体的产量也越大,但是当酶的浓度超过一定值后,原生质体的产量反而下降,甚至急剧下降,这是因为裂解酶中其他杂酶,如氧化物酶和核糖核酸酶,对原生质体造成破坏所致[16],另外,酶浓度过大,原生质体脱壁太彻底,对原生质体再生也会造成严重影响[15],同样酶解时间过短,菌丝体裂解不充分,影响原生质体的释放;酶解时间过长,造成质膜破坏,出现破裂不完整的原生质体,影响原生质体的产量、质量以及原生质体的再生。有研究报道,用Lysing enzyme和Driselase的混合酶对裂解大豆疫霉菌(Phytophthora sojae)细胞壁制备原生质体具有明显的增效作用[28]。姚婷婷等报道使用1%蜗牛酶+1%纤维素酶+0.1%溶菌酶对黑曲霉原生质体的释放有较好的作用[29]。本研究使用的裂解酶是Lysing enzyme,该酶含有降解真菌细胞壁所需的主要酶活成分,如纤维素酶,几丁质酶及蛋白酶等、这种酶与其他的酶系统混合使用对原生质体的制备是否有增效作用还有待进一步研究。
渗透压稳定剂既是维持原生质体内外渗透压稳定的关键因素,更是发挥酶活性的最佳的场所,因此使用不同的渗透压稳定剂,收获的原生质体量明显不同。常用渗透压稳定剂有无机盐离子和有机类化合物两大类。祝子坪发现以蔗糖为渗透压稳定剂的产量远高于用其他渗透压稳定剂的产量[22]。姚婷婷[29]发现,山梨醇是黑曲霉释放原生质体最佳的渗透压稳定剂。而本研究发现,无机盐类的KCl和NaCl是制备大丽轮枝菌原生质体的最佳渗透压稳定剂,而蔗糖、葡萄糖等有机化合物类物质不易作为大丽轮枝菌原生质体制备的渗透压稳定剂。
李伶俐[25]对甘蓝枯萎病菌原生质体再生的研究结果表明,SR比PDA更有利于甘蓝枯萎菌原生质体的再生,再生率可达21.13%。本研究对大丽轮枝菌原生质体再生的研究也得到同样的结果,TB3和SR作为再生培养基,其作用明显优于PDA培养基,上层覆盖培养基的Agar浓度为0.5%,再生率最高,达到22.45%,说明再生培养基种类及浓度影响原生质体的再生。
将含GFP基因的重组质粒对原生质体进行遗传转化,结果显示,GFP能够在原生质体中瞬时表达,说明本研究建立的原生质体制备和再生体系可用于大丽轮枝菌的遗传转化,为进一步研究大丽轮枝菌功能基因奠定了基础。
4 结论本实验将各种主要限制因素进行了优化,最后确定适于制备大丽轮枝菌原生质体的体系为:分生孢子培养18 h收集菌丝,用10 mg/mL的裂解酶于30℃酶解4 h,渗透压稳定剂选用1.2 mol/L的KCl,pH调至6,可以获得3.3×107个/mL的原生质体;原生质体再生以TB3作为再生培养基,上层覆盖培养基Agar的浓度为0.5%,再生率可达22.45%。
| [1] |
Woolliams GE. Host range and symptomatology of Verticillium dahliae in economic, weed and native plants in interior British Columbia[J]. Can J Plant Sci, 1966, 46(6): 661-669. DOI:10.4141/cjps66-110 |
| [2] |
Isaac I. Speciation in Verticillium[J]. Annu Rev Phytopathol, 1967, 5: 201-222. DOI:10.1146/annurev.py.05.090167.001221 |
| [3] |
Klosterman SJ, Atallah ZK, Vallad GE, et al. Diversity, pathogenicity, and management of verticillium species[J]. Annual Review of Phytopathology, 2009, 22(4): 39-62. |
| [4] |
Rauyaree P, et al. Mutations in VMK1, a mitogen-activated protein kinase gene, affect microsclerotia formation and pathogenicity in Verticillium dahliae[J]. Curr Genet, 2005, 48(2): 109-116. DOI:10.1007/s00294-005-0586-0 |
| [5] |
Tzima AK, Paplomatas EJ, et al. The G protein β subunit controls virulence and multiple growth- and development-related traits in Verticillium dahliae[J]. Fungal Genet Biol, 2012, 4: 271-283. |
| [6] |
Klimes A, Amyotte SG, Grant S, et al. Microsclerotia development in Verticillium dahliae:Regulation and differential expression of the hydrophobin gene VDH1[J]. Fungal Genet Biol, 2008, 12: 1525-1532. |
| [7] |
Tzima AK, Paplomatas EJ, Rauyaree P, et al. Roles of the catalytic subunit of cAMP-dependent protein kinase A in virulence and development of the soilborne plant pathogen Verticillium dahliae[J]. Fungal Genetics Biology, 2010, 47(5): 406-415. DOI:10.1016/j.fgb.2010.01.007 |
| [8] |
Zhang YL, Li ZF, Feng ZL, et al. Isolation and functional analysis of the pathogenicity related gene VdPR3 from Verticillium dahliae on cotton[J]. Curr Genet, 2015, 61(4): 555-566. DOI:10.1007/s00294-015-0476-z |
| [9] |
Zhang LS, Ni H, Du X, et al. The Verticillium-specific protein VdSCP7 localizes to the plant nucleus and modulates immunity to fungal infections[J]. New Phytologist, 2017, 215(1): 368-381. DOI:10.1111/nph.14537 |
| [10] |
Kombrink A, Rovenich H, Shi-kunne XQ, et al. Verticillium dahliae LysM effectors differentially contribute to virulence on plant hosts[J]. Molecular Plant Pathology, 2017, 18(4): 596-608. DOI:10.1111/mpp.2017.18.issue-4 |
| [11] |
Yang XY, Tu LL, Zhu LF, et al. Expression profile analysis of genes involved in cell wall regeneration during protoplast culture in cotton by suppression subtractive hybridization and macroarray[J]. Journal of Experimental Botany, 2008, 59(13): 3661-3674. DOI:10.1093/jxb/ern214 |
| [12] |
Knight MR, Anthony KC, Steven MS. Transgenic plant aequorin reports the effects of touch and cold-shock and elicitors on cytoplasmic calcium[J]. Nature, 1991, 352(5): 524-526. |
| [13] |
Sheen J. Singal transduction in maize and Arabidopsis mesophyll protoplases[J]. Plant Physiology, 2001, 127(4): 1466-1475. DOI:10.1104/pp.010820 |
| [14] |
韩小路, 白静科, 张玮, 等. 介导的苹果果生刺盘孢原生质体转化体系的研究[J]. 西北农业学报, 2016(3): 442-449. DOI:10.7606/j.issn.1004-1389.2016.03.017 |
| [15] |
郭成金, 赵润. 冬虫夏草原生质体制备与再生条件的研究[J]. 食品科学, 2009, 30(5): 166-170. |
| [16] |
弭宝彬, 张吉祥, 杨宇红, 等. 尖抱镰刀菌辣椒专化型原生质体制备条件优化[J]. 生物技术通报, 2013, 4(4): 96-100. |
| [17] |
Goswami RS. Targeted gene replacement in fungi using a split-marker approach[J]. Methods Mol Biol, 2012, 16: 255-269. |
| [18] |
李晶莹, 孙婷婷, 张国权, 等. 大型真菌原生质体的制备与再生研究[J]. 中国林副特产, 2015, 4(38): 98-101. |
| [19] |
伏建国, 强胜, 朱云枝. 链格孢菌原生质体的制备与限制性内切酶介导整合转化的致病性诱变[J]. 菌物学报, 2005, 24(3): 407-413. |
| [20] |
王淑珍, 高雁, 范俊, 等. 松茸原生质体制备与再生的研究[J]. 食用菌, 2002, 24(3): 6-8. |
| [21] |
王昱, 王义, 王康宇, 等. 灵芝原生质体制备与再生研究[J]. 北方园艺, 2013, 37(16): 184-188. |
| [22] |
祝子坪, 马海乐. 桑黄菌原生质体的分离与再生研究[J]. 中国中药, 2007, 32(21): 21-22. |
| [23] |
张卉, 刘长江. 姬松茸原生质体形成和再生的研究[J]. 微生物学报, 2003, 23(3): 18-20. |
| [24] |
梁清乐, 王秋颖, 曾念开, 等. 茯苓原生质体制备与再生条件初探[J]. 中草药, 2006, 37(5): 773-775. |
| [25] |
李伶俐, 严红, 李兴红, 等. 甘蓝枯萎病菌原生质体的制备与再生条件的优化[J]. 中国农学通报, 2011(10): 203-207. |
| [26] |
张婷, 李佳, 侯英敏, 等. 酶法制备黑曲霉原生质体的条件[J]. 大连工业大学学报, 2015, 34(4): 239-242. |
| [27] |
张丽霞, 郭成金. 猪苓原生质体制备与再生条件的研究[J]. 中国食用菌, 2008, 27(5): 35-37. |
| [28] |
陈孝仁, 王源超, 张正光, 等. 大豆疫霉菌原生质体制备及再生菌株的生物学性状[J]. 南京农业大学学报, 2005, 28(4): 45-49. |
| [29] |
姚婷婷, 王正祥. 黑曲霉原生质体的制备、再生及转化条件[J]. 食品与生物技术学报, 2006, 25(4): 116-120. |




