棉铃虫(Helicoverpa armigera)是农作物的重要害虫,因其寄主范围广、繁殖潜能大、种群能远距离迁移和对环境适应力强等特点,条件适宜时常大面积爆发成灾,造成棉花、玉米、花生、豆类、蔬菜、花卉等的严重损失,其中以棉花遭受的损失最大,例如1992年在我国棉区的棉铃虫大爆发[1]。随后,在我国出现了大量的关于棉铃虫杀虫剂的研究[2-3]。其中,以辛硫磷为代表的有机磷农药与以灭多威为代表的氨基甲酸酯类杀虫剂被广泛应用。
乙酰胆碱酯酶(Acetylcholinestrase,AchE,EC3.1.1.7)能快速水解神经递质乙酰胆碱(Acetylcholine,Ach)生成胆碱及乙酸,终止神经递质乙酰胆碱对突触后膜的兴奋作用,保证神经信号在生物体内的正常传递[4]。AchE上有有机磷与氨基甲酸酯类化合物的作用位点,这两类化合物与AchE结合后,会造成酶催化部位的磷酰化与氨基甲酰化,破坏了正常的神经传导作用,生物长期处于神经兴奋状态,最终死亡[5]。
棉铃虫的AchE由ace1和ace2两种基因编码,ace1是AchE的主要编码基因[6]。大量研究表明,昆虫的抗药性便与ace基因的过量表达有着密切关系[7-9],且ace基因在农药压力的选择下发生着进化[10]。其中,Fournier等[11]研究表明,果蝇种类的抗药性与ace过量表达有关,而在有机磷农药和氨基甲酸酯类杀虫剂诱导的棉铃虫中,ace1与ace2所发挥的作用尚未见报道。
RNA干扰(RNA interference,RNAi)是指dsRNA进入细胞后使内源的mRNA发生特异性的降解,从而引起靶基因的沉默,使得其相应的功能及表型缺失。自从1998年首次在秀丽隐杆线虫中发现注射dsRNA能够引起基因沉默以来,dsRNA引起的RNA干扰广泛应用于昆虫学研究中[12]。2013年,Xiong等[13]喂食表达HaHR3 dsRNA的菌液或者转基因叶片后,虫子体内HaHR3 mRNA和蛋白水平急剧下降,从而导致发育畸形及幼虫致死。喂食dsRNA可以引起昆虫RNAi,为深入阐明昆虫抗药性机理和害虫防控提供了新思路。
为此,本实验采用实时定量PCR方法检测辛硫磷、灭多威诱导和饲喂表达dsRNA的菌液后,棉铃虫幼虫中ace1和ace2转录水平的变化,旨为进一步研究有机磷农药、氨基甲酸酯类杀虫剂在基因分子水平上对棉铃虫的AchE的作用机制和以AchE为靶标基因的RNAi效应提供参考。
1 材料与方法 1.1 材料 1.1.1 供试昆虫棉铃虫卵购买自河南科云生物公司,人工气候箱进行孵化,其幼虫为有机磷和氨基甲酸酯类杀虫剂的敏感品系,孵化的幼虫采用人工饲料(本实验提供)饲养,温度28±2℃,相对湿度65±5%,光周期16 L:8 D。成虫用10%蜂蜜水饲养。
1.1.2 主要试剂辛硫磷购自Sigma公司;灭多威购自Aladdin公司;PrimeScriptTM RT reagent Kit with gDNA Eraser购自宝生物工程(大连)有限公司;TRIzon Reagent购自北京康为世纪生物科技有限公司;荧光PCR试剂FastStart Universal SYBR Green Master购自Roche公司;IPTG从自宝生物工程(大连)有限公司购买;引物由苏州金唯智生物科技有限公司合成。
本实验dsRNA的细菌表达采用L4440/HT115系统[14]。宿主菌HT115(DE3溶原菌)RNase Ⅲ缺陷,可在IPTG诱导下,高效表达克隆于含两个噬菌体T7启动子的质粒上(L4440)的基因的dsRNA[14]。本实验所用L4440已经过改造,使用Xcm Ⅰ酶切后,3'端各突出一个“T”碱基,因此可方便地通过TA克隆技术将棉铃虫ace1(GenBank检索号DQ001323,取1 109 bp的片段)和ace2基因序列(GenBank检索号AF369793,取500 bp的片段)各一个片段分别构建成dsRNA表达载体。
1.2 方法 1.2.1 实验处理杀虫剂实验组处理:供试棉铃虫饲养至4龄1 d时,取180条幼虫分为3组,在灭多威处理组,每头幼虫点滴灭多威药液0.1×7 µL(实验组一),在辛硫磷处理组,每头幼虫点滴辛硫磷药液0.3×10 µL(实验组二),处理后的棉铃虫单独放入玻璃管中,用人工饲料喂养,用清水作为对照组,之后移入培养箱中,分别在12 h、24 h、30 h、48 h、60 h取样。重复3次。
RNAi实验组处理:将含有双链RNA表达载体的HT115菌,在含有100 μg/mL Amp LB培养基中以37℃的温度和220 r/min的转速进行12 h的震荡培养。得到的菌液按照1:100的体积比接种到液体LB培养基中。当OD600 = 0.6时,加入IPTG至终浓度为0.45 mmol/L,37℃过夜培养。取新鲜发酵液,经4℃,4 000 r/min,离心15 min后弃上清液,加入新的LB制成10倍细菌浓缩液。将新鲜的饲料与100 μL浓缩细菌液搅拌均匀后备用。取180只二龄的棉铃虫,分为A、B、C三组,A组饲喂含有空菌的饲料,B组饲喂含有能够表达ace1基因dsRNA菌液的饲料,C组饲喂能够表达ace2基因dsRNA菌液的饲料。所有棉铃虫都放置在人工气候箱内给予相同的生长环境。在饲喂的过程中每24 h更换加入菌液的饲料,取样并拍照观察幼虫生长发育状况。本实验设3个生物学重复。
1.2.2 棉铃虫总RNA的提取及cDNA的制备按照TRIzon Reagent试剂盒说明书方法,分别提取试验组和对照组不同时间点幼虫的总RNA,用紫外分光光度计测定其纯度和浓度。用PrimeScriptTM RT reagent Kit with gDNA Eraser反转录试剂盒将提取的不同样不同时间点的RNA分别反转录成cDNA,备用。
1.2.3 实时荧光定量PCR分析采用Beacon Designer 8软件,按照Real-time PCR要求设计ribosomal protein S3a(RPS3A)内参基因和ace1、ace2基因的引物(表 1)。以合成的cDNA为模板,采用LigtCycler®PCR QC Kit试剂盒对各基因进行实时荧光定量PCR,具体步骤按照试剂盒说明书进行,反应体系为20 μL。反应程序为:95℃预变性3 min,95℃变性12 s,60℃退火40 s,72℃延伸12 s,40个循环。每个样品重复3次。
用LightCycler® 96荧光PCR仪(Roche)所带的LightCycler® 96 SW 1.1软件中读取数据,使用2-△△Ct的方法[15]分析数据,使用SPSS 19.0软件处理数据,采用GraphPad Prism 5软件制作图表。
2 结果 2.1 杀虫剂处理后棉铃虫ace基因表达规律采用RT-qPCR对杀虫剂处理后的乙酰胆碱酯酶基因在不同时间点的表达量进行检测。
结果(图 1)显示:灭多威处理后ace1基因表达量在12 h、24 h、48 h、60 h为显著下调。辛硫磷处理后ace1基因表达量在12 h、24 h、48 h显著下调,在60 h上调。从整体趋势上分析,灭多威处理后ace1基因表达量的变化是下调,辛硫磷处理后棉铃虫ace1基因表达量的变化是先下调后上调。
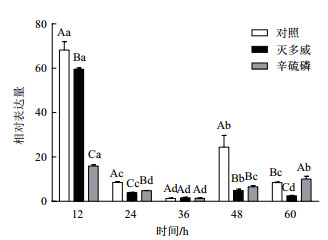
|
| 图 1 杀虫剂处理后棉铃虫ace1基因表达规律 大写字母表示相同时间点的不同处理之间的显著性比较,小写字母为相同处理的不同时间点的显著性比较,下同 |
灭多威处理后ace2基因表达量在12 h显著下调,在24 h、36 h、60 h显著上调。辛硫磷处理后ace2基因表达量在12 h、24 h显著下调,在48 h、60 h显著上调。从整体趋势上分析,灭多威处理后棉铃虫ace2基因表达量的变化是先下调后上调,辛硫磷处理后ace2基因表达量的变化是先下调后上调(图 2)。
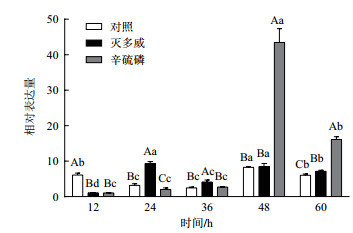
|
| 图 2 杀虫剂处理后棉铃虫ace2基因表达规律 |
取四龄的棉铃虫分为3组,A组为清水对照组,B组为灭多威处理组,C组为辛硫磷处理组。在杀虫剂处理后12 h、24 h和36 h皆出现棉铃虫严重蜷缩的现象。同时与A组相比,B组和C组化蛹更早,但从蛹到蛾的时间更长,羽化的失败率更高,且出现多种形态的畸形(图 3)。

|
| 图 3 杀虫剂处理前后棉铃虫表型变化 A:组为清水对照组;B:组为灭多威处理组;C:组为辛硫磷处理组 |
对棉铃虫喂食表达ace1基因dsRNA的细菌液后,棉铃虫ace1基因表达量在24 h、48 h下调明显,在72 h、96 h有不明显上调(图 4)。对棉铃虫喂食表达ace2基因dsRNA的细菌液后,棉铃虫ace2基因表达量在24 h、48 h下调明显,在72 h出现上调,在96 h下调(图 5)。从整体趋势上分析,在对棉铃虫进行ace基因dsRNA处理后,ace基因表达量变化下调。
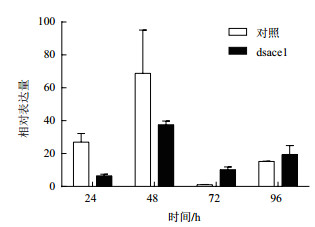
|
| 图 4 饲喂表达ace1基因dsRNA细菌液后,棉铃虫ace1基因的表达规律 |
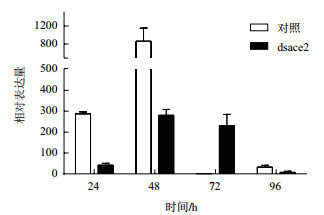
|
| 图 5 饲喂表达ace2基因dsRNA细菌液后,棉铃虫ace2基因的表达规律 |
A组喂食空菌,B组喂食表达ace1基因dsRNA细菌液,C组喂食表达ace2基因dsRNA细菌液。喂食第2天后发现(图 6),与A组比较,B组和C组的棉铃虫在死亡的同时其成长也出现滞后现象。喂食第4天后发现,A组的棉铃虫大小与体重差别细微,而B组和C组的棉铃虫在死亡的同时其大小和体重有了很大的差别。

|
| 图 6 饲喂表达ace基因dsRNA的细菌液后,棉铃虫的表型变化 A:组喂食空菌;B:组喂食表达ace1基因dsRNA细菌液;C:组喂食表达ace2基因dsRNA细菌液。背景纸每小格长1 cm、宽0.25 cm |
本研究结果显示,辛硫磷和灭多威进行诱导后,棉铃虫在12 h时,ace1和ace2皆显著下调,这可能是棉铃虫幼虫生理代谢水平被破坏导致的。辛硫磷诱导48 h时,ace1显著下调;ace2显著上调。灭多威诱导;24 h、48 h、60 h,ace1显著下调;24 h、36 h、60 h,ace2显著上调。总体来看,当农药处理满足一定的时间后,ace1表达量降低的时候ace2的表达量增加,推测棉铃虫的成活与ace2的过量表达有关。
大量研究结果表明,ace1是AchE的主要的编码基因[16-19],而在有些昆虫中ace2比ace1更丰富,AchE2是AchE的主要酶型[20-21]。经过辛硫磷与灭多威诱导后,从整体水平上分析,ace1基因表达量仍比ace2基因表达量多,从ace基因表达量的变化来说,与对照组相比,ace1基因表达量减少,ace2基因表达量增加。从上可推测,两种农药诱导棉铃虫后,AchE1仍是AchE的主要酶型,在AchE1的含量不足以支撑棉铃虫的正常生理活性后,AchE2的酶活力增加以满足棉铃虫的生理需求。
对棉铃虫进行ace基因dsRNA处理后,棉铃虫在死亡的同时也出现了不同程度的生长滞后现象。通过RT-qPCR技术发现ace基因表达量受到抑制,这说明ace基因可以作为研究RNAi技术防治棉铃虫的靶基因。但是ace1基因和ace2基因在后面的时间点里出现了上调的现象,推测棉铃虫被喂食表达dsRNA菌液的饲料后,体内mRNA被降解,棉铃虫在生长过程中为适应环境,其体内的ace基因过量表达来弥补被降解的mRNA。因此,在使用ace基因作为RNAi技术靶基因的时候,要慎重考虑棉铃虫的抗性问题。鉴于植物介导的昆虫RNAi已经成为害虫防治基因过程的一个重要思路[22-23],本研究可为在基因水平上研究有机磷农药、氨基甲酸酯类杀虫剂对棉铃虫的ace基因的作用机制、以及以ace基因为靶标的抗虫研究提供参考。
4 结论通过辛硫磷、灭多威诱导、dsRNA表达菌处理棉铃虫幼虫,可以造成ace1和ace2转录水平发生显著变化。用灭多威、辛硫磷处理后,ace1和ace2表达水平先出现显著下调,其后,ace1继续下调而ace2上调;通过饲喂dsRNA表达菌进行RNAi处理,可使棉铃虫ace1、ace2基因表达量明显下调(24 h、48 h),从而抑制靶标基因表达。
| [1] |
王武刚, 梁革梅, 郭予元. 棉铃虫特大发生及综合治理对策探讨[J]. 中国植保导刊, 1993, 1(4): 14-16. |
| [2] |
高明, 邓兆荣, 孟庆伟, 等. 11种杀虫剂对棉铃虫室内毒力测定[J]. 农药研究与应用, 2011, 15(3): 17-20. |
| [3] |
杨涛, 任福成, 夏成明, 等. 不同药剂对棉铃虫防治效果试验[J]. 棉花科学, 2009, 31(5): 34-36. |
| [4] |
Fournier D, Mutero A. Modification of acetylcholinesterase as a mechanism of resistance to insecticides[J]. Comparative Biochemistry and Physiology Part C:Pharmacology, Toxicology and Endocrinology, 1994, 108(1): 19-31. DOI:10.1016/1367-8280(94)90084-1 |
| [5] |
Matsumura F. Toxicology of Insecticides[M]. Second edition. New York: Plenum Press, 1985.
|
| [6] |
Lee DW, Kim SS, Shin SW, et al. Molecular characterization of two acetylcholinesterase genes from the oriental tobacco budworm, Helicoverpa assulta(Guenée)[J]. Biochimica Et Biophysica Acta General Subjects, 2006, 1760(2): 125-133. DOI:10.1016/j.bbagen.2005.10.009 |
| [7] |
Gao JR, Zhu KY. Increased expression of an acetylcholinesterase gene may confer organophosphate resistance in the greenbug, Schizaphis graminum(Homoptera:Aphididae)[J]. Pesticide Biochemistry & Physiology, 2002, 73(3): 164-173. |
| [8] |
Li F, Han Z. Mutations in acetylcholinesterase associated with insecticide resistance in the cotton aphid, Aphis gossypii Glover[J]. Insect Biochemistry & Molecular Biology, 2004, 34(4): 397-405. |
| [9] |
Labbé P, Berthomieu A, Berticat C, et al. Independent duplications of the acetylcholinesterase gene conferring insecticide resistance in the mosquito Culex pipiens[J]. Molecular Biology & Evolution, 2007, 24(4): 1056-1067. |
| [10] |
Lee DW, Choi JY, Kim WT, et al. Mutations of acetylcholinestera-se1 contribute to prothiofos-resistance in Plutella xylostella(L.)[J]. Biochem Biophys Res Commun, 2007, 353(3): 591-597. DOI:10.1016/j.bbrc.2006.12.088 |
| [11] |
Fournier D, Bride JM, Hoffmann F, et al. Acetylcholinesterase. Two types of modifications confer resistance to insecticide[J]. J Biol Chem, 1992, 267(20): 14270-14274. |
| [12] |
Timmons L, Fire A. Specific interference by ingested dsRNA[J]. Nature, 1998, 395(6705): 854. DOI:10.1038/27579 |
| [13] |
Xiong Y, Zeng H, Zhang Y, et al. Silencing the HaHR3 gene by transgenic plant-mediated RNAi to disrupt Helicoverpa armigera development[J]. Int J Biol Sci, 2013, 9(4): 370-381. DOI:10.7150/ijbs.5929 |
| [14] |
Tian H, Peng H, Yao Q, et al. Developmental control of a lepidopteran pest Spodoptera exigua by ingestion of bacteria expressing dsRNA of a non-midgut gene[J]. PLoS One, 2009, 4(7): e6225. DOI:10.1371/journal.pone.0006225 |
| [15] |
Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative C(T)method[J]. Nature Protocols, 2008, 3(6): 1101-1108. DOI:10.1038/nprot.2008.73 |
| [16] |
Alout H, Berthomieu A, Hadjivassilis A, et al. A new amino-acid substitution in acetylcholinesterase 1 confers insecticide resistance to Culex pipiens mosquitoes from Cyprus[J]. Insect Biochemistry & Molecular Biology, 2007, 37(1): 41-47. |
| [17] |
Malcolm CA, Bourguet D, Ascolillo A, et al. A sex-linked Ace gene, not linked to insensitive acetylcholinesterase-mediated insecticide resistance in Culex pipiens[J]. Insect Molecular Biology, 2010, 7(2): 107-120. |
| [18] |
Nabeshima T, Kozaki T, Tomita T, et al. An amino acid substitution on the second acetylcholinesterase in the pirimicarb-resistant strains of the peach potato aphid, Myzus persicae[J]. Biochemical & Biophysical Research Communications, 2003, 307(1): 15-22. |
| [19] |
Toda S, Komazaki S, Tomita T, et al. Two amino acid substitutions in acetylcholinesterase associated with pirimicarb and organophosp-horous insecticide resistance in the cotton aphid, Aphis gossypii Glover(Homoptera:Aphididae)[J]. Insect Molecular Biology, 2010, 13(5): 549-553. |
| [20] |
Shang JY, Shao YM, Lang GJ, et al. Expression of two types of acetylcholinesterase gene from the silkworm, Bombyx mori, in insect cells[J]. Insect Science, 2007, 14(6): 443-449. DOI:10.1111/j.1744-7917.2007.00172.x |
| [21] |
Chen HJ, Liao Z, Hui XM, et al. Ace2, rather than ace1, is the major acetylcholinesterase in the silkworm, Bombyx mori[J]. Insect Science, 2009, 16(4): 297-303. DOI:10.1111/ins.2009.16.issue-4 |
| [22] |
Lim ZX, Robinson KE, Jain RG, et al. Diet-delivered RNAi in Helicoverpa armigera - progresses and challenges[J]. Insect Science Physiology, 2016, 85: 86-93. DOI:10.1016/j.jinsphys.2015.11.005 |
| [23] |
Bally J, Mclntyre GJ, Doran RL, et al. In-plant protection against Helicoverpa armigera by production of long hpRNA in chloroplasts[J]. Front Plant Sci, 2016, 7: 1453. |





