类肌钙蛋白(Calponin,Cal),又称钙调宁蛋白。该蛋白于1994年被Applegate等[1]首次从鸡砂囊平滑肌组织中提取并纯化出来。随后发现其在多种生物体中存在,并在生物体的多个组织中表达,如人的血管、胃、膀胱、输尿管、输精管和子宫等组织平滑肌中都提取并纯化出了相关Calponin蛋白[2]。哺乳动物和鸟类体内的Calponin有3种亚型,根据等电点和同源染色体的不同分为:碱性Calponin(H1-Calponin,PI 8-10),中性Calponin(H2-Calponin,PI 7-8)和酸性Calponin(H3-Calponin,PI 5-6)[3]。在哺乳动物体内,这3个亚型的1-273位氨基酸有高度的保守性(> 70%),氨基端都包含单个CH结构域,此结构域参与肌动蛋白结合[4]。羧基端有3个串联重复,但是酸性Calponin的羧基端序列与其他两者较为不同[3-6]。
Calponin是一种多功能的调节蛋白,它调节30多种酶的活性[7]。在平滑肌细胞中Calponin特异性的表达,其与肌动蛋白/原肌球蛋白细丝结合并抑制肌球蛋白Mg2+-ATPase活性[8-9]。Calponin既通过调节肌动蛋白之间的相互作用来调节肌肉组织收缩功能,又可以调控细胞内激酶或钙信号的收缩调节[10-12]。Calponin被磷酸化能可逆地阻断其与Ca2+ /钙调蛋白的相互作用。Calponin也在其他非肌肉细胞中被发现,如在神经元和星形胶质细胞中有相关报道[13]。该蛋白在非肌肉细胞中调节细胞骨架的生长并增强细胞骨架的稳定性[13-14],从而参与细胞的分裂、运动[15]及免疫调控[16]等过程。
Kozłowska等[17-18]克隆表达了果蝇和赤拟谷盗的Calponin家族基因DmChd64和TcChd64,并对这两个蛋白的空间结构进行了研究,且有研究证明Chd64与FK506结合蛋白(FKBP39)有相互作用[17]。HaCal可能参与了棉铃虫的变态过程,结果显示HaCal在棉铃虫蛹中上调表达,而20-羟基蜕皮激素提高了该基因的表达[19]。棉铃虫蜕皮过程中有30种差异表达的蛋白质,包括酶类,调节剂,蛋白质水解酶和受体蛋白[20]。HaCal与蜜蜂Chd64和果蝇Chd64分别有70%和67%的同源性[21],因此HaCal可能与某些差异表达的蛋白存在相互作用。因对HaCal的结构特征了解不完全,以及缺少相应的抗体,阻碍了人们对HaCal在棉铃虫蜕皮和蛹变等发育过程中的功能认识。
本课题组通过酵母单杂交技术筛选棉铃虫CYP6B6基因响应2-十三烷酮诱导的调控因子,从中捕获到HaCal,且前期已克隆分析了HaCal基因,并在核酸水平上检测了该基因在棉铃虫不同发育时期和不同组织中的含量,说明HaCal在棉铃虫的不同发育时期和应对2-十三烷酮中均发挥作用。因此本实验通过纯化获得高浓度融合蛋白His-HaCal,继而用蛋白免疫法制备了高滴度的棉铃虫HaCal多克隆抗体,并验证了该抗体能与棉铃虫体内的HaCal特异性结合,这为后期进行HaCal功能的研究,以及与其他蛋白互作的鉴定提供重要的检测工具。
1 材料与方法 1.1 材料棉铃虫和黄粉虫由本实验室饲养,室内饲养条件为:温度25℃,相对湿度为75%,光周期为16 L﹕8 D。昆明白鼠从新疆医科大学医院购买。蛋白Marker和BCA试剂盒购自Thermo Fisher Scientific公司。小鼠抗His-tag的多克隆抗体、辣根过氧化物酶标记的山羊抗小鼠IgG抗体和DAB显色试剂盒购自中杉金桥公司(北京)。ELISA板由广州洁特生物过滤制品有限公司提供,其余所用的化学试剂均为国产分析纯。
1.2 方法 1.2.1 HaCal蛋白的诱导表达和纯化融合蛋白His-HaCal的大量表达及纯化按照本课题组前期的方法进行,并使用Ni-NTA柱纯化融合蛋白,对目标蛋白的纯化采用不同浓度咪唑(0.02 mol/L,2次、0.04、0.1、0.2及0.5 mol/L)进行洗脱,分别收集流出的洗脱液并经SDS-PAGE电泳检测,用BCA蛋白浓度定量试剂盒进行蛋白定量。
1.2.2 多克隆抗体的制备纯化后的His-HaCal融合蛋白免疫小白鼠,用此法制备鼠抗His-HaCal的多克隆抗体。第一次免疫前用眼眶采血法收集小白鼠血液,将其37℃放置30 min,4℃放置1 h,5 000 r/min离心10 min收集上层清液,将血清放于-80℃保存,作阴性对照。免疫时,每只小鼠用50 μg纯化的融合蛋白与等体积的弗氏完全佐剂充分混匀并乳化,足垫和皮下两部位注射免疫小鼠。两周一次加强免疫,共4次免疫。除第一次免疫用弗氏完全佐剂以外,其余3次均用弗氏不完全佐剂。免疫4次后收集血清将其放于-80℃保存备用。
1.2.3 ELISA法检测鼠抗His-HaCal抗血清效价抗体滴度的检测用间接酶联免疫吸附测定法(间接ELISA)。His-HaCal抗原经包被液稀释,抗原终浓度10 μg/mL,每孔加入200 μL该包被液包被ELISA板,4℃过夜包被后弃去包被液;用PBST洗涤3次,每孔加入200 μL封闭液(5%脱脂奶粉的PBST),37℃封闭2 h;弃去封闭液后加入100 μL按比例稀释的抗血清(血清:封闭液),37℃孵育1 h;用PBST洗涤3次,每孔加入100 μL的二抗稀释液(羊抗鼠IgG:封闭液为1:3 000);PBST洗涤3次,加入100 μL/孔的TMB显色液,37℃显色10 min,最后加入50 μL的H2SO4(2 mol/L)终止反应。读取在450 nm处的OD值。
1.2.4 多克隆抗体的特异性分析采用TCA/丙酮沉淀法提取棉铃虫和黄粉虫总蛋白,具体步骤参考Li等[22]的方法。将His-HaCal、棉铃虫和黄粉虫总蛋白,SDS-PAGE电泳分离后电转移至PVDF膜上。用封闭液(5%脱脂奶粉的PBST)37℃封闭1 h,弃封闭液,加入1:1 000稀释的His-HaCal多克隆抗体37℃孵育1.5 h再用PBST溶液洗膜3次。1:3 000稀释的二抗(山羊抗鼠IgG抗体),在37℃孵育1.5 h,PBST洗3次后加入DAB底物显色液避光显色10 min,显现清晰条带后加去离子水终止反应并拍照。
免疫组化昆虫为2龄棉铃虫,固定、脱水、透明、浸蜡、包埋、切片、脱蜡和抗原的修复等步骤参考Zhao等[23]的方法,随后用含有5%脱脂奶粉的PBS进行抗原封闭,37℃孵育2 h;洗去封闭液后滴加一抗(血清:封闭液=1:1 500),4℃过夜孵育,37℃保温30 min;甩去一抗,用PBS洗涤3次,滴加二抗(山羊抗鼠IgG:封闭液=1:2 000),37℃孵育2 h;弃去二抗,用PBS洗涤3次,将组织切片上滴加DAB显色剂,显色3 min,蒸馏水冲洗DAB显色液;随后进行梯度脱水和封片;最后用Nikon NIS-Elements D显微镜进行观察和拍照。
2 结果 2.1 His-HaCal融合蛋白的表达纯化先用镍柱吸附原核表达的融合蛋白His-HaCal,再用不同浓度的咪唑梯度洗脱,所得的洗脱样经15%的SDS-PAGE电泳检测(图 1)显示His-HaCal在0.02、0.04、0.1、0.2和0.5 mol/ L咪唑浓度的洗脱液都能洗下来,其中0.5 mol/ L咪唑浓度的洗脱液能洗脱比较单一的融合蛋白His-HaCal,可以用于后期的免疫小鼠制备抗体。
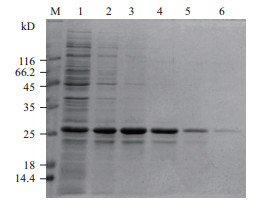
|
| 图 1 融合蛋白在不同浓度的咪唑洗脱液纯化洗脱 M:蛋白marker;1-6:0.02、0.02、0.04、0.1、0.2和0.5 mol/ L咪唑浓度的洗脱液洗脱的蛋白条带 |
Western blot鉴定原核表达的融合蛋白His-HaCal,结果(图 2)表明杂交出的条带大小与预计大小23.9 kD相符合,说明融合蛋白表达正确。
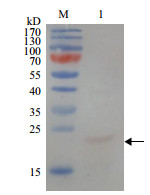
|
| 图 2 纯化后的融合蛋白His-HaCal Western blot鉴定 M:蛋白Marker;1:经NI-NTA纯化的His-HaCal蛋白 |
用His-HaCal融合蛋白4次免疫小白鼠后,ELISA方法测定抗血清效价。从图 3可以看出当血清稀释819 200倍时,样品在450 nm的光吸收值大于阴性对照数值的2.1倍,即抗血清效价均大于819 200,甚至部分样品(2号老鼠)抗血清效价达到163 8400,说明已达到预期的实验要求。
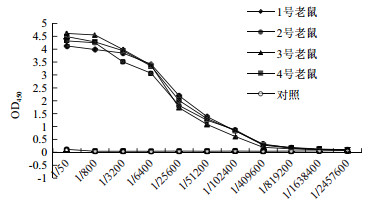
|
| 图 3 ELISA测定His-HaCal多克隆抗体效价 |
用已制备好的抗His-HaCal多克隆抗体检测棉铃虫和黄粉虫的总蛋白,Western blot结果(图 4-A)显示所制备的多克隆抗体与棉铃虫天然HaCal蛋白特异性结合,条带大小(20.52 kD)正确,而与黄粉虫的总蛋白无杂交条带。用免疫后的小鼠血清对棉铃虫中肠组织进行免疫组化分析(图 4-B),表明该血清能和棉铃虫中肠组织天然的HaCal特异性结合,说明制备的His-HaCal多克隆抗体具有较好的免疫特异性,可以用于后续的研究。
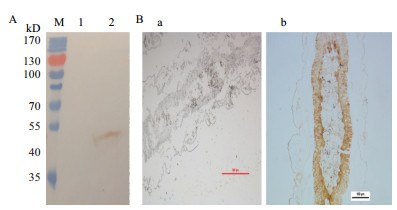
|
| 图 4 抗HaCal多克隆抗体的免疫特异性检测 A:M:蛋白Marker;1:黄粉虫总蛋白;2:棉铃虫总蛋白;B:免疫组化结果;a:免疫前血清;b:免疫后血清 |
类肌钙蛋白(Calponin)是一种肌动蛋白结合蛋白,有抑制肌动球蛋白Mg2+ATPase的活性[8-9]。目前Calponin功能的研究主要涉及协调平滑肌的收缩、细胞增殖及细胞信号传导等。Calponin在细胞信号传导的过程中,与受体蛋白结合从而将蛋白激酶C(Protein kinase C,PKC)和丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)定位于细胞膜上,又能结合PKC的调控域从而调节PKC的活性。Calponin也能影响该途径下游基因的转录激活和表达,因而改变细胞增殖[24]。
研究表明Calponin特异性抗体可以作为肿瘤检测和蛋白检测的有效工具。Calponin在人类平滑肌组织中的研究较多,可用于临床诊断[25]。Lee等[26]用免疫组化方法证实Calponin也存在于肾肌成纤维细胞中,PECs(壁层上皮细胞)细胞与含有Calponin的成肌细胞之间的相互作用能在肾小球硬化晚期诊断中起着关键作用。Calponin2单克隆抗体可用于乳腺癌的早期诊断,此外,Calponin2还有助于判定肿瘤是否为恶性[27]。Meyer-Rochow等[28]用特异性识别戈尔迪乌斯线虫Calponin和Troponin(肌钙蛋白)的两种抗体来对线虫体壁肌肉进行免疫组化检测,证实此肌肉具有平滑肌和横纹肌特征。此特征前期仅在秀丽线虫中和少数蜕皮昆虫中得到证实。
棉铃虫的生长和发育主要由保幼激素(Juvenile hormome,JH)和20-羟基蜕皮激素(20E)控制,JH调控幼虫状态的维持,20E调控幼虫的蜕皮和和蛹的变态,在幼虫阶段结束时,JH滴度下降至最低水平,20E滴度升高从而开始蛹的变态过程[29]。棉铃虫类肌钙蛋白(HaCal)属于Calponin家族蛋白,在棉铃虫的整个发育过程中均表达,且可能参与幼虫的蜕皮过程和蛹的变态过程。Liu等[30]研究发现,含有Chd结构域的HaCal蛋白在棉铃虫蜕皮和蛹变过程中上调表达,并被PKC磷酸化,且受20E和钾氨普烯的诱导表达量上升,20E诱导后蛋白被磷酸化,而钾氨普烯诱导后蛋白仍未被磷酸化。HaCal存在于细胞质中,激素诱导后可快速转移到细胞核中,非磷酸化的HaCal能与USP1(泛素特异性蛋白酶)相互作用,在20E的信号转导途径中作为中间调节剂起着关键作用。Burgstaller等[31]的研究表明Calponin的C末端可变区决定不同类型Calponin的细胞种类分布和同一类型Calponin的不同功能。Gimona等[32]从鸡的骨骼肌肉、肾脏、肝脏和脾脏等组织中提取总蛋白,用抗Calponin蛋白的抗体进行检测,结果显示未检测到Calponin蛋白,随后其他研究小组研究亦有相似结果。
为了得到高效价和高特异性的多克隆抗体,必须对抗原的准备、实验动物的选择、免疫的方式和加强免疫的间隔等方面进行详细设计。本实验选用了蛋白免疫法,此方法比核酸免疫所得到的抗体效价高,但缺点是抗原持续发挥作用的时间比核酸免疫持续的时间短,因此每两周加强免疫一次[33]。本实验纯化出高纯度的His-HaCaL融合蛋白,满足了抗原免疫要求。选用6周龄且较温顺的雌性小鼠,注射时添加弗氏佐剂来改善免疫反应,因为它无免疫原性,且能增强抗原的免疫应答过程[34]。本实验采用足垫加腹部皮下多点注射的方法,因为足垫和腹部皮下的抗原递呈细胞较多,有利于对抗原的摄取和加工。前3次免疫用足垫免疫为主皮下免疫为辅,3次免疫后观察到小鼠足趾肿胀,第四次免疫时选择皮下免疫为主,足垫免疫辅,且每次总注入量不变。徐霞等(Xu)[35]采用此方法获得了效价较好的小鼠抗青霉素结合蛋白(PBP2a)的多克隆抗体,研究显示不同方法获得的抗体效价也不同,抗体效价高到低依次为足垫加皮下免疫、腹腔免疫和足垫免疫。本实验用纯化的HaCaL蛋白获得了滴度高于1:819 200的多克隆抗体,其中二号样本滴度高达1:163 8400,表明该抗体可满足后续实验要求。Western blot结果显示获得的抗体能与棉铃虫体内天然HaCaL蛋白结合且不能识别黄粉虫体内Calponin蛋白,表明该多克隆抗体的特异性较高。从蛋白水平上对棉铃虫类肌钙蛋白进行检测,相对于核酸水平上检测,蛋白质的功能较稳定,从蛋白水平来分析、鉴定更加直接、准确。随后通过免疫组化的方法进一步证明该蛋白存在于棉铃虫的中肠组织中且表达量较高。
4 结论本实验纯化获得了高浓度的融合蛋白His-HaCal,通过蛋白免疫法制备了高滴度和特异性较高的棉铃虫HaCal多克隆抗体,并验证了该抗体能与棉铃虫体内的HaCal特异性结合,这为后期进行HaCal功能的研究和与其他蛋白互作的鉴定提供重要的检测工具。
| [1] |
Applegate D, Feng W, Green RS, et al. Cloning and expression of a novel acidic calponin isoform from rat aortic vascular smooth muscle[J]. J Biol Chem, 1994, 269(14): 10683-10690. |
| [2] |
李颖. H2-calponin在胃癌中的表达及意义[D]. 西安: 第四军医大学, 2007, 15(12): 1800-1803.
|
| [3] |
Takahashi K, Nadal-Ginard B. Molecular cloning and sequence analysis of smooth muscle calponin[J]. J Biol Chem, 1991, 266(20): 13284-13288. |
| [4] |
Gimona M, Mital R. The single CH domain of calponin is neither sufficient nor necessary for F-actin binding[J]. Journal of Cell Science, 1998, 111(Pt 13): 1813-1821. |
| [5] |
Wriggers W, Mehler E, Pitici F, et al. Structure and dynamics of calmodulin in solution[J]. Biophysical Journal, 1998, 74(4): 1622-1639. DOI:10.1016/S0006-3495(98)77876-2 |
| [6] |
Strasser P, Gimona M, Moessler H, et al. Mammalian calponin[J]. Febs Letters, 1993, 330(1): 13-18. DOI:10.1016/0014-5793(93)80909-E |
| [7] |
Winder SJ, Walsh MP. Smooth muscle calponin. Inhibition of actomyosin MgATPase and regulation by phosphorylation[J]. J Biol Chem, 1990, 265(17): 10148-10155. |
| [8] |
Abe M, Takahashi K, Hiwada K. Effect of calponin on actin-activated myosin ATPase activity[J]. Journal of Biochemistry, 1990, 108(5): 835-838. DOI:10.1093/oxfordjournals.jbchem.a123289 |
| [9] |
Dobrzhanskaya AV, Vyatchin IG, Lazarev SS, et al. Molluscan smooth catch muscle contains calponin but not caldesmon[J]. J Muscle Res Cell Motil, 2013, 34(1): 23-33. DOI:10.1007/s10974-012-9329-2 |
| [10] |
Winder SJ, Walsh MP. Smooth muscle calponin[J]. Biochemical Society Transactions, 1989, 17(4): 786-787. DOI:10.1042/bst0170786 |
| [11] |
Carmichael JD, Winder SJ, Walsh MP, et al. Calponin and smooth muscle regulation[J]. Canadian Journal of Physiology & Pharmacology, 1994, 72(11): 1415-1419. |
| [12] |
Sirenko VV, Dobrzhanskaya AV, Shelud'Ko NS, et al. Calponin-like protein from mussel smooth muscle is a competitive inhibitor of actomyosin ATPase[J]. Biochemistry, 2016, 81(1): 28-33. |
| [13] |
Hossain MM, Crish JF, Eckert RL, et al. H2-calponin is regulated by mechanical tension and modifies the function of actin cytoskeleton[J]. J Biol Chem, 2005, 280(51): 42442-42453. DOI:10.1074/jbc.M509952200 |
| [14] |
Liu R, Jin JP. Calponin:A mechanical tension-modulated regulator of cytoskeleton and cell motility[J]. Current Topics in Biochemical Research, 2015, 16: 1-15. |
| [15] |
Ulmer B, Hagenlocher C, Schmalholz S, et al. Calponin 2 acts as an effector of noncanonical Wnt-mediated cell polarization during neural crest cell migration[J]. Cell Reports, 2013, 3(3): 615-621. DOI:10.1016/j.celrep.2013.02.015 |
| [16] |
Flemming A, Huang QQ, Jin JP, et al. A conditional knockout mouse model reveals that calponin-3 is dispensable for Early b cell development[J]. PLoS One, 2015, 10(6): e0128385. DOI:10.1371/journal.pone.0128385 |
| [17] |
Kozłowska M, Tarczewska A, Jakób M, et al. 2014. Calponin-like chd64 is partly disordered[J]. PLoS One, 2014, 9(5): 1-14. |
| [18] |
Tarczewska A, Kozłowska M, Dobryszycki P, et al. Insight into the unfolding properties of Chd64, a small, single domain protein with a globular core and disordered tails[J]. PLoS One, 2015, 10(9): e0137074. DOI:10.1371/journal.pone.0137074 |
| [19] |
Fu Q, Liu PC, Wang JX, et al. Proteomic identification of differentially expressed and phosphorylated proteins in epidermis involved in larval-pupal metamorphosis of Helicoverpa armigera[J]. BMC Genomics, 2009, 10(1): 600. DOI:10.1186/1471-2164-10-600 |
| [20] |
Zhao XF, He HJ, Dong DJ, et al. Identification of differentially expressed proteins during larval molting of Helicoverpa armigera[J]. Journal of Proteome Research, 2006, 5(1): 164-169. DOI:10.1021/pr0502424 |
| [21] |
Li Y, Zhang Z, Robinson GE, et al. Identification and characterization of a juvenile hormone response element and its binding proteins[J]. J Biol Chem, 2007, 282(52): 37605-37617. DOI:10.1074/jbc.M704595200 |
| [22] |
Li S, Xiong RY, Wang XF, et al. Five proteins of Laodelphax striatellus are potentially involved in the interactions between rice stripe virus and vector[J]. PLoS One, 2011, 6(10): e26585. DOI:10.1371/journal.pone.0026585 |
| [23] |
Zhao J, Liu N, Ma J, et al. Effect of silencing CYP6B6 of Helicoverpa armigera(Lepidoptera:Noctuidae)on its growth, development, and insecticide tolerance[J]. Journal of Economic Entomology, 2016, 109(6): 2506-2516. DOI:10.1093/jee/tow181 |
| [24] |
Yang JX, Li SY, Han GZ, et al. The special feature of calponin on myosins phosphorylated by MLCK and PKA respectively[J]. Journal of Biomedical Research, 2005, 19(3): 111-115. |
| [25] |
Lee H, Torres FX, Mclean SA, et al. Immunophenotypic heterogeneity of primary sinonasal melanoma with aberrant expression of neuroendocrine markers and calponin[J]. Applied Immunohistochemistry & Molecular Morphology, 2011, 19(1): 48-53. |
| [26] |
Lee SY, Choi JY, Jin DC, et al. Expression of calponin in periglomerular myofibroblasts of rat kidney with experimental chronic injuries[J]. Anatomy & Cell Biology, 2010, 43(2): 132-139. |
| [27] |
Debald M, Jin JP, Linke A, et al. Calponin-h2:a potential serum marker for the early detection of human breast cancer?[J]. Tumour Biology, 2014, 35(11): 11121-11127. DOI:10.1007/s13277-014-2419-6 |
| [28] |
Meyer-Rochow VB, Royuela M. Immunocytochemically determined regulatory proteins, troponin, calponin and caldesmon, may occur together in the musculature of a Gordian worm(Ecdysozoa, Cycloneuralia, Nematomorpha)[J]. Zoomorphology, 2017(1): 1-5. |
| [29] |
Riddiford LM, Hiruma K, Zhou X, et al. Insights into the molecular basis of the hormonal control of molting and metamorphosis from Manduca sexta and Drosophila melanogaster[J]. Insect Biochemistry & Molecular Biology, 2003, 33(12): 1327-1338. |
| [30] |
Liu PC, Wang JX, Song QS, et al. The participation of calponin in the cross talk between 20-Hydroxyecdysone and juvenile hormone signaling pathways by phosphorylation variation[J]. PLoS One, 2011, 6(6): 414-422. |
| [31] |
Burgstaller G, Kranewitter WJ, Gimona M. The molecular basis for the autoregulation of calponin by isoform-specific C-terminal tail sequences[J]. Journal of Cell Science, 2002, 115(Pt 10): 2021-2029. |
| [32] |
Gimona M, Herzog M, Vandekerckhove J, et al. Smooth muscle specific expression of calponin[J]. Febs Letters, 1990, 274(1): 159-162. |
| [33] |
李晓娟. 肝片吸虫重组GST、CatL蛋白及其DNA核酸联合免疫初步研究[D]. 大庆: 黑龙江八一农垦大学, 2009.
|
| [34] |
霍华德, 凯瑟, 张权庚. 抗体制备与使用实验指南[M]. 北京: 科学出版社, 2010.
|
| [35] |
XU Xia, Tang XH, Huang H, et al. A comparison of immunization protocols in preparing mouse poly-clonal antibody against PBP2a[J]. Journal of Tropical Medicine, 2007, 7(2): 145-147. |




