多倍化(Polyploidy)即生物体合子中拥有超过两套染色体的现象,广泛存在于自然界中,如鱼类[1]、甲壳类[2]以及两栖类[3]。植物中多倍化现象更是普遍存在。80%以上的被子植物在进化过程中存在多倍性[4]。以多倍体形式存在的物种有更丰富的基因型与表型多态性,进而提高对环境的适应性与群体遗传多态性[5]。此外,多倍化也是产生与保持杂种优势的重要途径之一[6]。根据多倍体中染色体组的遗传来源,可将多倍体分为同源多倍体(Autopolyploid)与异源多倍体(Allopolyploid)[7]。
多倍化会对细胞减数分裂产生深刻的影响[8]。在多倍体减数分裂过程中,既有可能染色体之间两两交叉形成二价体,染色体行为类似于二倍体,这种模式被称为二体遗传;也有可能超过两条同源染色体或近源染色体之间交叉形成多价体,这种模式被称为多体遗传,这导致多倍体遗传要比二倍体遗传复杂很多[9]。目前对于多倍体遗传的研究都是建立在群体数据的基础上。即利用两套背景不同、具有多态性标签位点的染色体构建杂合同源或异源多倍体亲本,然后对其后代回交或自交群体采集一定大小的样本,进行多态性位点的检测并绘制图谱,统计分析[10]。实际上,群体数据的分析是极其依赖模型的,依据的模型不同所得结果常有较大差异[11, 12]。但目前多是利用理论分析与计算机模拟的方法建模,而没有一个由准确实验数据支持的模型。因此我们希望利用四分子分析,这一能够精准分析单次减数分裂的方法[13],将多倍体遗传重组的研究从群体水平精确到个体水平,构建有实验数据支持的多倍体遗传重组模型。20世纪90年代以来,在拟南芥(Arabidopsis thaliana)中陆续发现的3个基因[14, 15],这3个基因任意一个的纯合失活突变都能使花粉母细胞单次减数分裂发育而来的4个花粉互不分离,并由此将这3个基因命名为QUARTET(QRT1、QRT2以及QRT3),是应用四分子分析的极好材料。因此本研究从带有qrt1突变的二倍体拟南芥Columbia及Landsberg erecta生态型出发,诱导并筛选染色体组成功加倍的四倍体qrt1突变株,并测定它们与二倍体及四倍体参照的表型差异,能为在多倍体遗传重组中应用四分子分析奠定基础。
1 材料与方法 1.1 材料野生型Columbia生态型二倍体Col-0及其四倍体CS3151、野生型Landsberg erecta生态型二倍体Ler及其四倍体CS3900均为实验室保存。二倍体Columbia QRT1 -/-突变体、二倍体Landsberg erecta QRT1 -/-突变体以及特异性识别拟南芥(Arabidopsis thaliana)着丝粒位置180 bp重复序列的荧光原位杂交探针获赠于陆平利研究员(复旦大学生命科学院植物科学研究所)。
1.2 方法 1.2.1 拟南芥的诱导与传代用0.08%浓度的秋水仙素溶液处理10 d龄的QRT1 -/-二倍体Columbia与Landsberg erecta幼苗(G0)5 h。培养G0幼苗,收集G0的种子。将这批种子种下,从这批苗(G1)中鉴定与筛选成功加倍的植株,收集这些植株的种子,传代,并于后代中再次验证倍性。
1.2.2 流式细胞技术取50 mg左右植株幼嫩莲座叶片,参照文献[16]处理。不同的是,这里叶片材料经过破碎之后经过30 μm孔径尼龙膜过滤,并用100 μg/mL的碘化丙啶(PI)染色30 min左右。所用仪器为FACSCalibur流式细胞仪(BD Biosciences),分析软件为CellQuestPro。所用荧光染料为PI,选择荧光检测通道为FL2,同时对FL-2的值取对数,使等比DNA含量的峰在图上显示为等间距的峰。
1.2.3 荧光原位杂交技术取卡诺氏液固定好的幼嫩花序,按照前人方式[17]处理,观察其中花粉母细胞的减数分裂。DNA染料为4,6-二脒基-2-苯基吲哚(DAPI),同时利用特异性识别拟南芥着丝粒位置180 bp重复序列的荧光原位杂交探针标识着丝粒的位置,进行染色体计数。荧光探针生色基团为Cy3,识别序列以及制作过程参照文献进行[18]。
2 结果 2.1 四倍体的诱导与流式细胞仪检测倍性结果本研究中,为确定细胞倍性,利用流式细胞技术,以二倍体野生型Col与Ler(图 1-A,1-B)、四倍体野生型Col与Ler(图 1-G,1-H)为对照,从Columbia背景筛选出并编号为C313的植株(图 1-C),从Ler背景筛选出并编号为L311的植株(图 1-D)。自交传代,并在G3中再次用流式细胞技术验证C313与L311的倍性(图 1-E,1-F)。

|
| 图 1 流式细胞技术检测细胞倍性 A:Col-0 2n;B:Ler 2n;C:G1-C313;D:G1-L311;E:G3-C313;F:G3-L311;G:Col-0 4n;H:Ler4n(纵坐标代表细胞个数,横坐标为荧光强度(FL-2)取对数。峰的位置代表峰的倍性。在二倍体对照中,从左至右峰的倍性分别为2n、4n、8n等,二倍体会比四倍体多出最左边一道2n的峰) |
本研究中的流式结果,显示了拟南芥中广泛存在的内复制现象[19],即核基因组复制而细胞不分裂的现象。这导致拟南芥叶片实际为多种倍性细胞共存的嵌合体,故其流式结果中有多个峰。而由于荧光强度取了对数,故等比的峰表现为等间距的峰。而二倍体与四倍体的区别就在于,二倍体有2n的峰(图 1-A,1-B),而四倍体没有(图 1-G,1-H)。经过G1与G3的重复验证,流式结果验证C313与L311核基因组加倍成功。另外,有文章[20]报道拟南芥的内复制速率随着倍性的提高而提高,在本研究中,也基本反映了这一现象(图 1-C,1-E,1-F,1-G,1-H),在这几张图中,4n的峰相比于二倍体中2n的峰(图 1-A,1-B)要更低,而内复制之后的峰相对的更高,表现出更高的内复制速率。
2.2 荧光原位杂交技术鉴定倍性结果在利用流式初步在G1群体中筛选出C313与L311植株后,于花期观察花粉母细胞减数分裂(图 2-d-i)。在细线期,细胞已完成DNA复制,染色体开始凝聚。此时姐妹染色单体通过着丝粒相连,尚未分开。而同源染色体尚未配对。因此染色质弥散于核内,每一个着丝粒都代表一条染色体,代表其上的一对姐妹染色单体。可见C313与L311中皆能数到20个点,而二倍体对照(图 2-a-c)只能数到10个点,验证了倍性。并继续传代,至G3时,再次观察花粉母细胞减数分裂(图 2-j-p),验证了C313与L311染色体加倍成功。

|
| 图 2 荧光原位杂交技术检测细胞倍性 图中细胞皆为减数分裂细线期的细胞,染色质用DAPI染为蓝色,着丝粒被探针标记为红色小点。红点个数代表染色体个数,拟南芥(Arabidopsis thaliana)二倍体在细线期有10个点,四倍体有20个点。细胞背景标记在左侧。Bars=5 μm |
利用垂直平板培养记录种子萌发期根的生长,包括纵向深度(主根长度)和横向广度(测根数目)。结果发现在Col与Ler背景中,多倍化都不对主根的生长造成影响,而qrt1突变在Ler中对主根生长有抑制作用(图 3-A-C),p=2.2e-16)。至于侧根,多倍化以及qrt1突变在两个被背景中都会抑制侧根数目,而在Ler中,多倍化及qrt1突变的抑制作用显现出一定的可加性,而在Col中则没有(图 3-D,E)。

|
| 图 3 根的相关表型 A:4种Col背景植株幼苗根的生长曲线,生长速度无显著性差异;B:4种Ler背景植株幼苗根的生长曲线,qrt突变抑制了主根生长速度;C:8种背景14 d龄幼苗的主根长度,qrt突变抑制了主根长度;D,E:8种背景14 d龄幼苗的侧根数目,Ler中倍性与qrt突变影响可叠加,而Col中不会 |
与一般多倍化导致植株体型增大的报道不同,本研究中发现倍性对主茎高度的影响具有背景依赖性(图 4-C)),即在Col中,四倍体更高(37.72 cm增长至41.41 cm,p=2.06e-17),而在Ler中,四倍体更矮(33.52 cm降低至31.56 cm,p=2.50e-10),也许是由于样本量(30株)不够大导致的。同时,四倍体中主茎抽薹日期也被推迟(图 4-D),Col中由26.2 d推迟至39.0 d,Ler中由24.6 d推迟至35.0 d)。至于分枝,我们又分了两个表型,一个是近莲座的基部侧枝(类似于分蘖),一个是距离土壤有一定高度的主茎分枝。多倍化仅仅在Ler背景中抑制了主茎分枝的数量,在Col背景中则无影响(图 4-B)。而对于基部侧枝这个表型,不管是多倍化还是qrt1突变,都具有显著的抑制效果,同时二者抑制作用可叠加(图 4-A)。实际上,在四倍体主茎基部,可以观察到未生长的芽,所以四倍化抑制基部侧枝数目主要是通过抑制芽的生长而不是芽的发生。
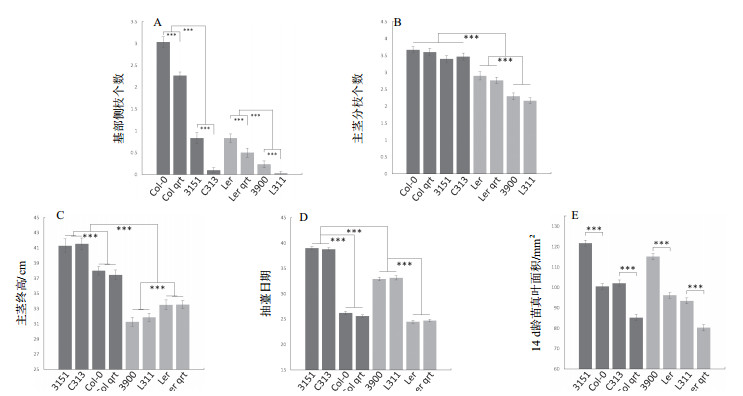
|
| 图 4 茎及叶的相关表型 A:基部侧枝数量,倍性与qrt突变皆起抑制效果,且效果可叠加;B:主茎分枝数量,Col中不受倍性或qrt突变影响,Ler中受倍性影响;C:主茎最终高度,Col与Ler受倍性影响相反;D:抽薹日期,倍性推迟抽薹日期;E:14 d龄幼苗真叶(叶长 > 1mm)叶片面积,倍性与qrt基因促进叶片初生生长 |
至于对叶的影响,在两个背景中,多倍化都导致莲座叶片面积更大,同时qrt1突变都抑制了叶片面积(图 4-E)。
2.4 生殖生长相关表型的测定与分析首先对花药进行亚历山大红染色(图 5-A),所有的花粉都被染上了红色,说明多倍化或者qrt1突变都不会影响花粉的活性。其次,我们测量了花粉(图 5-B)以及花药中隔(图 5-C)的大小,发现多倍化都使其体积增大。至于果荚,多倍化导致每果荚种子数显著降低(二倍体Col平均每果荚50.49粒,四倍体Col平均每果荚30.18粒;二倍体Ler平均每果荚40.99粒,四倍体Ler平均每果荚18.84粒)。

|
| 图 5 花以及果荚相关表型 A:花药亚历山大红染色,有活性的花粉被染成红色;B:花粉直径;C:药室中隔长度;D:每果荚种子数;E:果荚长度;F:每株果荚数(Bar=200 μm) |
本研究中新制四倍体C313与L311相比四倍体参照,每果荚种子数又进一步显著性的降低(图 5-D),3151平均每果荚32.37粒,C313平均每果荚27.98粒,3900平均每果荚20.28粒,L311平均每果荚17.40粒)。多倍化对果荚长度的影响具有背景依赖性(图 5-E),在Col中没有影响,而在Ler中使果荚长度显著降低(p=2.29e-68)。
多倍化对每株果荚个数的影响同样具有背景依赖性(图 5-F),但并不是依赖其是Col还是Ler,而是依赖于qrt1突变与否。在二倍体中,qrt1突变使果荚数显著降低。在此基础上,多倍化使野生型果荚数降低,使qrt1突变体果荚数上升。
在对种子影响上,四倍化使种子显著增大(图 6-A)。大小,即种子的长轴长与短轴长,形状,即种子的离心率。四倍化导致种子的长轴与短轴同时增大,并最终保持种子的离心率,即形状基本不变(图 6-B-D)。当然Col与Ler,不同背景之间,种子的形状就有差异,Col种子离心率更大,种子更扁。同时,加倍之前,种子长轴基本一致,而加倍之后,短轴基本一致(图 6-C-D)。在种子的发芽率方面,8个背景种子的发芽率都接近100%(图 6-F),可见虽然多倍化导致每果荚种子数大幅降低,但结出的种子都仍然保持着很好的发芽率。

|
| 图 6 种子相关表型 A:各背景种子;B:种子离心率;C:种子长轴长度;D:种子短轴长度;E:种子发芽率(红色虚线为100%发芽率). Bar=1 mm. |
四分子分析是研究遗传重组的一项强有力的手段,但一直以来,由于高等真核生物中没有适合应用四分子分析的物理结构,导致这种实验手段无法被应用于真核生物减数分裂的研究。但随着QUARTET基因被发现,在拟南芥中应用四分子分析成为了可能。陆平利教授[21]应用四分子分析成功分析了二倍体Col qrt与Ler qrt杂交后代的遗传重组。
在本研究中,首先从带有QUARTET1突变的二倍体Columbia与Landsberg erecta生态型拟南芥出发,利用秋水仙素诱导体细胞突变,并从嵌合体植株的后代中,利用流式细胞仪与荧光原位杂交技术,通过对两个传代群体之间的纵向重复以及群体内部的横向重复,筛选出成功加倍的带有qrt1突变的四倍体Columbia与Landsberg erecta生态型拟南芥C313与L311。为后续构建Col与Ler的杂交分离四倍体群体,并应用四分子分析研究多倍体遗传重组准备了材料。其次,对筛选出的Col与Ler同源四倍体的根、茎、叶、花、果荚、种子等表型进行了测定并与相对应的二倍体、四倍体Col、Ler参照进行了比对。在前人对QUARTET1表达定位研究的基础上[22],通过垂直培养幼苗,统计侧根数目,计算叶片面积,进一步确认了qrt1突变抑制了侧根生长以及叶的初生生长。本研究在Columbia与Landsberg erecta两个生态型中。既观察到了被广泛阐述的四倍化对营养生长、生殖生长的促进作用,如莲座叶片、花粉、花药、种子在四倍化的影响下明显增大;也发现了四倍化对某些器官的抑制效应,如侧根数量、基部侧枝数量、抽薹日期受到了四倍化的抑制;另外,还发现有些表型并未受到四倍化的影响,如主根长度、种子形状。上述这些表型在两个生态型背景中受到四倍化影响是相似的,同为促进或同为抑制或都不受影响,但还有一些表型,如主茎分枝数量、最终株高、果荚长度,在两个背景中受到四倍化的影响是不同的,显示出四倍化对植株的作用会受到整体基因组背景的影响。在育性方面,发现多倍化导致每果荚种子数变少。同时还发现了本研究中所诱导得来的新制四倍体C313与L311相对于四倍体对照,每果荚中种子更少,体现了新制四倍体的特征。尽管种子数降低了,但不管是二倍体还是四倍体对照还是本研究中的新制四倍体,都表现出乎了接近100%的发芽率。
本研究构建的带有qrt1突变的四倍体Col与Ler拟南芥为在四倍体中应用四分子分析准备了材料;结合本研究中测定的表型,提供了研究多倍体转录组的实验对象;还发现了新制四倍体与相对稳定四倍体之间的表型差异,提供了研究新制四倍体中染色体组如何变化并趋于稳定的实验对象。
4 结论利用秋水仙素处理带有qrt1突变的Col与Ler生态型拟南芥,通过流式细胞技术与荧光原位杂交计数筛选出成功加倍的、带有qrt1突变的四倍体Col与Ler生态型拟南芥,并观察测量了8个遗传背景拟南芥的多个营养与生殖表型,发现了qrt1突变以及倍性对拟南芥不同表型的差异化影响。
| [1] |
Leggatt RA, Iwama GK. Occurrence of polyploidy in the fishes[J]. Reviews in Fish Biology and Fisheries, 2003, 13(3): 237-246. DOI:10.1023/B:RFBF.0000033049.00668.fe |
| [2] |
Lecher P, Defaye D, Noel P. Chromosomes and nuclear DNA of Crustacea[J]. Invertebrate Reproduction & Development, 1995, 27: 85-114. |
| [3] |
Bachmann K, Bogart JP. Comparative cytochemical measurements in the diploid-tetraploid species pair of hylid frogs Hyla chrysoscelis and H. versicolor[J]. Cytogenet Cell Genet, 1975, 15(3): 186-194. DOI:10.1159/000130517 |
| [4] |
Otto SP, Whitton J. Polyploid incidence and evolution[J]. Annu Rev Genet, 2000, 34: 401-437. DOI:10.1146/annurev.genet.34.1.401 |
| [5] |
Riddle NC, Birchler JA. Effects of reunited diverged regulatory hierarchies in allopolyploids and species hybrids[J]. Trends Genet, 2003, 19(11): 597-600. DOI:10.1016/j.tig.2003.09.005 |
| [6] |
Rausch JH, Morgan MT. The effect of self-fertilization, inbreeding depression, and population size on autopolyploid establishment[J]. Evolution, 2005, 59(9): 1867-1875. |
| [7] |
Otto SP. The evolutionary consequences of polyploidy[J]. Cell, 2007, 131(3): 452-462. DOI:10.1016/j.cell.2007.10.022 |
| [8] |
Lloyd A, Bomblies K. Meiosis in autopolyploid and allopolyploid Arabidopsis[J]. Curr Opin Plant Biol, 2016, 30: 116-122. DOI:10.1016/j.pbi.2016.02.004 |
| [9] |
NTJ B. Introduction to Mathematical Theory of Genetic Linkage[M]. London: Oxford University Press, 1961.
|
| [10] |
Luo ZW, Zhang Z, Leach L, et al. Constructing genetic linkage maps under a tetrasomic model[J]. Genetics, 2006, 172(4): 2635-2645. |
| [11] |
Pecinka A, Fang W, Rehmsmeier M, et al. Polyploidization increases meiotic recombination frequency in Arabidopsis[J]. BMC Biol, 2011, 9: 24. DOI:10.1186/1741-7007-9-24 |
| [12] |
Wang L, Luo Z. Polyploidization increases meiotic recombination frequency in Arabidopsis:a close look at statistical modeling and data analysis[J]. BMC Biol, 2012, 10: 30. DOI:10.1186/1741-7007-10-30 |
| [13] |
Winge O, Laustsen O. On two types of spore germination, and on genetic segregations in Saccharomyces demonstrated through single spore cultures[J]. CR Trav Lab Carlsberg Ser Physiol, 1937, 24: 263-315. |
| [14] |
Preuss D, Rhee SY, Davis RW. Tetrad analysis possible in Arabidopsis with mutation of the QUARTET(QRT)genes[J]. Science, 1994, 264(5164): 1458-1460. DOI:10.1126/science.8197459 |
| [15] |
Rhee SY, Osborne E, et al. Microspore separation in the quartet 3 mutants of Arabidopsis is impaired by a defect in a developmentally regulated polygalacturonase required for pollen mother cell wall degradation[J]. Plant Physiol, 2003, 133(3): 1170-1180. DOI:10.1104/pp.103.028266 |
| [16] |
Galbraith DW, Harkins KR, Maddox JM, et al. Rapid flow cytometric analysis of the cell cycle in intact plant tissues[J]. Science, 1983, 220(4601): 1049-1051. DOI:10.1126/science.220.4601.1049 |
| [17] |
Heslop-Harrison JS. Cytogenetic analysis of Arabidopsis[J]. Methods Mol Biol, 1998, 82: 119-127. |
| [18] |
Riechmann J, Wellmer F. Flower Development[M]. New York: Humana Press, 2014.
|
| [19] |
Galbraith DW, et al. Systemic Endopolyp-loidy in Arabidopsis thaliana[J]. Plant Physiol, 1991, 96(3): 985-989. DOI:10.1104/pp.96.3.985 |
| [20] |
Lu P, Han X, Qi J, et al. Analysis of Arabidopsis genome-wide variations before and after meiosis and meiotic recombination by resequencing Landsberg erecta and all four products of a single meiosis[J]. Genome Research, 2012, 22(3): 508-518. DOI:10.1101/gr.127522.111 |
| [21] |
Lu P, Han X, Qi J, et al. Analysis of Arabidopsis genome-wide variations before and after meiosis and meiotic recombination by resequencing Landsberg erecta and all four products of a single meiosis[J]. Genome Research, 2012, 22(3): 508-518. DOI:10.1101/gr.127522.111 |
| [22] |
Francis KE, Lam SY, Copenhaver GP. Separation of Arabidopsis pollen tetrads is regulated by QUARTET1, a pectin methylesterase gene[J]. Plant Physiol, 2006, 142(3): 1004-1013. DOI:10.1104/pp.106.085274 |




