ABC转运蛋白,即腺苷三磷酸结合盒转运蛋白(ATP-binding cassette transporters),是目前已知最大、最古老的蛋白家族之一,广泛存在于植物细胞的质膜、液泡、线粒体和过氧化物酶体中,在植物生理活动中发挥各自作用[1-2]。植物中ABC转运蛋白种类繁多、结构复杂、功能多样。它们参与植物体内激素、脂质、金属离子、次生代谢物和外源物质的运输,且与植物抵抗病原体和逆境胁迫响应有关。
ABC转运蛋白的主要特征就是含有一个ATP结合盒的结构[3],成员通常含有1-2个核苷酸结合结构域(Nucleotide-binding domains,NBDs)和1-2个跨膜结构域(Transmembrane domains,TMDs)。TMD通常含有4-6个跨膜的α螺旋,NBD结构域则是一个长度约200个氨基酸的保守区域[4]。ABC蛋白通过NBD的结构特征和成员间的多基因亲缘关系来分类[5-6]。ABCG蛋白是植物中最大的ABC蛋白亚家族[7]。拟南芥全基因组测序结果显示其包含131个ABC转运蛋白基因,其中ABCG是数量最多的亚族(44个)[8]。ABCG亚家族分为两类。一类是WBC(White-brown complex)型,称为半分子转运蛋白。另一类为PDR(Pleiotropic drug resistance)型,称为全分子转运蛋白[9]。目前,对植物ABCG蛋白的分布和功能开展了广泛研究。如拟南芥AtABCG11能运输角质和蜡质单体,对表皮形成有极重要的作用[10-12];小立碗藓中PpABCG7突变会使表皮蜡质积累出现缺陷,降低小立碗藓对干旱胁迫的抵抗能力[13];水稻ABCG15对于花药分裂和花粉发育是必需的[14];百脉根LjABCG1参与植株抗病性[15];苜蓿MtABCG10可能参与植物抗毒素合成相关的类黄酮水平调节[16]。ABCG家族成员在植物激素信号转导相关途径中也发挥了作用[17-18]。2010年,Kuromori等[19]发现AtABCG25是植物激素脱落酸(ABA)的转运蛋白,它以同源二聚体的形式,参与细胞间ABA信号通路,对叶表面的气孔产生调节作用。过表达该基因后,保卫细胞表现出更强的ABA信号以及水分的高效利用,从而增加拟南芥的抗旱性[20]。此外,部分植物的ABCG25的cDNA序列及其演绎的氨基酸序列已经登录至GenBank,为研究其功能提供了基础。
盐芥(E. salsugineum)是十字花科盐芥属植物。作为模式植物拟南芥的近缘物种,盐芥具备生活周期短、自花授粉、基因组小、易诱变转化等和拟南芥相似的特征[21]。研究表明,盐芥具有对包括干旱、高盐、异常温度等多种逆境的更强的耐受性[22-26]。盐芥全基因组序列的解析,为进一步从分子遗传水平探究盐芥抗逆性奠定了基础[27]。这使盐芥在逆境响应与耐受的分子机制研究方面更具价值。但目前对于盐芥ABCG家族成员及其基因的结构、分布和功能还所知甚少。为了探索盐芥ABCG25的结构特征及其在盐芥抗逆性机制中的作用,本研究以已报道的盐芥EST数据库中的序列为模板设计引物,通过电子克隆技术获得EsABCG25的cDNA全长序列,并通过生物信息学方法对其进行分析,同时对EsABCG25的组织特异性和胁迫响应表达进行探究,旨在为进一步阐明EsABCG25的功能及其与盐芥逆境响应机制之间的关系奠定基础。
1 材料与方法 1.1 材料盐芥材料生态型为山东型,其种子为实验室保存。克隆载体为pGEM-T easy(Promeaga公司)。PCR引物由上海生物工程有限公司合成。采用Trizol试剂(Invitrogen公司)提取盐芥组织总RNA。逆转录酶M-MLV、T4 DNA连接酶和DNaseI等试剂均购自Promeaga公司。质粒提取和凝胶回收试剂盒购自天根生化科技有限公司,SYBR Premix Ex TaqTM试剂购自TaKaRa公司。
1.2 方法 1.2.1 盐芥材料的准备盐芥种子依次用75%乙醇消毒1 min和1%次氯酸钠消毒10 min,用灭菌水冲洗5次,每次2 min。之后将种子均匀铺于MS平板中,于4℃黑暗条件下春化一周。春化结束后置于光暗周期16 h/8 h,光照强度100 μE/m2/s,温度22℃的环境条件下培养。2周后将幼苗移栽入蛭石中继续培养,期间用营养液浇灌。培养4周后,取长势相近的植株,分别进行胁迫处理。NaCl处理:用含有200 mmol/L NaCl的营养液浇灌。干旱处理:停止浇灌营养液至蛭石基质完全失水。低温处理:将盐芥植株置于培养箱中4℃培养,正常浇灌营养液。ABA处理:叶面喷洒50 μmol/L的ABA溶液。在NaCl、低温和ABA处理12 h、24 h、1周时取中等大小叶片;干旱胁迫1-2周待叶片出现明显萎蔫后复水12 h,取盐芥叶片。采集的叶片经液氮速冻后,-80℃保存备用。上述取材时均以未处理的盐芥叶片作为对照。此外,正常条件下生长的盐芥植株,待其开花结果之后,分别取根、莲座叶、茎生叶、茎、花和角果等组织,液氮冷冻后,-80℃保存备用。
1.2.2 RNA提取与cDNA合成用Trizol试剂提取盐芥各组织的总RNA。用1%的琼脂糖凝胶电泳检测RNA质量,通过检测后,以Oligo dT(16)为引物进行逆转录。逆转录体系为25 μL,包括DEPC-ddH2O 13 μL、Rasin 1 μL、RNA模板2 μL和Oligo dT(16)(10 μmol/L)1 μL。混匀后,70℃预变性10 min,置于冰上冷却。之后依次加入5×MLV buffer 5 μL、dNTP(10 mmol/L)2 μL和M-MLV 1 μL,混匀后42℃反应9 min合成cDNA。完毕后,80℃变性5 min,-20℃保存备用。
1.2.3 EsABCG25的电子克隆以拟南芥AtABCG25序列(At1G71960)为参照对盐芥的ESTs进行Blastn比对。利用在线序列拼接程序CAP3对搜索到的与AtABCG25相似性较高的盐芥EST序列进行拼接。获得序列重叠群后,再以之为种子重复上一步直至序列不能延伸为止。根据最终获得的核酸序列设计上游和下游引物(EsABCG25P1:5'-CTCTCGTTCATTCTCTCAG-3'和EsABCG25P2:5'-GCTTAAATATTCCGAATTAA-3')。以cDNA为模板进行PCR扩增。PCR体系为25 μL,包含1×Taq酶buffer、0.25 mmol/L dNTP、上游和下游引物(0.4 μmol/L)、PfuDNA聚合酶1 μL以及cDNA模板。首先加入除DNA聚合酶外的其他组分,混匀后94℃预变性3 min,加入聚合酶进行PCR循环反应,反应程序为94℃ 1 min,57℃ 1 min,72℃ 1.5 min,35个循环,72℃ 10 min。PCR产物用0.8%的琼脂糖凝胶电泳检测后与pGEM-T easy克隆载体连接,转化至大肠杆菌感受态细胞DH5α。通过蓝白斑筛选鉴定阳性克隆,送样至上海生物工程有限公司测序。
1.2.4 EsABCG25及其编码蛋白的生物信息学分析EsABCG25的染色体定位通过使用Bioedit软件进行该基因序列与盐芥7条染色体DNA序列的BLASTN的结果来确定,位置图使用MapInspect软件(http://www.plantbreeding.wur.nl/uk/software_mapinspect.html)绘制。使用Gene Structure Display Serve 2.0[28](http://gsds.cbi.pku.edu.cn)对基因内含子与外显子结构进行分析。使用DNAMAN5.0软件对EsABCG25编码氨基酸序列进行演绎并分析其氨基酸组成。利用ProtScale工具(http://web.expasy.org/protscale/)分析蛋白质的分子量、疏水性、极性变化以及预测等电点[29]。蛋白质二级结构预测分别通过SOPMA服务器(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)和SMART在线数据库(http://smart.embl-heidelberg.de/)进行[30-31]。对于该基因的系统进化分析,首先通过NCBI Protein Blast工具(http://blast.ncbi.nlm.nih.gov/Blast.cgi)搜索EsABCG25编码氨基酸序列的同源序列,再将获得的同源序列及EsABCG25氨基酸序列通过GeneDoc软件进行多序列比对,用MEGA5.2软件根据多序列比对结果构建系统进化树。
1.2.5 高通量测序分析EsABCG25的组织特异性表达与可变剪接事件利用实验室的盐芥六种组织的高通量转录组测序文库(由深圳华大基因科技有限公司构建,项目编号F16FTSNCKF1028_THEiotE),根据已知的序列信息和GenBank登录号比对至文库中以寻找EsABCG25,并通过用RSEM(RNA-Seq by expectation maximization)策略进行基因的表达定量[32]。表达定量的结果以FPKM值表示。FPKM法能消除基因长度和测序量差异对计算基因表达的影响,计算得到的基因表达量可直接用于比较不同样品间的基因差异表达。用TopHat[33]软件对EsABCG25在转录过程中的可变剪接事件进行分析。
1.2.6 逆境胁迫下EsABCG25的Real-time PCR分析以盐芥的Tublin作为内参基因,对不同样品的cDNA模板上样量进行均一化。根据Real-time PCR引物设计原则,设计EsABCG25的特异性引物(Tubulin-F:5'-GCCAATCCGGTGCTGGTAACA-3'和Tubulin-R:5'-CATACCAGATCCAGTTCCTCCTCCC-3';EsABCG25F:5'-GGGAACGGAGAGGCGATAT-3'和EsABCG25R:5'-AAGTTTAATACGCCTCAAAGC-CA-3')
2 结果 2.1 EsABCG25的克隆以拟南芥AtABCG25序列为查询序列,通过BLAST比对筛选盐芥EST序列并进行拼接,根据拼接序列设计上、下游引物,以盐芥cDNA为模板进行PCR扩增,获得大小约为2.1 kb的特异产物(图 1)并进行测序。该基因的DNA序列以及预测其编码的氨基酸序列已登录至GenBank,登录号为KY111263。
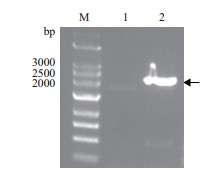
|
| 图 1 盐芥EsABCG25的扩增 M:DNA分子标准;1:其他;2:EsABCG25 |
测序分析表明EsABCG25的cDNA全长为2 154 bp,与拟南芥AtABCG25比对,发现EsABCG25含有完整编码区。在起始密码子ATG上游含有78 bp的非编码区,终止密码子TAA下游含有90 bp的非编码区,开放阅读框(Open reading frame,ORF)为1 983 bp。根据该基因序列与盐芥染色体核酸序列的BLASTN结果,确定该基因位于盐芥第5染色体上第21 935 011至第21 941 152个核苷酸区域(图 2-A),包括整个编码区在内全长为6 142 bp。对该基因内含子与外显子结构分析表明,该基因包含4个外显子和3个内含子(图 2-B),4个外显子中各有2个分布在序列的5'端和3'端。上游2个外显子分别是第1-205个核苷酸(205 bp)和第366-1 206个核苷酸(841 bp),下游2个外显子分别是第4 947-5 284个核苷酸(338 bp)和第5 372-6 142个核苷酸(771 bp)。位于基因序列中央的则是长达3 740 bp的内含子序列,位于两侧的2个内含子长度较短,均小于150 bp。
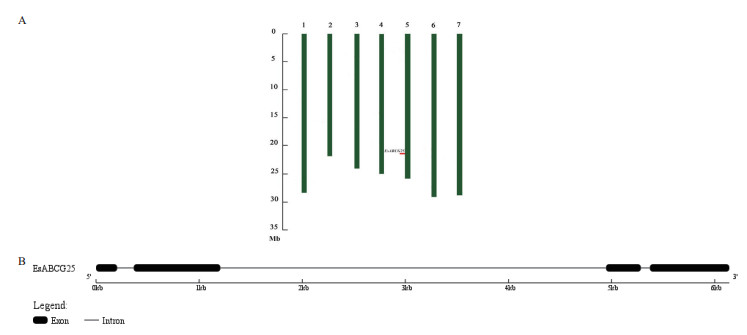
|
| 图 2 EsABCG25的染色体定位(A)和基因结构(B) A:上方数字代表染色体编号,绿色条形代表染色体,纵坐标表示染色体DNA长度;B:EsABCG25的外显子与内含子结构,黑色条状区域代表外显子,条状区域间横线代表内含子 |
EsABCG25编码一个含660个氨基酸的蛋白质,分子量为72.6 kD。预测该蛋白分子的理论等电点为9.06,含有20种基本氨基酸,其中含量最高的为亮氨酸(Leu),为13.16%;含量最低的是色氨酸(Trp),为1.06%,酸性氨基酸残基(Asp+Glu)总数57个,碱性氨基酸残基(Arg+Lys)总数69个,氨基酸极性的最大值为10.522,最小值为5.600。疏水性分析(图 3-A)表明,氨基酸序列中,第642位的苯丙氨酸(Phe)具有最高的分值2.878和最强的疏水性,而第25位的精氨酸(Arg)则具有最低的分值-2.789和最强的亲水性,整个氨基酸序列疏水值的平均值为0.209,表示EsABCG25分子有较弱的疏水性,这与具有跨膜结构的ABCG家族成员表现出的特征相近。利用SOPMA工具预测蛋白分子的二级结构,结果(图 3-B)表明,该蛋白分子由37.82%的α-螺旋、23.75%的延伸链、11.04%的β-转角和27.38%的无规则卷曲组成,表明α-螺旋和无规则卷曲是该蛋白质分子的主要二级结构元件。利用SMART数据库预测该蛋白质分子的二级结构,结果(图 3-C)显示,EsABCG25分子含有一个核苷酸结合结构域(NBD)以及一个跨膜结构域(TMD),属于半转运器,即属于WBC型。
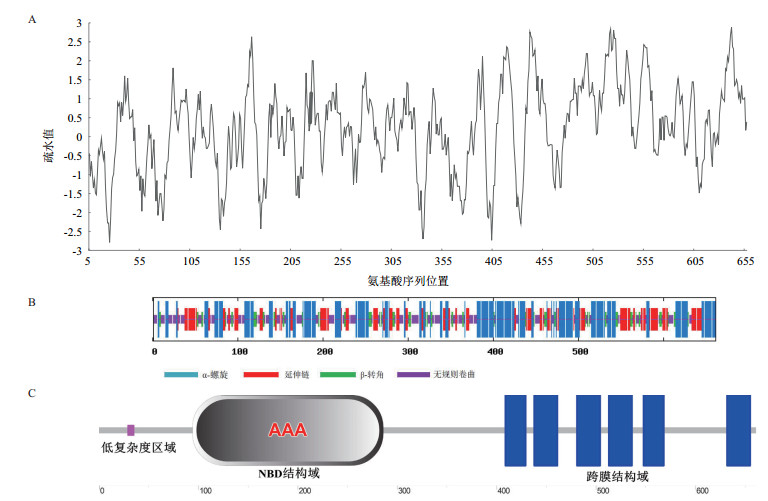
|
| 图 3 EsABCG25编码蛋白的疏水性分析(A)与二级结构预测(B、C) |
通过NCBI Protein Blast数据库搜索EsABCG25编码蛋白的同源序列,获得15种植物的高相似度氨基酸序列。这15种植物的同源序列GenBank登录号分别为芜菁(Brassica rapa,XP_009105860.1)、萝卜(Raphanus sativus,XP_018457081.1)、甘蓝(Brassica oleracea,XP_013592372.1)、拟南芥(Arabidopsis thaliana,NP_565030.1)、亚麻荠(Camelina sativa,XP_010428049.1)、醉蝶花(Tarenaya hassleriana,XP_010521140.1)、麻风树(Jatropha curcas,XP_012065776.1)、葡萄(Vitis vinifera,XP_002268373.1)、可可(Theobroma cacao,EOY17220.1)、木薯(Manihot esculenta,XP_021603498.1)、木豆(Cajanus cajan,XP_020210384.1)、绒毛烟草(Nicotiana tomentosiformis,XP_009604112.1)、木本棉(Gossypium arboretum,XP_017603971.1)、胡杨(Populus euphratica,XP_011005152.1)和大豆(Glycine max,XP_003555426.1)。比对结果(图 4)表明,盐芥EsABCG25的氨基酸序列与芜菁同源序列相似度最高,达92%,其次为甘蓝,相似度为91%;与萝卜、拟南芥和亚麻荠的同源序列相似度为87%-89%;与醉蝶花同源序列的相似度为79%;与麻风树、葡萄、可可、木薯、木豆、绒毛烟草、木本棉、胡杨和大豆等植物的同源序列相似性在63%-65%。对上述序列进行多序列比对的结果显示,EsABCG25含有和其他同源序列一致的1个NBD结构域和1个TMD结构域。NBD结构域较为保守,含有3个高度保守的特征元件,分别为Walker A(GPSGSGKST)、Walker B(LDEPTSGLD)和位于二者间的ABC signature(XSGGERKRVSIA)。

|
| 图 4 盐芥EsABCG25编码蛋白与其他植物ABCG25的氨基酸序列的相似性对比(部分序列) 比对图中所列物种拉丁名简写为盐芥(Es)、芜菁(Br)、萝卜(Rs)、甘蓝(Bo)、拟南芥(At)、亚麻荠(Cs)、醉蝶花(Th)、麻风树(Jc)、葡萄(Vv)、可可(Tc)、木薯(Me)、木豆(Cc)、绒毛烟草(Nt)、木本棉(Ga)、胡杨(Pe)和大豆(Gm)。图中A、B、C处为预测属于NBD结构域的Walker A(A)、ABC signature(B)和Walker B(C)元件 |
采用MEGA5.2的NJ策略构建上述16条同源氨基酸序列的系统进化树(图 5)。包含盐芥在内的16种植物均属于双子叶植物纲,在聚类上分成两个大分支。其中一个分支内的7种植物中有6种为十字花科植物:盐芥EsABCG25与同属于十字花科的萝卜、芜菁、甘蓝的同源序列因亲缘关系很近而聚在一起,相似性也在89%以上。但在这4种植物的聚类中,其他3种之间相对于盐芥更加相近;而另外两种十字花科植物拟南芥和亚麻荠的同源序列相比于前四者在亲缘上更加接近;此外,来自白菜花科醉蝶花属的醉蝶花的同源序列(与EsABCG25相似性为79%),相比于其他科植物,与盐芥等十字花科植物更接近。另一个分支中,属于豆科、大戟科等7科的可可、木本棉、胡杨、麻风树、木薯、葡萄、绒毛烟草、大豆和木豆等9种植物的同源序列聚类在一起,与EsABCG25的相似性均小于65%,亲缘上离盐芥相对较远。

|
| 图 5 盐芥EsABCG25编码蛋白与其他植物ABCG25蛋白的系统进化分析 |
为了解盐芥不同部位EsABCG25的表达情况,用正常条件下生长的盐芥根部、莲座叶、茎生叶、茎部、花和角果等6种组织RNA构建高通量测序文库,比对至盐芥基因和基因组数据库,通过特定统计学方法,以FPKM值为指标,确定各组织中EsABCG25的表达丰度。如图 6-A,盐芥植株的6种组织中EsABCG25均有一定程度的表达,其中EsABCG25在茎的表达丰度最高,而莲座叶中表达丰度最低,前者表达丰度是后者的11倍。
此外,该基因在同为运输通道的根部中也有较高转录水平,约为茎的一半,是莲座叶的5.5倍。在茎生叶和花当中的表达丰度则较低。用TopHat软件鉴定EsABCG25在各组织中转录时发生的可变剪接事件,结果(图 6-B)显示,在6种组织中都发现了该基因的可变剪接事件,除茎之外其他5种组织中均鉴定出2个可变剪接事件,类型分别是首个外显子可变(Alternative first exon)和内含子保留(Intron retention);而在茎中则只鉴定出首个外显子可变事件。
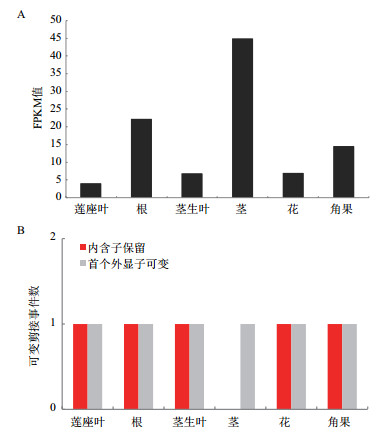
|
| 图 6 EsABCG25在盐芥不同组织中的表达情况(A)与可变剪接事件数(B) |
为了研究不同逆境胁迫对EsABCG25表达的影响,对4周龄的盐芥植株分别进行200 mmol/L NaCl,4℃低温,以及自然干旱等胁迫,此外还实施了50 μmol/L ABA处理。分别提取各处理组及对照组的叶片总RNA,逆转录后通过Real time-PCR分析EsABCG25的相对表达水平。结果表明,在不同逆境胁迫处理后,盐芥叶片EsABCG25表达水平有了不同的变化趋势。盐胁迫12 h时,EsABCG25表达水平是正常生长条件下的3.4倍,当胁迫再增加12 h后,基因表达水平回落至正常水平的1.4倍,而盐胁迫持续至1周后,基因表达持续下调,降到胁迫前水平的80%(图 7-A)。当干旱胁迫达到1周时,EsABCG25表达水平显著降低,为正常条件下的29%,而持续干旱2周后,其表达又增加至近似于原来程度(图 7-B);与盐胁迫不同的是,在4℃条件维持12 h后,EsABCG25的表达出现下调,为胁迫前的56%,但胁迫持续至24 h时,表达水平上升至正常水平的1.7倍,在4℃下生长一周后,表达再次下调至胁迫前的70%(图 7-C)。此外值得注意的是,在ABA处理12 h后,盐芥叶片EsABCG25的表达水平上升至处理前的8.8倍;持续处理24 h后,该基因表达又恢复至近似正常条件下水平,持续处理至1周,EsABCG25仍保持正常表达水平(图 7-D)。
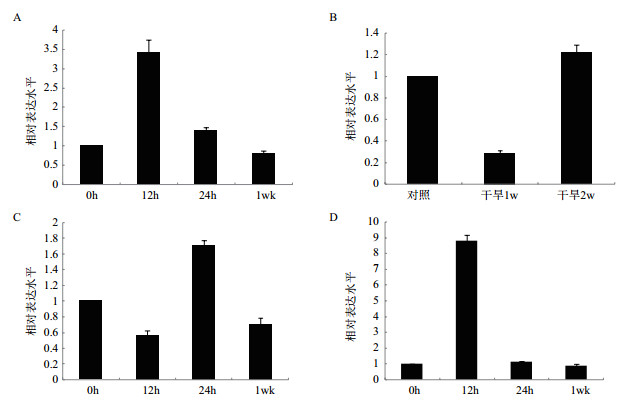
|
| 图 7 EsABCG25在不同胁迫条件下的相对表达水平 A:盐胁迫;B:干旱胁迫;C:低温胁迫;D:ABA胁迫 |
本研究以拟南芥AtABCG25序列为参照,从盐芥EST数据库中获得了与AtABCG25同源性较高的盐芥EST拼接序列。这种通过已知的近缘物种同源基因序列,利用生物信息学技术手段,对EST数据进行延伸分析的方法,能够有效地促进新基因的发现和基因功能的研究。但这种以生物信息学方法获得的基因信息,须通过分子遗传学的实验手段来验证。本研究中,根据拼接序列设计上下游引物,以盐芥cDNA为模板,首次克隆出特异性的全长序列并通过测序验证,将之命名为EsABCG25。盐芥基因组和EST序列信息的不断增加和完善,为寻找和克隆更多的盐芥ABCG成员的基因序列,完善盐芥ABCG亚家族信息奠定了基础。在通过高通量测序文库搜索EsABCG25信息的过程中,发现了另一条与EsABCG25序列相近,但编码区长度要短得多的cDNA序列(1 296 bp,XM_006390661),对该cDNA编码蛋白分子二级结构预测发现,其末端含一个NBD结构域,不含跨膜结构域,其预测功能与EsABCG25相似,二者在结构和功能上的潜在异同有待更多研究。目前已知拟南芥131个ABC家族基因中ABCG亚家族基因有44个[8]。作为拟南芥的近缘物种,盐芥比前者多2条染色体,考虑到盐芥具有更强的抗逆性以及ABCG成员广泛参与植物逆境响应机制的特点[34-35],盐芥ABCG亚家族成员在数量和功能上可能会更加丰富,且与盐芥抗逆境机制的关系会更加密切,有待进一步的挖掘。
EsABCG25二级结构预测结果表明,它含有一个核苷酸结合结构域(NBD)和一个跨膜结构域(TMD),说明其属于ABCG亚家族的半分子转运器(WBC型)[9]。这一类转运器需要以双分子的形式才能发挥功能。朱璐等[36]对拟南芥ABC转运蛋白家族的信息和功能分析发现,拟南芥ABCG亚家族中,28个成员属于WBC型。WBC型可以与自己聚合形成同源二聚体,也可以与其他WBC型成员聚合成异源二聚体。已有研究发现AtABCG11可以形成同源二聚体,而AtABCG12只能与AtABCG11结合为异源二聚体行使转运功能;AtABCG14只能严格的与AtABCG11形成异源二聚体,而AtABCG11可以形成同源二聚体或者和AtABCG9结合成异源二聚体发挥功能[37-40]。EsABCG25为WBC型的半转运蛋白,也必然以同样方式发挥功能,因此,需进一步探究其形成二聚体的方式和对象。从而了解其发挥功能的机制。
通过EsABCG25编码氨基酸序列与其他植物同源序列的比对发现,EsABCG25具有与其他分子高度相似的NBD,包含3个特征元件Walker A、Walker B和ABC signature,这一区域在各植物间是高度保守的。NBD作为核苷酸结合结构域,功能是与ATP结合,为转运提供能量来源[41],其高度保守性表明这一功能的普遍性。从进化树可以看到,来自于不同物种的ABCG25氨基酸序列构成的系统进化树与传统的植物学分类相吻合。此外,虽然EsABCG25是以拟南芥AtABCG25为参照基因克隆到的,但进化树显示,相对于拟南芥,EsABCG25与同科的另外2种植物芜菁和甘蓝的同源序列相似度更高,而相对地,拟南芥与亚麻荠同源序列最为接近。ABC转运蛋白中,TMD承担跨膜功能,是其执行运输功能的关键结构,且参与转运底物的识别[42]。如ABC家族成员ABCA1是细胞抗砷的关键蛋白之一[43],研究发现该蛋白的特异性抗砷结构位于TMD2的胞外第六α-螺旋环上,构建该区域的缺失突变导致细胞排砷功能显著下降[44]。根据多序列比对的结果,推测ABCG25在系统进化上的变化有可能来源于变异频率更高的TMD结构域上,这一区域的变异程度可能导致ABCG25在不同植物中转运功能与效率上的差异。
对AtABCG25的研究发现其主要分布于拟南芥的维管组织当中,且参与了拟南芥内源ABA的转运与相关响应机制[19]。通过转基因构建的AtABCG25过表达突变体植株的叶表面保卫细胞的ABA信号显著增强,且植株的水分利用效率明显上升,使拟南芥植株对干旱的耐受性增强[20]。本研究表明该基因在茎和根当中的表达水平非常高,是莲座叶的数倍。这与Kuromori等[19-20]实验结果表现出一致性。胁迫表达试验表明,EsABCG25对于多种逆境均产生不同程度的响应,但对于外源ABA胁迫的响应尤为显著,且EsABCG25在ABA胁迫的较早期(12 h),表达水平迅速上升,但1 d后,其表达水平又回归至正常且长期不变,相较于其他胁迫,EsABCG25对于ABA的响应更显著且更早。这暗示EsABCG25在功能上与AtABCG25的相似性。综上,推测EsABCG25很可能通过直接参与盐芥对ABA信号的响应进而引发盐芥对其他逆境的耐受机制。
可变剪接作为基因转录后修饰的一种方式,普遍存在于真核生物中。随着研究的深入,可变剪接逐渐被认可为一种能够增加蛋白质结构和功能多样性的重要机制[45]。目前认为可变剪接通过产生选择性的蛋白质产物,改变有功能和无功能转录本的比率,以及产生空间结构相似的蛋白质参与竞争等方式增加了基因表达多样性[46]。可变剪接在植物的生长发育和环境适应过程中发挥了重要作用[47-48]。本研究在盐芥的不同组织中均发现了EsABCG25的可变剪接事件,这些事件使其表达产生不同的结果,其生物学意义有待继续探讨。
盐芥与拟南芥具有相似遗传背景并表现出更强的抗逆境能力。EsABCG25作为盐芥中新的ABC蛋白基因被发现,有必要进一步研究其详细功能以及其功能在分子水平上的执行机制。
4 结论从盐芥中克隆获得cDNA全长序列2 154 bp的EsABCG25(GenBank登录号KY111263)。该基因定位于盐芥第5染色体,全长6 142 bp,含有4个外显子和3个内含子。该基因编码一个含660个氨基酸的蛋白质,蛋白分子呈现弱疏水性,含有一个NBD和一个TMD结构域,与同科植物芜菁的同源蛋白亲缘关系最近,具有ABCG家族典型特征。该基因在盐芥茎部表达最为丰富,且在各组织中均有可变剪接事件;同时其表达受到多种逆境的诱导,尤其受脱落酸的明显诱导,与盐芥的抗逆性关系密切。
| [1] |
聂智毅, 黎瑜, 曾日中. ABC转运蛋白与巴西橡胶树产胶代谢[J]. 热带农业科学, 2013, 33(12): 25-34, 40. DOI:10.3969/j.issn.1009-2196.2013.12.007 |
| [2] |
邵若玄, 沈忆珂, 周文彬, 等. 植物ATP结合盒(ABC)转运蛋白研究进展[J]. 浙江农林大学学报, 2013, 30(5): 761-768. DOI:10.11833/j.issn.2095-0756.2013.05.020 |
| [3] |
Verrier PJ, Bird D, Burla B, et al. Plant ABC proteins:a unified nomenclature and updated inventory[J]. Trends in Plant Science, 2008, 13(4): 151-159. DOI:10.1016/j.tplants.2008.02.001 |
| [4] |
Philip A. Plant ATP-binding cassette transporters[J]. Plant Biology, 2007, 58: 347-375. DOI:10.1146/annurev.arplant.57.032905.105406 |
| [5] |
Dean M, Annilo T. Evolution of the ATP-binding cassette(ABC)transporter superfamily in vertebrates[J]. Annual Review of Genomics and Human Genetics, 2005, 6(6): 123-142. |
| [6] |
Dean M, Hamon Y, Chimini G. The human ATP-binding cassette(ABC)transporter superfamily[J]. Genome Research, 2001, 11(7): 1156-1166. DOI:10.1101/gr.GR-1649R |
| [7] |
Andolfo G, Ruocco M, Di Donato A, et al. Genetic variability and evolutionary diversification of membrane ABC transporters in plants[J]. BMC Plant Biology, 2015, 15: 51. DOI:10.1186/s12870-014-0323-2 |
| [8] |
张婧, 陈梦词, 马清, 等. 植物ABCG转运蛋白研究进展[J]. 草业学报, 2015, 24(7): 180-188. DOI:10.11686/cyxb2014415 |
| [9] |
Fernandez-Calvino L, Faulkner C, Walshaw J, et al. Arabidopsis plasmodesmal proteome[J]. PLoS One, 2011, 6(4): e18880. DOI:10.1371/journal.pone.0018880 |
| [10] |
Bird D, Beisson F, Brigham A, et al. Characterization of Arabidopsis ABCG11/WBC11, an ATP binding cassette(ABC)transporter that is required for cuticular lipid secretion?[J]. The Plant J, 2007, 52(3): 485-498. DOI:10.1111/j.1365-313X.2007.03252.x |
| [11] |
Panikashvili D, Savaldi-Goldstein S, Mandel T, et al. The Arabidopsis DESPERADO/AtWBC11 transporter is required for cutin and wax secretion[J]. Plant Physiology, 2007, 145(4): 1345-1360. DOI:10.1104/pp.107.105676 |
| [12] |
Ukitsu H, Kuromori T, Toyooka K, et al. Cytological and biochemical analysis of COF1, an Arabidopsis mutant of an ABC transporter gene[J]. Plant Cell Physiology, 2007, 48(11): 1524-1533. DOI:10.1093/pcp/pcm139 |
| [13] |
Buda GJ, Barnes WJ, Fich EA, et al. An ATP binding cassette transporter is required for cuticular wax deposition and desiccation tolerance in the moss Physcomitrella patens[J]. The Plant Cell, 2013, 25(10): 4000-4013. DOI:10.1105/tpc.113.117648 |
| [14] |
Qin P, Tu B, Wang Y, et al. ABCG15 encodes an ABC transporter protein, and is essential for post-meiotic anther and pollen exine development in rice[J]. Plant Cell Physiology, 2013, 54(1): 138-154. DOI:10.1093/pcp/pcs162 |
| [15] |
Sugiyama A, Fukuda S, Takanashi K, et al. Molecular characterization of LjABCG1, an ATP-binding cassette protein in Lotus japonicus[J]. PLoS One, 2015, 10(9): e0139127. DOI:10.1371/journal.pone.0139127 |
| [16] |
Banasiak J, Biala W, Staszków A, et al. A Medicago runcatula ABC transporter belonging to subfamily G modulates the level of isoflavonoids[J]. Journal of Experimental Botany, 2013, 64(4): 1005-1015. DOI:10.1093/jxb/ers380 |
| [17] |
Ito H, Gray W. A gain-of-function mutation in the Arabidopsis pleiotropic drug resistance transporter PDR9 confers resistance to auxinic herbicides[J]. Plant Physiology, 2006, 142: 63-74. DOI:10.1104/pp.106.084533 |
| [18] |
Ko D, Kang J, Kiba T, et al. Arabidopsis ABCG14 is essential for the root-to-shoot translocation of cytokinin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111: 7150-7155. DOI:10.1073/pnas.1321519111 |
| [19] |
Kuromori T, Miyaji T, Yabuuchi H, et al. ABC transporter AtABCG25 is involved in abscisic acid transport and responses[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(5): 2361-2366. DOI:10.1073/pnas.0912516107 |
| [20] |
Kuromori T, Fujita M, Urano K, et al. Overexpression of AtABCG25 enhances the abscisic acid signal in guard cells and improves plant water use efficiency[J]. Plant Science, 2016, 251: 75-81. DOI:10.1016/j.plantsci.2016.02.019 |
| [21] |
常丽丽, 韩冰, 王海燕, 等. 盐芥响应盐胁迫的分子机制研究进展[J]. 西北植物学报, 2011, 31(12): 2565-2571. |
| [22] |
王荣, 韩旭思, 高飞, 等. 盐芥叶片响应干旱胁迫的蛋白质组学初步分析[J]. 西北植物学报, 2012, 32(3): 465-470. |
| [23] |
Inan G, Zhang Q, Li P, et al. A halophyte and cryophyte Arabidopsis relative model system and its applicability to molecular genetic analyses of growth and development of extremophiles[J]. Plant Physiology, 2004, 135(3): 1718-1737. DOI:10.1104/pp.104.041723 |
| [24] |
Wang ZL, Li PH, Fredricksen M, et al. Expressed sequence tags from Thellungiella halophila, a new model to study plant salt-tolerance[J]. Plant Science, 2004, 166(3): 609-616. DOI:10.1016/j.plantsci.2003.10.030 |
| [25] |
宋晓峰, 司晓娇, 沈晓艳, 等. 盐芥和拟南芥在不同胁迫下生理及ABA受体基因的响应[J]. 植物生理学报, 2015, 51(8): 1248-1256. |
| [26] |
杨剑超, 袁芳, 王新慧, 等. 不同浓度NaCl胁迫下盐芥与拟南芥有机渗透调节物质与抗氧化酶系统的比较[J]. 山东农业科学, 2009(12): 48-51. DOI:10.3969/j.issn.1001-4942.2009.12.012 |
| [27] |
Wu HJ, Zhang Z, Wang JY, et al. Insights into salt tolerance from the genome of Thellungiella salsuginea[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(30): 12219-12224. DOI:10.1073/pnas.1209954109 |
| [28] |
Guo AY, Zhu QH, Chen X, et al. GSDS:a gene structure display server[J]. Yi Chuan, 2007, 29(8): 1023-1026. DOI:10.1360/yc-007-1023 |
| [29] |
Kyte J, Doolittle RF. A simple method for displaying the hydropathic character of a protein[J]. Journal of Molecular Biology, 1982, 157: 105-132. DOI:10.1016/0022-2836(82)90515-0 |
| [30] |
Combet C, Blanchet C, Geourjon C, et al. NPS@:Network protein sequence analysis[J]. Trends in Biochemical Sciences, 2000, 25(3): 147-150. DOI:10.1016/S0968-0004(99)01540-6 |
| [31] |
Schultz J, Copley R, Doerks T, et al. SMART:A Web-based tool for the study of genetically mobile domains[J]. Nucleic Acids Research, 2000, 28: 231-234. DOI:10.1093/nar/28.1.231 |
| [32] |
Bo L, Colin N. RSEM:accurate transcript quantification from RNA-Seq data with or without a reference genome[J]. BMC Bioinformatics, 2011, 12: 323. DOI:10.1186/1471-2105-12-323 |
| [33] |
Kim D, Pertea G, Trapnell C, et al. TopHat2:accurate alignment of transcriptomes in the presence of insertions, deletions and gene fusions[J]. Genome Biology, 2013, 14(4): R36. DOI:10.1186/gb-2013-14-4-r36 |
| [34] |
王晓珠, 孙万梅, 马义峰, 等. 拟南芥ABC转运蛋白研究进展[J]. 植物生理学报, 2017, 53(2): 133-144. |
| [35] |
David A. The role of ABC transporters in cuticular lipid secretion[J]. Plant Science, 2008, 174: 563-569. DOI:10.1016/j.plantsci.2008.03.016 |
| [36] |
朱璐, 许杰, 张大兵. 拟南芥ABC转运类蛋白家族的分子进化、表达模式和蛋白功能网络预测分析[J]. 植物生理学报, 2012, 48(12): 1151-1166. |
| [37] |
Bouige P, Laurent D, Piloyan L, et al. Phylogenetic and functional classification of ATP-binding cassette(ABC)systems[J]. Current Protein & Peptide Science, 2002, 3(5): 541-559. |
| [38] |
Le R, Sorin C, Chakraborti D, et al. ABCG9, ABCG11 and ABCG14 ABC transporters are required for vascular development in Arabidopsis[J]. Plant J, 2013, 76: 811-824. DOI:10.1111/tpj.12334 |
| [39] |
McFarlane H, Shin J, Bird D, et al. Arabidopsis ABCG transporters, which are required for export of diverse cuticular lipids, dimerize in different combinations[J]. The Plant Cell, 2010, 22: 3066-3075. DOI:10.1105/tpc.110.077974 |
| [40] |
Zhang Q, Blaylock L, Harrison M. Two Medicago truncatula half-ABC transporters are essential for arbuscule development in arbuscular mycorrhizal symbiosis[J]. The Plant Cell, 2010, 22: 1483-1497. DOI:10.1105/tpc.110.074955 |
| [41] |
Bairoch A. Prosite:a dictionary of sites and patterns in proteins[J]. Nucleic Acids Research, 1992, 20: 2013-2018. DOI:10.1093/nar/20.suppl.2013 |
| [42] |
Higgins C, Linton K. The ATP switch model for ABC transporters[J]. Nature Structural & Molecular Biology, 2004, 11: 918-926. |
| [43] |
Singaraja RR, Visscher H, James ER, et al. Specific mutations in ABCA1 have discrete effects on ABCA1 function and lipid phenotypes both in vivo and in vitro[J]. Circulation Research, 2006, 99(4): 389-397. DOI:10.1161/01.RES.0000237920.70451.ad |
| [44] |
罗燕, 程建兵, 谭晓华, 等. 三磷酸腺苷结合盒转运体A1蛋白第二跨膜结构域缺失突变体的构建及其抗砷性研究[J]. 中国药学杂志, 2012, 47(23): 1877-1882. |
| [45] |
Birzele F, Csaba G, Zimmer R. Alternative splicing and protein structure evolution[J]. Nucleic Acids Research, 2008, 36(2): 550-558. DOI:10.1093/nar/gkm1054 |
| [46] |
李敏, 刘国庆, 蔡禄. 可变剪接与蛋白质结构多样性[J]. 生物物理学报, 2015, 31(1): 65-75. |
| [47] |
Carvalho F, Feijao C, Duque P. On the physiological significance of alternative splicingevents in higher plants[J]. Protoplasm, 2013, 250(3): 639-650. DOI:10.1007/s00709-012-0448-9 |
| [48] |
李娇. 玉米苗期干旱胁迫下可变剪接及其调控因子的研究[D]. 郑州: 郑州大学, 2013.
|




