同源异型域-亮氨酸拉链(Homeodomain-leucine zipper,HD-Zip)是植物特有的转录因子,包含一个高度保守的同源异型结构域HD,HD羧基末端紧连着一个亮氨酸拉链结构域[1]。研究发现,HD-Zip转录因子通过抑制或促进细胞的增殖、分化和生长,参与器官、维管束及分生组织的形成,调控原形成层细胞的活动及形成层细胞和维管束细胞的分化,同时还可调控激素合成及外界环境的响应[2~4]。HD-Zip转录因子已在多种草本植物及木本植物中被证明与纤维调控有关。单淳敏[5]在2014年鉴定到在纤维快速伸长期特异表达的HD-Zip类转录因子GhHOX3,该基因在棉纤维伸长的过程中发挥决定性作用。阿拉姆等[6]证明编码来自长蒴黄麻和圆果种黄麻的同源框-亮氨酸拉链蛋白hat22能够修饰,优选地增加或增强纤维长度。Du等[7]在2011年证明HD-ZIP类转录因子PtHB7在杨树次生木质部的分化调控中起重要作用,是调控杨树木质部分化的关键基因。根据DNA结合特异性、基因结构等特征可将HD-Zip分为HD-ZipⅠ-Ⅳ4个亚家族,主要参与植物的激素、光信号、逆境应答反应以及器官发育的调控[8, 9]。其中,HD-ZipⅢ已被证明参与调控维管组织纤维调控。Zhong等[10]在1999年发现拟南芥中的5个HD-ZipⅢ基因在原形成层细胞和木质部细胞中特异表达,发现显性突变体rev-10d/avb1和phb-1d的木质部包围韧皮部且维管束数目显著增多的现象。王瑞等[11]通过不同组织中表达谱的分析表明,大多数HD-ZipⅣ基因优先在发育中的胚珠和纤维中表达,从而意味着该基因家族可能参与纤维发育。但HD-ZipⅠ家族中尚未报到与维管组织纤维调控有关。最初鉴定到的HD20属于HD-Zip型Ⅰ家族,其表达与干旱和创伤等多重诱导相关的刺激有关[12]。目前,有关烟草HD20结构及分子生物学功能的研究鲜见报道。吴拥军等[13]在2009年将CHIFN-γ转入烟草中,发现转ChIFN-γ烟草具有显著的抗虫效果,且茎部维管束较对照发达。该实验室前期通过显著差异基因的GO和Pathway分析,从转ChIFN-γ烟草中筛选获得抗虫相关候选基因HD20。基因芯片结果显示转基因烟草在2个不同生长时期中HD20均显著的上调表达[14]。因此,推测转ChIFN-γ烟草茎部纤维细胞的分化与HD20的上调表达有关。本研究利用RT-PCR克隆技术,从烟草中克隆HD20的cDNA序列,对该基因及编码蛋白氨基酸进行序列分析,同时构建含HD的过表达载体pSH737-HD并将其遗传转化至拟南芥,通过石蜡切片观察其组织变化,为研究HD功能提供了一定的理论依据,为进一步研究目的基因在引起植物抗虫反应中的作用奠定基础。
1 材料与方法 1.1 材料野生型烟草K326(Wild Nicotiana tabacum)组织样本为哥伦比亚野生型拟南芥(Arabidopsis thaliana),由贵州省烟科院提供。植物表达载体pSH-737、农杆菌EHA105为本分子生物学实验室保存。
1.2 方法 1.2.1 引物设计与合成根据GenBank数据库中Homeodomain 20 transcription factor(HD20)mRNA(Accession:HM107874)序列设计引物(HD20 F:5'-ATGTTTGATGGAGGGGAATTTTC-3';HD20 R:5'-TCAAGACCAGAAATCCCACCACT-3'),由TaKaRa(大连)公司合成,预扩增片段长度约762 bp。
1.2.2 总RNA的提取和纯化烟草叶片总RNA的提取按照TRIZOl® Reagent试剂盒的操作提取[15]。1%甲醛变性琼脂糖凝胶电泳检查RNA的完整度。
1.2.3 HD20的克隆及序列分析以烟草总RNA为模板,Prime ScriptTM One Step RT-PCR Kit Ver.2试剂盒一步法直接扩增目的片段,RT-PCR体系为50 μL,包括10 mmol/L上下游引物各2 μL、2×1 Step Buffer 25 μL、Prime Script 1 Step Enzyme Mixc2 μL和RNA模板小于1 μg;反应程序为50℃反转录30 min,5℃ 2 min;95℃ 30 s,50℃ 30 s,72℃ 90 s,循环30次;72℃ 10 min。RT-PCR产物进行纯化、连接、转化。通过菌落PCR与质粒PCR验证,阳性菌液于宝生物公司(大连)测序。
利用Protscale在线软件对编码蛋白进行疏水性分析。通过NCBI在线软件Conserved domain对结构域进行预测,BLASTXP进行氨基酸同源性分析。CLUSTALW进行氨基酸多序列比对。MEGA 6软件包中的构建系统发育树。Signal P 4.1进行信号肽分析。TMHMM2.进行跨膜结构分析。Plant-PLoc进行亚细胞定位预测。SOPMA预测氨基酸序列的二级结构。MEGA6软件进行氨基酸序列进化树分析。
1.2.4 表达载体的构建及拟南芥遗传转化将含XbaⅠ和EcoRⅠ酶切位点的引物HD MF/HD MR从含有目的基因的T载体上进行PCR扩增,胶回收后与酶切处理后的pSH-737表达载体连接转化。通过菌落PCR检测,挑取检测结果为阳性的菌落提取质粒,用Hind Ⅲ/XhoⅠ进行双酶切验证,拟南芥遗传转化采用农杆菌介导法,具体步骤参照徐锦涛等[16]。
1.2.5 石蜡切片参照蔡雁峰[17]方法选取野生型及转基因拟南芥新鲜植株相同部位进行石蜡切片。
2 结果 2.1 HD20的克隆利用引物HD20 F/HD20 R对目的基因进行RT-PCR扩增(图 1),获得一条符合预期大小的目的条带,测序为762 bp,符合预期结果。
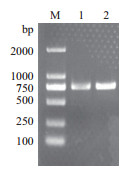
|
| 图 1 烟草HD20的RT-PCR扩增 M:DL2000 Marker;1,2:RT-PCR扩增产物 |
HD20的CDS全长762 bp,编码253个氨基酸,碱基A、G、T和C的含量分别为32.68%、23.88%、27.30%和16.14%,其中(G+C)所占百分比为40.03%。氨基酸序列分析表明,HD20成熟蛋白的分子式为C1262H1960N352O420S9,分子量为29 072.09 kD,理论等电点为4.91,稳定系数为51.26,是一类不稳定蛋白,脂溶性指数为62.09,亲水性平均数为-0.967,无跨膜结构域,说明该蛋白为不稳定亲水性蛋白;蛋白质结构域预测显示,包含2个高度保守结构域:同源异型结构域HD20(45-95)以及紧随HD20羧基末端的亮氨酸拉链结构域(97-124)(图 2)。因此HD20属于HD-Zip家族;亚细胞定位显示该蛋白定位于细胞核中(图 3);同时,HD20蛋白的二级结构表明,该蛋白是由37.15%的不规则卷曲、43.08%的α螺旋、10.67%的延伸链和9.09%的β转角组成,因此α螺旋为该蛋白二级结构的主要成分。
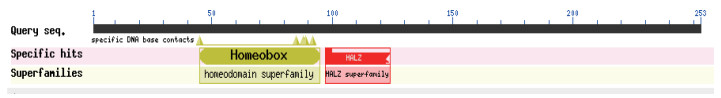
|
| 图 2 烟草HD20转录因子蛋白保守结构域 |

|
| 图 3 烟草HD20的亚细胞定位 |
氨基酸同源序列比对(图 4)显示,HD20与烟草基因ATHB-12-like同源性一致为100%。ATHB12属于同源结构域-亮氨酸拉链Ⅰ类(HD-ZipⅠ)基因,HD20属于HD-ZipⅠ亚家族。与其他高等植物ATHB-12-like基因氨基酸比对结果显示,HD20编码的氨基酸序列与辣椒(XP 016538251.1)、马铃薯(XP_006339757.1)、番茄(XP_004230017.1)、棉花(XP_017629690.1)、番茄(EOX95622.1)、枣(XP_015888788.1)大豆(XP_003528775.1)和绿豆(XP_014524102.1)编码的氨基酸序列具有较高的同源性,分别为74%、72%、69%、68%、62%、61%和58%。说明HD20编码的氨基酸与各植物中ATHB-12-like编码的氨基酸序列存在较高的同源性。采用MEGA6软件将HD20编码的蛋白序列与辣椒、番茄和马铃薯等9种植物的ATHB-12-like蛋白序列进行进化树分析,发现其与同一茄科植物的亲缘关系最接近;与棉花、枣以及胡杨等亲缘关系比较接近;与拟南芥的亲缘关系最远。
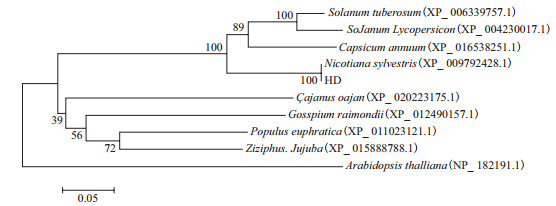
|
| 图 4 基于氨基酸序列的HD20转录因子系统发育树 Nicotiana sylvestris(美花烟草,XP_ 009792428.1),Capsicum annuum(甜辣椒,XP_ 016538251.1),SoJanum Lycopersicon(番茄,XP_ 004230017.1),Solanum tuberosum(马铃薯,XP_ 006339757.1),Çajanus oajan(木豆,XP_ 020223175.1),Gosspium raimondii(棉花,XP_ 012490157.1),Populus euphratica(胡杨,XP_ 011023121.1),Ziziphus.Jujuba(枣, XP_ 015888788.1),Arabidopsis thalliana(拟南芥,NP_ 182191.1) |
使用软件CLUSTALW对HD20与其他植物ATHB-12氨基酸进行多序列比对(图 5),发现HD20与不同物种间ATHB-12-like编码蛋白在同源异型结构域以及亮氨酸拉链结构域存在较高的保守型,说明在该类转录因子中这些保守结构域至关重要,因此进化上较保守。

|
| 图 5 HD20保守结构域序列对比 Nicotiana tabacum(HD,AGI02596.1)、Nicotiana tabacum(烟草,NP_ 01311821.1)、Nicotiana sylvestris(美花烟草,XP_ 009792428.1)、Solanum tuberosum(马铃薯,XP_ 006339757.1)、Solanum lycopersicum(番茄,XP_ 004230017.1)、Capsicum annuum(甜辣椒,XP_ 016538251.1)、Gossypium arboreum(木本棉,XP 017629690.1)、Populus euphratica(胡杨,XP_ 011023121.1)、Ziziphus jujuba(枣,XP_015888788.1)、Cajanus cajan(木豆,XP_020223175.1)、Arabidopsis thaliana(拟南芥,NP_ 182191.1) |
构建真核表达载体pSH737-HD,采用农杆菌介导转化法将HD20转化至拟南芥(图 6),并对转基因植株进行GUS染色,保存阳性植株,以便后续实验。

|
| 图 6 HD20的遗传转化 A:转基因种子的筛选;B:转基因拟南芥;C:转基因植株的检测 |
通过石蜡切片检测转HD20拟南芥组织的差异,发现茎部木质部较对照发达。结果(图 7)表明,HD20与拟南芥的纤维分化有关,推测HD20在拟南芥纤维分化过程中的重要作用。
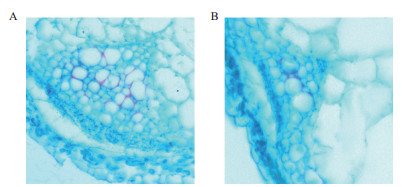
|
| 图 7 转HD20拟南芥石蜡切片 A:转HD20拟南芥茎部;B:野生型拟南芥茎部 |
烟草HD20与植物激素的表达调控相关,但其在纤维分化中的作用未见报道。本研究克隆获得烟草HD20完整编码区的cDNA序列,其推导的氨基酸序列与其他植物同源蛋白的氨基酸序列有保守的特异性序列和较高的序列相似性,其中与辣椒ATHB-12-like基因的氨基酸序列同源性最高,达74%,具有潜在的生物学意义。结构域是生物大分子体现特异结构和独立功能的基础,分析其编码的蛋白序列发现其具有典型的亮氨酸拉链结构和同源异型结构域,由此推断该蛋白属于HD-Zip家族。迄今为止,国内外对烟草HD的克隆研究较少。Re等[18]在2011年对烟草NaHD20(HM107874.2)进行克隆,获得基因长度为1 091 bp,与本研究得到HD20序列相似度为96%。烟草HD20的克隆有助于阐明不同HD20的关系及丰富HD-Zip家族成员。此外,本研究将烟草HD20遗传转化至拟南芥,石蜡切片结果显示,茎部维管束发生改变,木质部较对照更发达,表明该基因与维管组织纤维细胞的分化相关,推测该基因参与拟南芥纤维组织分化的代谢调控,在纤维细胞分化机制中发挥调控作用。因此,转ChIFN-γ烟草中HD20的上调表达是转基因烟草茎部维管束增加的直接因素。
维管组织是陆生植物主要的特征结构,为植物向上生长提供机械支撑,具有运输营养物质、水分及信号分子的作用。维管束由木质部、形成层和韧皮部3种组织组成。Sachs[19]和Aloni[20]已经开创了维管组织分化的生理研究,发现纤维形成诱导所需的信号来自幼叶。Zhong等[21]在1999年证明IFL1调控拟南芥中的间质纤维分化,编码同源二聚体-亮氨酸拉链蛋白,HD-Zip蛋白在间质细胞和维管束中表达,证明HD-Zip蛋白具有调控植物纤维细胞分化的作用。Manavella等[22]发现HD20具有调节植物激素产生的功能,尤其是对JA和ET的正调控,HD20还可对ET的敏感性及SA的积累起负调控作用。本研究表明HD20对烟草及拟南芥的维管束组织纤维分化具有调控作用。因此,推测HD20编码的HD-Zip蛋白参与植物的生长发育,对植物激素的产生具有调节功能,或者影响植物体内与激素相关的表达调控,从而导致纤维细胞发生改变。
为了更加明确地验证HD20与植物体内纤维分化的调控有关,后续可将转HD20拟南芥进行激素测定以及研究其是否在内分泌或维管束状纤维具有差异表达,进一步为HD-Zip蛋白在纤维分化的调控提供直接证据,为HD20的功能研究提供理论依据。
4 结论克隆获得HD20的cDNA序列,其蛋白序列具有典型的亮氨酸拉链结构和同源异型结构域,推测属于HD-Zip家族。HD20对烟草及拟南芥的维管束组织纤维分化具有调控作用。
| [1] |
Johannesson H, Wang Y, Engström P. DNA-binding and dimerization preferences of Arabidopsis homeodomain-leucine zipper transcription factors in vitro[J]. Plant Molecular Biology, 2001, 45(1): 63-73. DOI:10.1023/A:1006423324025 |
| [2] |
Baima S, Possenti M, Matteucci A, et al. The Arabidopsis ATHB-8 HD-Zip protein acts as a differentiation-promoting transcription factor of the vascular meristems[J]. Plant Physiology, 2001, 126(2): 643-655. DOI:10.1104/pp.126.2.643 |
| [3] |
Ariel FD, Manavella PA, Dezar CA, et al. The true story of the HD-Zip family[J]. Trends in Plant Science, 2007, 12(9): 419-426. DOI:10.1016/j.tplants.2007.08.003 |
| [4] |
Harris JC, Hrmova M, Lopato S, et al. Modulation of plant growth by HD-Zip class Ⅰ and Ⅱ transcription factors in response to environmental stimuli[J]. New Phytology, 2011, 190(4): 823-837. DOI:10.1111/nph.2011.190.issue-4 |
| [5] |
单淳敏. 棉纤维伸长的关键调控因子GhHOX3的研究[D]. 北京: 中国科学院大学, 2014. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2608674
|
| [6] |
M. 阿拉姆, M. S. 伊斯拉姆, B. 艾哈迈德, 等. 编码来自长蒴黄麻和圆果种黄麻的同源框-亮氨酸拉链蛋白hat22(hd-zip蛋白22)的核苷酸序列和使用方法: 中国, 105143247 A[P]. 2015-12-09.
|
| [7] |
Du J, Miura E, Robischon M, et al. The populus class Ⅲ HD ZIP transcription factor, POPCORONA, affects cell differentiation during secondary growth of woody stems[J]. PLoS One, 2011, 6(2): e17458. DOI:10.1371/journal.pone.0017458 |
| [8] |
Meijer AH, Kam RJD, D'Erfurth I, et al. HD-Zip proteins of families Ⅰ and Ⅱ from rice:interactions and functional properties[J]. Molecular Genetics and Genomics, 2000, 263(1): 12-21. DOI:10.1007/PL00008671 |
| [9] |
秦永芳, 李登弟, 李学宝. 植物HD-Zip转录因子研究进展[J]. 细胞生物学杂志, 2009, 31(4): 514-520. |
| [10] |
Zhong R, Taylor JJ, Ye ZH. Transformation of the collateral vascular bundles into amphivasal vascular bundles in an Arabidopsis mutant[J]. Plant Physiology, 1999, 120(1): 53-64. DOI:10.1104/pp.120.1.53 |
| [11] |
王瑞, 鲁丽丽, 刘拓, 等. 棉花中HD-Zip Ⅳ家族基因的全基因组鉴定及特征分析[J]. 分子植物育种, 2017, 15(8): 2921-2936. |
| [12] |
Raud B, Chan RL, Baldwin IT, et al. RNAi-mediated silencing of the HD-Zip gene HD20 in Nicotiana attenuata affects benzyl acetone emission from corollas via ABA levels and the expression of metabolic genes[J]. BMC Plant Biol, 2012, 12(1): 60-75. DOI:10.1186/1471-2229-12-60 |
| [13] |
吴拥军, 赵德刚, 许文钊, 等. 转ChIFN-γ基因烟草抗虫作用初步研究[J]. 云南大学学报:自然科学版, 2009, 31(6): 629-631. |
| [14] |
Wu YJ, Wu YJ, Luo X, et al. Identification of differentially expressed genes that potentially confer pest resistance in transgenic ChIFN-Î3 tobacco[J]. Gene, 2014, 543(2): 181-189. DOI:10.1016/j.gene.2014.04.027 |
| [15] |
Li D, Ren W, Wang X, et al. A modified method using TRIzol®, reagent and liquid nitrogen produces high-quality RNA from rat pancreas[J]. Applied Biochemistry & Biotechnology, 2009, 158(2): 253-261. |
| [16] |
徐锦涛. 八棱海棠actin基因的克隆与GO基因转化拟南芥研究[D]. 南京: 南京农业大学, 2008. http://cdmd.cnki.com.cn/article/cdmd-10307-2009076889.htm
|
| [17] |
蔡雁峰. 拟南芥/柴胡高度不对称体细胞杂种的研究[D]. 济南: 山东大学, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10422-2007088415.htm
|
| [18] |
Ré DA, Dezar CA, Chan RL, et al. Nicotiana attenuata NaHD20 plays a role in leaf ABA accumulation during water stress, benzylacetone emission from flowers, and the timing of bolting and flower transitions[J]. J Exp Bot, 2011, 62(1): 155-166. DOI:10.1093/jxb/erq252 |
| [19] |
Sachs T. The induction of fibre differentiation in peas[J]. Annals of Botany, 1972, 36(144): 189-197. |
| [20] |
Aloni R. Polarity of induction and pattern of primary phloem fiber differentiation in coleus[J]. American Journal of Botany, 1976, 63(6): 877-889. DOI:10.1002/ajb2.1976.63.issue-6 |
| [21] |
Zhong R, Ye ZH. Alteration of auxin polar transport in the Arabidopsis ifl1 mutants[J]. Plant Physiology, 2001, 126(2): 549-563. DOI:10.1104/pp.126.2.549 |
| [22] |
Manavella PA, Dezar CA, Bonaventure G, et al. HAHB4, a sunflower HD-Zip protein, integrates signals from the jasmonic acid and ethylene pathways during wounding and biotic stress responses[J]. Plant Journal for Cell & Molecular Biology, 2008, 56(3): 376-388. |




