棉花是世界上重要的纤维作物,由于新疆独特的自然气候使其成为国内面积最大的产棉区。棉花黄萎病是全球范围内的棉花病害之一,极大影响棉花质量及产量。棉花黄萎病是由轮枝菌属(Verticillium)的病原菌引起,目前发现有6个种是植物病原菌,分别为大丽轮枝菌(V. dahliae Klebahn)、变黑轮枝菌(V.nigrescens Pethybridge)、三体轮枝菌(V.tricorpus Isaac)、黑白轮枝菌(Verticillium albo-atrum Reinke and Berthold)、云状轮枝菌(V.nubilum Pethybridge)及V.theobromae(Turconi)[1-4]。其中造成棉花黄萎病的主要病原菌为大丽轮枝菌和黑白轮枝菌。由于植棉地区生态环境发生变化,造成病菌表现出不同的致病类型,从而产生许多致病力强的菌株类型,但是变异形成的菌株类型仍然不是太清楚。姚耀文等[5]通过致病力测定将我国棉花黄萎病分为3个生理型,分别为:生理型Ⅰ致病力极强,生理型Ⅱ致病力极弱,以及致病力中等介于前两种生理型之间的生理型Ⅲ。段维军等[6]证实新疆存在少量落叶型黄萎菌。韩宏伟等[7]通过分子手段发现新疆北部(北疆)落叶型黄萎菌比例占到39%。李彩红等[8]发现气候条件的改变会影响黄萎病菌产生遗传变异及致病类型差异。刘燕霞等[9]利用ISSR标记技术对不同地区大丽轮枝菌遗传分化及致病力进行分析。黄萎病菌菌株间的亲缘关系可以利用分子进化树及营养亲和性技术来分析。Puhalla等[10]首次利用硝酸盐营养缺陷性突变体(nit)技术研究黄萎病菌营养亲和性。本研究通过现代分子技术检测和菌株培养表型观察相结合的方法研究新疆石河子地区棉花黄萎病菌的致病类型及菌株的亲缘关系,从而明确石河子地区棉花黄萎病菌的变异和致病力分化情况,以期为该地区筛选黄萎病的耐病或抗病棉花品种提供科学依据。
1 材料与方法 1.1 材料 1.1.1 菌株与试剂棉花病株采自新疆石河子棉花种植区,其中SHZ-1至SHZ-9采自143团石南农场,SHZ-10至SHZ-16采自145团清泉集七连,SHZ-17至SHZ-24采自大学试验场二连。pMD19-T克隆载体、PCR反应液购自TaKaRa公司,琼脂糖购自Biowest公司,琼脂糖凝胶回收试剂盒购自天根生物公司,引物合成由北京华大基因有限公司完成。
1.1.2 培养基PDA培养基Czapek液体培养基及LB固体培养基[11]用于真菌及细菌培养;BM培养基、MM培养基、KPS培养基、MO2培养基及MH培养基[12-13]均用于营养亲和性研究。
1.2 方法 1.2.1 菌株分离纯化通过岳永亮等[14]的方法对本研究中感病棉株进行组织分离。分离纯化后菌株低温保存。
1.2.2 分子生物学检测通过优化的CTAB法[15]提取棉花黄萎菌DNA。以其为模板,通过真菌ITS通用引物[16]ITS1/ITS4、黄萎菌特异引物DB19/DB22、黄萎菌致病类型特异引物[17]D-1/D-2、ND-1/ND-2分别对分离菌株进行PCR扩增(表 1)。PCR扩增反应体系为20 μL,Taq聚合酶0.5 μL、Taq酶缓冲液2.5 μL、dNTP 2.0 μL、引物1.0 μL、模板1.0 μL。PCR反应程序:95℃,10 min;95℃ 45 s、56℃ 30 s,72℃ 30 s,30个循环;72℃,10 min。真菌ITS通用引物扩增后获得的阳性克隆,连接至pMD19-T载体,测序连接成功后的质粒,比对测序结果,下载比对后同源性较高的ITS序列,利用MEGA 5.0采用Neighbour-Joining Method构建病原菌株分子进化树。
通过景岚等[18]的方法对本研究中分离得到的24株棉花黄萎病菌进行营养亲和性鉴定分析
1.2.4 菌株温室致病力鉴定采用无底营养钵定量接菌液法[19-20],接菌孢子浓度为1.0×107 cef/mL。供试棉株为新陆早33号、新陆早7号、中棉35号。将单孢纯化后的菌株利用Czapek液体培养基,26℃、180 r/min避光振荡培养一周,四层纱布过滤菌丝,接种于长至3片真叶的棉苗,接种15 d后,根据感病棉苗的病情指数进行黄萎菌致病力分析。
黄萎病病级调查[19-20]:0级:健株,无病状;1级:子叶出现病状;2级:1片真叶严重发病;3级:2片真叶表现病状;4级:植株生长点死亡或全株枯死;病情指数计算公式如下:

致病力类型的划分:强致病力为Ⅰ型:平均病指30.0以上;中致病型Ⅲ型:平均病指20.1-30.0;弱致病型Ⅱ型:平均病指20.0以下。
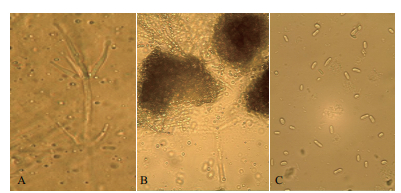
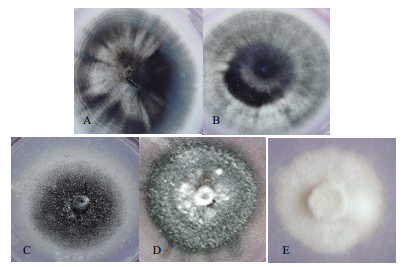
2 结果 2.1 菌落形态及显微形态鉴定本研究分离的24株菌株菌落形态,与孔德真[21]等描述相似,菌落表面为白色绒毛状,周围有黑色微菌核产生,菌落形态以圆形居多,少部分为椭圆形,进行显微观察,发现其能够产生与大丽轮枝菌相似的含有2-4个分枝的轮状分生孢子梗(图 1-A);还能够产生与大丽轮枝菌相似的黑色微菌核结构(图 1-B),在微菌核旁侧有少量无色透明孢子(图 1-C)。大部分分离菌株菌落都有同心轮纹(图 2-A),部分菌落微菌核呈现出由内向外放射状(图 2-B),综上所述,初步判定分离菌株为棉花黄萎菌。依据菌落不同形态将供试菌株分为3种。菌核型(图 2-C):培养基中央菌核较多,边缘菌核较少,菌丝菌核周围形成白色圆圈,气生菌丝不发达,无凸起。丝核型(图 2-D):产生较多菌核,呈现发散状态,边缘整齐,培养基中央有较多气生菌丝,有灰白色菌丝凸起。菌丝型(图 2-E):不产生菌核,菌丝密集且边缘整齐,无凸起,气生菌丝不发达。
|
| 图 1 分离菌株的分生孢子、孢子梗及微菌核的显微形态 注∷A:分生孢子梗;B:微菌核显微结构;C:分生孢子 |
|
| 图 2 分离菌株的微菌核形态及菌落培养类型 注∷A-B:微菌核的两种类型;C-E:黄萎菌的三种培养类型 |
供试菌株ITS区段通过真菌特异引物ITS1和ITS4进行聚合酶链式反应扩增得到约500 bp的目的条带(图 3-A)。测序后,在GenBank数据库中通过BLAST比对,发现这些序列和已知ITS序列具有高度同源性,从分子水平鉴定证明供试菌株为大丽轮枝菌。利用PCR手段通过黄萎菌特异性引物DB19/DB22对纯化的菌株进行扩增得到539 bp的特异性条带(图 3-B),从而进一步确定分离得到的菌株为大丽轮枝菌。对供试的棉花黄萎病菌采用落叶型(D-1/D-2)和非落叶型特异引物(ND-1/ND-2)进行聚合酶链式反应,落叶性引物扩增可得到约500 bp的目的条带,非落叶型引物扩增可得到约1 500 bp的目的条带(图 3-C)。确定分离得到的黄萎菌11株为落叶型,13株为非落叶型。
将分离的24株菌株ITS序列与GenBank中同源性较高的轮枝菌ITS序列进行多序列比对并构建系统进化树(图 4)。这些ITS序列信息如下:KC156638.1、U82452.1、KC156640.1、KJ696553.1、KC156635.1、KM013462.1分别来自于中国北京、美国麦迪逊、中国河南、北京、河南及重庆;分离的24株黄萎菌中SHZ-4、SHZ-5、SHZ-6、SHZ-8、SHZ-9、SHZ-11在同一进化支,与来自北京的KJ696553.1相近;SHZ-24与来自河南KCl156635.1在同一进化支比较相近;SHZ-17、SHZ-23在同一进化支上,与进化上来自美国的U82452.1和来自中国河南的KCl156640.1比较相近。

|
| 图 4 分离的24株石河子棉花棉花黄萎病菌ITS序列构建的N-J进化树 |
通过诱导培养基诱导培养15 d后,分离菌株中有10株菌株可产生突变体菌落,菌落边缘呈现扩散性生长扇形突变体菌落。而其中14株不能产生突变体。24株菌株共获得53个突变体,nit1、nitM、nit3的数值分别为39、10、4,分别占总突变体的73.58%、18.87%及7.54%。nit1突变体数量最多,最易获得;nitM次之;nit3突变体最难获得。对分离得到的24株黄萎菌的nit1和nitM突变体进行全组合配对,研究菌株之间的亲和性。结果(表 2)表明:供试菌株可分为3个不同的营养亲和群,其中SHZ-4、SHZ-5、SHZ-6、SHZ-8、SHZ-9、SHZ-11属于一个亲和群,命名为VCG1。SHZ-2、SHZ-18属于一个亲和群,命名为VCG2。SHZ-13、SHZ-21属于一个亲和群,命名为VCG3。
利用无底营养钵定量接菌液法测定24株黄萎菌在3个不同的鉴别寄主上的致病力,结果显示(表 3)24株菌株表现出明显的致病力差异。根据致病力不同将24株菌株划分为强、中、弱3种不同类型。强致病力占75%,中等致病力占8.3%,弱致病力占16.7%。其中SHZ-9菌株的致病力较强,SHZ-4号菌株的致病力较弱。
棉花黄萎病菌本身变异情况及致病力分化研究可为培育优良抗病品种及有效的病害预防提供理论基础。棉花黄萎病多是由大丽轮枝菌造成的土传病害,特点是分布广、变异性强、造成危害大。李国英等[22]研究表明石河子地区于2001-2008年间,黄萎病发病面积成倍增加,发病率高于30%的发病面积更是增加8倍以上。韩宏伟[7]等研究表明2005-2010年间新疆北部棉花黄萎菌由以中、弱致病力为主转变为以强致病力为主。本研究从石河子不同地区自然病圃采集感病植株,经组织分离、分子鉴定后获得24株大丽轮枝菌,其中强、中致病力类型菌株有20株,占到83.3%,说明石河子棉区黄萎菌以强、中致病力为主,同时本研究中强致病力菌株占到75%,这与韩宏伟等研究结果中石河子地区强致病力菌系占51.7%相比高出了23.3%,由此说明,石河子棉区黄萎病情明显加重、枯死型症状增多的主要原因是石河子地区黄萎菌群体致病力类型发生较大变化,致病力强菌系明显增加。
2004年,研究表明新疆仅有少量落叶型黄萎菌存在;2008年,新疆北部落叶型黄萎菌达到39%[7];2009年新疆石河子地区落叶型黄萎菌已达到37.9%[23]。本研究分离所获24株菌株中,落叶型黄萎菌11株,占到45.8%,这与2009年相比高出了6.8%。同时11株落叶型黄萎菌中强致病力类型9株,占81.8%,由此说明,石河子棉区在生长的中后期出现大面积落叶致光杆的主要原因是石河子地区黄萎菌群体出现较多致病性强的落叶型菌系。同时SHZ-9是24株菌株中致病力最强的菌株,但是它是非落叶型菌系,这与王国宁等[24]发现有些非落叶型黄萎菌致病力强于落叶型黄萎菌相一致。
本研究发现SHZ-9与SHZ-4在分子进化树上亲缘关系较近,且同属于VCG1,分子检测后发现两者均为非落叶型大丽轮枝菌,但侵染相同品种棉花后表现出的致病力有显著差异,SHZ-9是24株菌株中致病力最强的菌株,平均病情指数为50,而SHZ-4是致病力较弱的菌株,平均病情指数仅为17.6,这表明同为非落叶型菌系接种相同品种能表现出完全不同的致病力,与朱荷琴等[25]研究结果相似,两者致病力分化明显的原因还有待深入研究。
4 结论本研究分离获得24株石河子地区棉花黄萎病致病菌株均为大丽轮枝菌,11株落叶型黄萎菌,13株非落叶型黄萎菌。分子进化树显示24株菌在系统进化方式上属于2个不同的分支。致病力结果显示24株菌株强致病力占到75%,中等致病力占到8.3%,弱致病力占到16.7%,SHZ-9致病力最强,SHZ-4致病力较弱,菌株存在明显致病力分化现象。
| [1] |
Barbara DJ, Clewes E. Plant pathogenic Verticillium species: how many of them are there?[J]. Mol Plant Pathol, 2003, 4: 297-305. DOI:10.1046/j.1364-3703.2003.00172.x |
| [2] |
Qin QM, et al. Phylogenetic analyses of phytopathogenic isolates of Verticillium spp.[J]. Phytopathol, 2006, 6: 582-592. |
| [3] |
Klosterman SJ, Atallah ZK, Vallad GE, et al. Diversity, pathogenicity, and management of verticillium species[J]. Annual Review of Phytopathol, 2009, 47(1): 39-62. DOI:10.1146/annurev-phyto-080508-081748 |
| [4] |
White TJ, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]// Innis MA, Gelfand DH, Sninsky JJ, et al. PCR-Protocols: A guide to methods and applications. New York: Academic Press, 199: 315-322.
|
| [5] |
姚耀文, 傅翠真, 王文录, 等. 棉花黄萎病菌生理型鉴定的初步研究[J]. 植物保护学报, 1982, 9(3): 145-148. |
| [6] |
段维军, 李国英, 张莉, 等. 新疆棉花黄萎病菌致病性分化监测研究[J]. 新疆农业科学, 2004, 41(5): 324-328. |
| [7] |
韩宏伟, 刘培源, 高峰, 等. 新疆北部棉区黄萎病菌种群致病性分化及变异[J]. 植物保护学报, 2011, 38(2): 121-126. |
| [8] |
李彩红, 王永波, 赵瑞元, 等. 湖南常德地区棉花黄萎病菌培养特性及致病力分化研究[J]. 中国棉花, 2015(7): 18-21. DOI:10.11963/issn.1000-632X.201507006 |
| [9] |
刘燕霞, 侯丽娟, 等. 棉花黄萎病菌ISSR反应体系优化及其遗传多样性分析[J]. 植物保护学报, 2010(5): 425-430. |
| [10] |
Puhalla JE, Hummel M. Vegetative compatibility groups within Verticillium dahliae[J]. Phytopathol, 1983, 9: 1305-1308. |
| [11] |
沈萍, 陈向东. 微生物学实验[M]. 第4版. 北京: 高等教育出版社, 2007.
|
| [12] |
Brooker NL, Leslie JF, Dickman MB. Nitrate non-utilizing mutants of Colletotrichum and their use in studies of vegetative compatibility and genetic relatedness[J]. Phytopathol, 1991, 6: 672-677. |
| [13] |
Emi K, Shuji T, Jun-Ichi S, et al. Agrobacterium tumefaciens-mediated transformation of Aspergillus aculeatus for insertional mutagenesis[J]. Amb Express, 2011, 1: 46. DOI:10.1186/2191-0855-1-46 |
| [14] |
岳永亮, 任毓忠, 张莉, 等. 新疆榆树黄萎病病原菌鉴定[J]. 植物保护, 2016, 42(2): 251-253. |
| [15] |
伏荣桃, 王剑, 陈诚, 等. 稻曲病菌基因组DNA提取方法比较与小文库构建[J]. 生物技术通报, 2018, 34(3): 102-106. |
| [16] |
姜雨萌, 牛永春, 邓晖. rDNA ITS序列在ACCC真菌鉴定中的应用[J]. 微生物学通报, 2016, 43(5): 942-947. |
| [17] |
Pérezartés E, et al. Differentiation of cotton-defoliating and nondef-oliating pathotypes of Verticillium dahliae by RAPD and specific PCR analyses[J]. Eur J Plant Pathol, 2000, 6: 507-517. |
| [18] |
景岚, 裴旭, 杨柳青, 等. 向日葵黄萎病菌营养亲和性及致病力分化[J]. 中国油料作物学报, 2014, 36(1): 106-112. DOI:10.7505/j.issn.1007-9084.2014.01.016 |
| [19] |
任杰, 张贵, 曹雄, 等. 向日葵黄萎病菌不同培养型产毒能力和致病力分化[J]. 中国油料作物学报, 2014(3): 393-397. DOI:10.7505/j.issn.1007-9084.2014.03.016 |
| [20] |
石磊岩, 王波, 文学. 我国棉花黄萎病菌类型分化及培养特性研究[J]. 植物保护学报, 1993(3): 247-252. |
| [21] |
孔德真, 黎玉顺, 裴娟, 等. 新疆乌苏地区棉花黄萎病菌分离鉴定和致病力分析[J]. 中国农学通报, 2015(20): 61-66. |
| [22] |
李国英, 张新全, 宋玉萍, 等. 北疆棉区棉花黄萎病发生趋势、抗性研究[J]. 新疆农业科学, 2015, 52(1): 185-190. |
| [23] |
韩宏伟, 等. 石河子地区棉花黄萎病菌培养特性和致病力分化研究[J]. 新疆农业科学, 2011, 48(3): 522-527. DOI:10.6048/j.issn.1001-4330.2011.03.021 |
| [24] |
王国宁, 赵贵元, 岳晓伟, 等. 河北省棉花黄萎病菌致病性与ISSR遗传分化[J]. 棉花学报, 2012, 24(4): 348-357. |
| [25] |
朱荷琴, 李志芳, 冯自力, 等. 我国棉花黄萎病研究十年回顾及展望[J]. 棉花学报, 2017, 29(S1): 37-50. |