2. 贵州大学酿酒与食品工程学院,贵阳 550025;
3. 贵州大学生命科学学院,贵阳 550025
2. School of Liquor and Food Engineering, Guizhou University, Guiyang 550025;
3. College of Life Sciences, Guizhou University, Guiyang 550025
中国是一个磷矿资源丰富的大国,据2013-2014年美国地质调查局研究数据显示,中国现有磷矿储量约37亿t,占全球储量的5.5%,位居全球第二[1-2]。中国磷矿资源虽丰富但分布极为不均,主要集中在云南、四川、贵州、湖北等地区[3]。除分布不均外,中国磷矿还具有富矿少、贫矿多等不足,全国磷矿平均品位在17%左右[4-6]。贵州磷矿多以无机磷盐形式存在,全省磷矿平均品位为22.14%,磷矿质量居全国之首,以此资源为依托已建立了全国最重要的磷矿石和磷化工基地[7-9]。然而,磷矿在实际生产中经化学浮选工艺后将产生大量的磷尾矿渣,其组分特征为w(P2O5)≤10%[10],因含磷量低,属工业固体废弃物。目前采用丢弃或库存的方式处理,给环境造成一定影响,因此磷尾矿的综合再利用备受企业和学者的关注。现阶段,我国磷尾矿的综合利用率仅有7%,利用途径包括直接施用于土壤中、利用化学浮选法或磁选法提取有用矿物、利用酸解法制备化学复合肥及制备建筑材料[11-14]。其中,通过酸解法制备的磷肥复合肥[15],在使用中不仅降低了植物的吸收利用率[16],还会导致土壤出现板结等现象。因此,探索一种更环保、更高效的磷尾矿综合利用途径具有非常重要的意义。
近年来,随着应用生物技术的发展,大量解磷微生物涌现出来。解磷微生物是一类能将难溶性磷酸盐转化为可溶性磷酸盐的微生物。目前已知的具有解磷能力的微生物包括细菌、真菌和放线菌等,其中解磷细菌的数量和种类较多。国内外报道的解无机磷细菌主要有产碱菌属(Alcaligenes)、芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、黄杆菌属(Flavobacterium)、欧文氏菌属(Erwinia)、沙门氏菌属(Salmonella)、沙雷氏菌属(Serratia)、多硫杆菌属(Thiobacillus)等[17-20]。钟传青和Gadd等[21-22]就解磷细菌的解磷机制进行探索,研究发现解磷细菌能分泌磷酸酶和某些低分子量的有机酸,后者可向环境中提供质子和有机酸阴离子,从而促使难溶性的磷酸盐溶解[22]。故可利用解磷微生物制备解磷菌肥,此肥料不仅可提高土壤中磷的利用率,还可减少化学磷肥的使用量[23]。现阶段,解磷微生物在实际生产中已有应用,但其多样性不高,因此筛选出具有高效解磷性能的微生物,仍然是生产解磷菌肥的一项重要工作[24-26]。
本研究从贵州瓮福磷尾矿堆积场采集的土壤样品中筛选出高效解磷微生物,并通过菌株形态特征、生理生化和16S rDNA基因序列分析以及系统发育树对其菌株进行鉴定,并探索其对难溶性磷酸盐的解磷能力,为今后开发和利用解磷菌肥提供参考依据。
1 材料与方法 1.1 材料 1.1.1 仪器101-1AB电热恒温干燥箱:天津泰斯特仪器有限公司;YXQ-LS-75G立式压力蒸汽灭菌锅:上海博讯实业有限公司医疗设备厂;BMJ-250C培养箱:上海博讯实业有限公司医疗设备;JJ-CJ-IFD型超净工作台:苏州市金净净化设备科技有限公司;正置荧光显微镜:奥林巴斯Olympus;FA-2004N电子分析天平:上海菁海仪器有限公司;Heraeus Multifuge X3R大容量冷冻离心机:美国Thermo Fisher公司;721可见分光光度计:上海菁华科技仪器有限公司;PHS-3C型精密酸度计:上海大普仪器有限公司;PCR扩增仪:德国Jena;核酸电泳仪:德国Jena。
1.1.2 试剂细菌基因组DNA提取试剂盒购自美国BIOMIGA公司。磷酸三钙、葡萄糖、氯化钠和琼脂等试剂均为国产分析纯。
1.1.3 样品来源磷矿土壤样品从贵州瓮福磷尾矿堆积场采集。
1.1.4 培养基无机磷选择性固体培养基:葡萄糖10.0 g,Ca3(PO4)2 5.0 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,琼脂18 g,蒸馏水1 000 mL,pH 7.0-7.5,121℃灭菌20 min。其中以Ca3(PO4)2作为磷源,需与其他药品分开灭菌后混合。牛肉膏蛋白胨固体培养基:蛋白胨10.0 g,牛肉膏3.0 g,氯化钠5.0 g,琼脂15 g,蒸馏水1 000 mL,pH 7.0-7.4,115℃灭菌30 min。上述两种培养基的配方中去掉琼脂即可制成液体培养基。
1.2 方法 1.2.1 解磷细菌的分离筛选及纯化称取5 g土壤样品,加入盛有45 mL无菌生理盐水的锥形瓶中,制成稀释度为10-1的土壤悬液,置于30℃的摇床中振荡30 min。将土壤悬液按10倍梯度制成10-2-10-6,并各取上述梯度的土壤悬液0.2 mL均匀涂布在无机磷选择性固体培养基上,每个稀释度重复3次。将其倒置于30℃恒温培养箱中培养4-5 d后,用接种环挑取具有溶磷圈的单菌落在牛肉膏蛋白胨固体培养基上进行分离及纯化。将纯化后的菌种分别点接于无机磷选择性固体培养基上,在30℃条件下培养4-5 d后观察溶磷圈产生情况,通过十字交叉法测量溶磷圈直径(D)和菌落直径(d)。根据是否产生溶磷圈及D/d值的大小来初步确定菌株的溶磷能力,筛选出具有明显溶磷圈的菌株转接到牛肉膏蛋白胨斜面培养基上,置于4℃下保存。
1.2.2 形态学鉴定将筛选得到的解磷细菌分别点种于牛肉膏蛋白胨固体培养基上,在30℃条件下培养2 d后观察单菌落形态特征。
1.2.3 生理生化测定参考第八版《伯杰氏细菌鉴定手册》[27]测定糖醇发酵、淀粉降解、明胶液化、甲基红试验、柠檬酸盐利用试验等生理生化试验,进行观察和记录。
1.2.4 分子生物学鉴定将解磷细菌接入50 mL牛肉膏蛋白胨液体培养基,置于30℃,180 r/min的摇床中振荡2 d,然后使用细菌基因组DNA提取试剂盒(美国BIOMIGA公司)提取解磷细菌DNA。采用细菌16S rDNA通用上游引物27F(5'- AGAGTTTGATCCTGGCTCAG-3')和下游引物1492R(5'-GGTTACCTTGTTACGACTT-3')对解磷细菌进行PCR扩增。细菌PCR扩增体系为25 μL:细菌DNA模板2 μL,2×Taq PCR Master Mix 12.5 μL,上下游引物各1 μL,ddH2O 8.5 μL。细菌PCR反应程序:94℃预变性5 min后,94℃变性1 min,55℃退火1 min,72℃延伸2 min,35个循环,然后72℃延伸10 min,4℃保存。扩增后的PCR产物用1%琼脂糖凝胶,1×TAE电泳缓冲液,上样5 μL,以5 V/cm电压电泳检验,在凝胶成像仪系统进行观察,拍照。再将PCR产物送至英淮捷基贸易有限公司测序,为保证序列的准确度,测序采用双向测序。所得测序结果输入美国国家生物技术信息中心NCBI(National Center of Biotechnology Information)数据库进行比对,选取同源性较高的菌株序列作为参照,用MEGA 5.05软件构建菌株系统发育树,进行菌种鉴定。
1.2.5 磷含量标准曲线的绘制参照NY/T 2421-2013《植株全磷含量测定钼锑抗比色法》[28]中磷含量标准曲线的绘制方法,以测得的吸光度为纵坐标,磷浓度为横坐标绘制磷标准曲线。
1.2.6 解磷细菌溶磷能力及培养液pH值的测定[29]将筛选得到的菌株接种于50 mL的牛肉膏蛋白胨液体培养基中,经30℃,180 r/min过夜培养后得到种子液,菌量约为1×108 CFU/mL。再按1%的接种量接种到无机磷选择性液体培养基中后,置于上述同等条件下培养7 d。以不接菌作为对照,每株菌设置3组平行。摇床培养1-7 d过程中每天定时取样,一部分样品用pH计直接测定培养液的pH值。另一部分样品在10 000 r/min条件下离心5 min,上清液经0.45 μm滤膜过滤后用钼锑抗比色法测定OD700值,根据磷含量标准曲线计算出上清液中磷的含量。
1.2.7 数据处理试验数据采用SPSS 22. 0和Excel 2003进行相关统计和分析,用Origin 8.5软件作图,表中数据均为3次重复的平均值。
2 结果 2.1 解磷细菌的分离筛选结果在无机磷选择性固体培养基上分离出4株菌落形态不同的菌株,分别编号为PSB1、PSB2、PSB3和PSB4。通过观察这4株菌的溶磷圈大小(图 1)发现,PSB1、PSB3和PSB4具有明显溶磷圈(表 1)。

|
| 图 1 解磷细菌的溶磷圈图 |
3株解磷细菌在30℃恒温下培养2 d后菌落直径可达3-5 mm,单菌落形态及描述见表 2和图 2。

|
| 图 2 解磷细菌单菌落图 |
对筛选所得菌株PSB1、PSB3和PSB4进行部分生理生化指标测定,结果见表 3。3株菌在培养条件下均能利用柠檬酸盐(钠),并产生H2O2酶,不能产生H2S和赖氨酸脱羧酶。菌株PSB1仅能利用D-海藻糖、甘露醇和D-麦芽糖作为碳源进行生长代谢,而菌株PSB3能利用葡萄糖、蔗糖和甘露醇等多种糖醇,菌株PSB4不能利用任何一种碳源。
筛选所得3株解磷细菌的PCR产物扩增电泳图如图 3所示,将PCR产物送至英淮捷基贸易有限公司测序,测序结果表明,PSB1、PSB3和PSB4目的片段大小分别为1 409 bp、1 400 bp和1 410 bp。

|
| 图 3 三株解磷细菌的PCR产物扩增图 |
将测序得到的3株解磷细菌16S rDNA基因序列输入NCBI BLAST数据库中与较为相似且已发表的菌株16S rDNA基因序列进行比对,再通过MEGA 5.0软件,将3株解磷细菌与其同属亲缘关系较近的模式菌株进行同源性分析并构建系统发育树,结果如图 4所示。PSB1与普城沙雷氏菌(Serratia plymuthica)菌株聚在同一分支,其序列同源性为99%;PSB3与嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia)菌株聚在同一分支,其序列同源性为99%;PSB4与泡囊短波单胞菌(Brevundimonas vesicularis)菌株聚在同一分支,其序列同源性为99%。
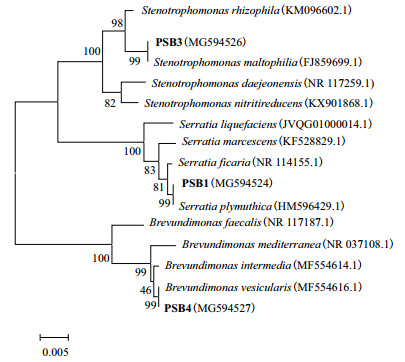
|
| 图 4 三株解磷细菌株系统发育树 括号中序号为参照菌株在GenBank中的登录号;分支点上的数字表示置信度;标尺0.005为进化距离 |
结合菌落形态特征、生理生化特征及16S rDNA序列分析结果,最后鉴定菌株PSB1、PSB3和PSB4分别为普城沙雷氏菌、嗜麦芽窄食单胞菌和泡囊短波单胞菌。
2.3 磷含量标准曲线由图 5可知,磷含量标准曲线回归方程为y = 0.500 4x-0.007 3,相关系数R2为0.999 3。结果表明,两者线性相关良好。

|
| 图 5 磷含量标准曲线 |
本实验设计利用磷酸三钙为唯一磷源,对其进行液态培养,采用钼锑抗比色法测定了不同解磷细菌的解磷能力,结果见图 6和图 7。

|
| 图 6 解磷细菌液态培养中pH值的变化 |

|
| 图 7 解磷细菌液态培养中溶磷量的变化 |
如图 6所示,3株解磷细菌在7 d液态培养过程中培养液的pH值发生了明显变化。在起初的24 h内,菌株PSB1、PSB3和PSB4培养液的pH值均显著下降,由最初pH值7.00分别下降至4.47、4.51和4.99。这可能由于解磷细菌在生长代谢过程中产生了各种有机酸,如苹果酸、柠檬酸等,导致培养液的pH值降低。直至培养到96 h时,菌株PSB3和PSB4培养液中的pH值降至最低,分别为4.30和4.35。菌株PSB1培养液在144 h时pH值降至最低,pH值为4.24。在三者pH值分别降至最低后,培养液pH值随培养时间的延长变化趋势并不明显。
如图 7所示,3株解磷细菌在7 d液态培养过程中培养液内可溶性磷含量总体呈先增加,后逐渐平缓减少的变化趋势。3株解磷细菌培养液中可溶性磷含量在0-48 h内变化显著,分别迅速升高至127.82 μg/mL、147.73 μg/mL和130.03 μg/mL。菌株PSB3培养液中可溶性磷含量在72 h时达到最高,为153.84 μg/mL,此后可溶性磷含量趋于稳定,但从96 h之后,该值出现缓慢降低的趋势。同样,菌株PSB1和PSB4培养液中可溶性磷含量在96 h时达到最高,分别为148.87 μg/mL和146.76 μg/mL,此后随着培养时间的延长,可溶性磷含量均有所下降,其中菌株PSB4培养液中可溶性磷含量下降较为明显。由于解磷细菌在产生各种有机酸将磷酸三钙溶解成可溶性磷的同时,菌体为维持自身生长代谢的需求将可溶性磷作为磷源将其利用,从而导致培养液中可溶性磷含量的降低。
3 讨论目前,许多研究者已分离出多种具有解磷能力的细菌。李白等[30]从土壤中分离得到3株解磷细菌,其中解磷能力最高可达到96.31 μg/mL。万兵兵等[31]从郑州市砂质潮土中分离出一株短小芽孢杆菌(Bacillus pumilus),最高解磷能力可达到128.90 μg/mL。余旋[32]对从四川核桃主产区根际筛选出的解磷细菌进行优化培养,最优解磷能力在200 μg/mL左右。与国内已报到的文献相比,该实验筛选所得的3株细菌PSB1、PSB3和PSB4的解磷能力均在150 μg/mL左右,都是具有较高解磷能力的菌种。
菌种PSB3被鉴定为嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia),目前对嗜麦芽寡养单胞菌的研究多以其耐药性和对动植物感染与致病等方面为主[33-35],在解无机磷方面鲜见报道。但通过该实验可知,嗜麦芽寡养单胞菌的解磷效果理想,故今后可对其在提高磷尾矿中磷的利用率以及研发解磷菌肥等方面进行深入研究。
为了研究实验筛选所得3株解磷细菌的解磷能力,对其进行液态培养。通过实验结果可知,在液态培养初期,培养液中可溶性磷含量均随着培养液pH值的降低而逐渐增加。但当培养液的pH值降至最低时,3株解磷细菌的解磷能力并非均达到最大值。通过SPSS 22.0软件对3株解磷细菌培养液的pH值和其解磷能力做相关性分析,结果发现菌株PSB1和PSB4培养液中pH值与其解磷能力存在显著的负相关性(P<0.05),相关系数r分别为-0.897和-0.958。说明菌株PSB1和PSB4是通过分泌某些有机酸来溶解无机磷,导致培养液中pH值的降低,该结论与多数已报道的研究结论相一致[36-38]。而菌株PSB3培养液中pH值与其解磷能力不存在显著相关性(P>0.05),相关系数r为-0.675,表明菌株PSB3在液态培养过程中可能产生了除有机酸以外的非有机酸物质,促使无机磷溶解。Illmer等[39]研究发现黄灰青霉(Penicillium aurantiogriseum)和假单胞菌属(Pseudomonas sp.)PI1889只有在NH4+介质存在条件下才具有溶解无机磷酸盐的能力,主要是因为呼吸作用或NH4+同化作用释放出质子引起磷酸盐的溶解,该项研究验证了非生成有机酸溶解难溶性磷酸盐的机理。故菌株PSB3同样可能也存在非分泌有机酸的其他解磷机理,具体作用机制还有待进一步研究。
4 结论本研究选取贵州瓮福磷尾矿土壤为样品,成功分离筛选出3株高效解磷细菌PSB1、PSB3和PSB4。通过对菌株的形态学特征、生理生化特征及分子生物学等技术和理论,初步鉴定菌株PSB1、PSB3和PSB4分别为普城沙雷氏菌、嗜麦芽窄食单胞菌和泡囊短波单胞菌。将上述菌种置于以磷酸三钙为唯一磷源的无机磷液体培养基中,在30℃恒温条件下培养7 d,测得最大解磷能力分别为148.87、153.84和146.76 μg/mL。菌株PSB1和PSB4培养液中pH值与其解磷能力存在显著的负相关性,而菌株PSB3不存在,其解磷机理还需进一步研究。
| [1] |
靳利飞, 周海东. 中国磷矿资源开发利用形势分析及可持续发展对策研究[J]. 中国人口·资源与环境, 2016(s1): 417-420. |
| [2] |
刘艳飞. 中国磷矿供需趋势研究[D]. 北京: 中国地质大学(北京), 2016.
|
| [3] |
冯安生, 曹飞, 吕振福. 我国磷矿资源综合利用水平调查与评价[J]. 矿产保护与利用, 2017(2): 13-17. |
| [4] |
王邵东, 张红映. 中国磷矿资源和磷肥生产与消费[J]. 化工矿物与加工, 2007(9): 30-33. |
| [5] |
张苏江, 易锦俊, 孔令湖, 等. 中国磷矿资源现状及磷矿国家级实物地质资料筛选[J]. 无机盐工业, 2016, 48(2): 2-5. |
| [6] |
薛天星, 熊先笑, 田升平. 中国磷矿主要矿集区及其资源潜力探讨[J]. 化工矿产地质, 2011, 33(1): 9-17. |
| [7] |
高志炜. 贵州省磷化工现状及发展前景[J]. 贵州化工, 1995(2): 8-10. |
| [8] |
汤德元. 磷、磷肥和磷酸盐生产工艺[M]. 贵阳: 贵州科技出版社, 1990.
|
| [9] |
朱建国, 代玉林. 贵州"十二五"磷化工产业基础与发展分析(上)[J]. 贵州化工, 2011, 36(3): 21-26. |
| [10] |
庾莉萍. 硫磺涨价困扰我国磷肥和磷复肥行业[J]. 硫磷设计与粉体工程, 2007(6): 6-8. |
| [11] |
蒋柏藩. 中国磷矿农业利用研究的五十年及展望[J]. 农业现代化研究, 1991, 12(1): 55-57. |
| [12] |
吴彩斌, 段希祥, 戴惠新, 等. 中低品位磷矿富集的新方法-干式电选法[J]. 化工矿物与加工, 2003, 32(9): 7-9. |
| [13] |
解田, 高晓明, 等. 高镁磷尾矿渣制取磷镁复合肥的工艺条件初步研究[J]. 化工矿物与加工, 2010, 39(12): 19-21. DOI:10.3969/j.issn.1008-7524.2010.12.007 |
| [14] |
杨丽, 邱跃琴, 金恒, 等. 磷尾矿在胶结充填物材料制备中的应用[J]. 矿治工程, 2014, 34(3): 457-461. |
| [15] |
胡宏, 李艳. 高镁磷尾矿渣制取磷镁复合肥料的试验研究[J]. 贵州化工, 2009, 34(2): 20-21. |
| [16] |
Khurana MP. An Inoculating Potential of Phosphate-Solubilising Microbes as Biofertlizers[J]. Journal of Biofertilizers & Biopesticides, 2013. |
| [17] |
Behera BC, Yadav H, Singh SK, et al. Alkaline phosphatase activity of a phosphate solubilizing Alcaligenes faecalis, isolated from Mangrove soil[J]. Biotechnol Research Innovation, 2017, 1(1): 101-111. DOI:10.1016/j.biori.2017.01.003 |
| [18] |
柯春亮, 陈宇丰, 等. 香蕉根际土壤解磷细菌的筛选、鉴定及解磷能力[J]. 微生物学通报, 2015, 42(6): 1032-1042. |
| [19] |
张淑云. 土壤解磷微生物研究进展[J]. 内蒙古林业科技, 2015, 41(1): 39-41. |
| [20] |
Paul D, Sinha SN. Isolation and characterization of a phosphate solubilizing heavy metal tolerant bacterium from River Ganga, West Bengal, India[J]. Songklanakarin Journal of Science & Technology, 2015, 37(6): 651-657. |
| [21] |
钟传青, 黄为一. P17菌株产生磷酸酶的影响因素及其定域研究[J]. 山东建筑大学学报, 2012(1): 32-35. |
| [22] |
Gadd GM. Fungal production of citric and oxalic acid:importance in metal speciation, physiology and biogeochemical processes[J]. Advances in Microbial Physiology, 1999, 41: 47-92. DOI:10.1016/S0065-2911(08)60165-4 |
| [23] |
贺梦醒, 高毅, 胡正雪, 等. 解磷菌株B25的筛选、鉴定及其解磷能力[J]. 应用生态学报, 2012, 23(1): 235-239. |
| [24] |
滕泽栋, 李敏, 朱静, 等. 解磷微生物对土壤磷资源利用影响的研究进展[J]. 土壤通报, 2017(1): 229-235. |
| [25] |
林英, 司春灿, 韩文华, 等. 解磷微生物研究进展[J]. 江西农业学报, 2017, 29(2): 99-103. |
| [26] |
吴文丽, 洪坚平, 孟会生, 等. 连续施用解磷菌肥对复垦土壤磷酸酶和Hedley磷形态的影响[J]. 中国土壤与肥料, 2016(4): 59-64. DOI:10.11838/sfsc.20160410 |
| [27] |
R. E. 布坎南, 等. 《伯杰细菌鉴定手册》[M]第8版. 上海: 中译本科学出版社, 1984.
|
| [28] |
中华人民共和国农业部. NY/T 2421-2013《植株全磷含量测定钼锑抗比色法》[S]. 北京: 中国标准出版社, 2013.
|
| [29] |
叶震, 陈秀蓉, 杨淑君. 东祁连山高寒植被土壤解磷菌筛选及其解磷能力的初步研究[J]. 草原与草坪, 2010, 30(5): 6-10. |
| [30] |
李白, 李军, 沈亚强. 三株土壤解磷细菌的分离及其解磷效果分析[J]. 生物技术通报, 2017, 33(5): 203-209. |
| [31] |
万兵兵, 刘晔, 等. 一株玉米根际多功能促生菌的筛选鉴定及效应研究[J]. 生物技术通报, 2016, 32(8): 169-176. |
| [32] |
余旋. 四川核桃主产区根际解磷细菌研究[D]. 成都: 四川农业大学, 2011.
|
| [33] |
唐敏, 李丽, 肖蓉, 等. 嗜麦芽寡养单胞菌胞外蛋白酶功能研究进展[J]. 微生物学报, 2016, 56(5): 731-739. |
| [34] |
孙安民, 王亚强, 王伟. 嗜麦芽寡养单胞菌检出率与耐药性分析[J]. 中华医院感染学杂志, 2015(23): 5317-5319. |
| [35] |
赵苏瑛, 杨琳, 李鹏飞, 等. 嗜麦芽寡养单胞菌获得性耐药的机制研究及整合子分布调查[J]. 中华医院感染学杂志, 2017, 27(2): 263-266. |
| [36] |
赵小蓉, 林启美, 孙焱鑫, 等. 细菌解磷能力测定方法的研究[J]. 微生物学通报, 2001, 28(1): 1-4. |
| [37] |
Liu Z, Li YC, Zhang S, et al. Characterization of phosphate-solubilizing bacteria isolated from calcareous soils[J]. Applied Soil Ecology, 2015, 96: 217-224. DOI:10.1016/j.apsoil.2015.08.003 |
| [38] |
康贻军, 胡健, 单君, 等. 两株解磷真菌的解磷能力及其解磷机理的初步研究[J]. 微生物学通报, 2006, 33(5): 22-27. |
| [39] |
Illmer P, Schinner F. Solubilization of inorganic calcium phosphates—Solubilization mechanisms[J]. Soil Biology & Biochemistry, 1995, 27(3): 257-263. |







