改变微藻的培养条件(如氮磷硅等营养成分、pH、温度、光强等)既可调控微藻的脂肪酸组成,又可调控微藻的总脂含量[1-4]。添加植物生长调节剂也是其中一种有效手段。据报道,2,4-表油菜素内酯(2,4-Epibrassinosteroid,EBR)、赤霉素(Gibberellin A3,GA3)、吲哚乙酸(Indole-3-acetic acid,IAA)、水杨酸(Salicylic acid,SA)等植物生长调节剂对促进微藻生长、优化脂肪酸组成、增加抗逆性等有显著功效[5]。该结论在小球藻(Chlorella sp.)、球等鞭金藻(Isochrysis galbana)等微藻中得以印证[6]。微拟球藻(Nannochloropsis sp.),属于真眼点藻纲(Eustigmatophyceae),是一类具有巨大开发潜力的经济微藻。其富含多糖、蛋白和多不饱和脂肪酸(PUFAs)等高附加值产物,被广泛用作水产饵料及心脏病、糖尿病等疾病的预防[7]。此外,微拟球藻油脂含量高,被视为最有发展前景的生物柴油原材料之一[8]。
目前,植物生长调节剂对微拟球藻产油率及脂肪酸组成影响的研究较少,本实验着重分析了EBR、GA3对微拟球藻大洋种(Nannochloropsis oceanica)生长、产油率和脂肪酸组成的影响,拟找出最适浓度,为微拟球藻的研究和应用提供借鉴。
1 材料与方法 1.1 材料微拟球藻藻种编号为N. oceanica LAMB0001,由中国海洋大学应用微藻生物学实验室提供。培养基选用f/2海水培养基[9]。培养温度(24±1)℃,光周期(L: D)12 h: 12 h,光照强度60 μmol photons/(m2·s)。每天固定时间摇瓶4次,防止细胞贴壁。EBR和GA3购自美国Sigma公司,使用微孔膜过滤除菌配制成母液,低温保存。
1.2 方法 1.2.1 实验流程将微拟球藻培养至指数生长中期,分别取60 mL接种于新鲜f/2培养基中至总体积300 mL,并分别添加EBR和GA3至相应的终浓度。EBR和GA3分别设置4个浓度梯度0、5、15和50 mg/L,每个浓度设置3个平行。培养10 d,收集细胞,测定干重、脂肪酸组成及总脂含量。期间,每天监测藻液光密度变化。
1.2.2 光密度及干重测定光密度测定方法:本实验使用750 nm波长下藻液的吸光度来表示藻液光密度。光密度值代表细胞密度。干重测定方法:离心收集一定体积的藻液,冷冻干燥后称取藻粉重量。
1.2.3 总脂含量测定分析取30 mg冷冻干燥的藻粉至密封性良好的螺口玻璃管中,加入氯仿-甲醇(体积比2: 1)剧烈震荡15 min,离心(4 000 r/min,10 min)后吸取上清液至新的螺口玻璃管中。重复抽提3次。向装有上清液的玻璃管中加入适量NaCl溶液(0.9%),充分震荡混匀,静置30 min。吸取下层有机相至新玻璃管中,50℃水浴待氯仿全部挥发,称重并计算总脂含量。
1.2.4 脂肪酸组成测定分析取20 mg冷冻干燥的藻粉置于密封性良好的螺口玻璃管中,加入2 mL KOH-CH3OH溶液(2 mol/L)于75℃水浴锅中皂化和甲酯化30 min;冷却至室温后加入2 mL HCl-CH3OH溶液(3 mol/L),75℃水浴酸化30 min;冷却后再加入1 mL色谱级正己烷和适量蒸馏水,充分震荡促进分层;吸取正己烷相待测。
脂肪酸组成分析:采用Agilent 6890 Series GC System气相色谱仪(US10251016,USA),色谱柱为HP-5毛细管柱(30 m×320 µm×0.25 µm,5% Phenyl Siloxane),检测器为氢火焰离子化检测器(FID)。使用安捷伦化学工作站数据处理系统(Agilent Chemsation)分析结果,以面积归一化法计算脂肪酸组分的相对百分含量。
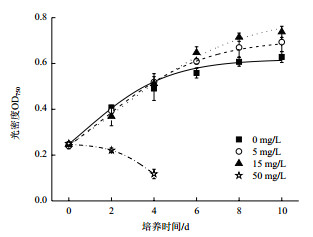
2 结果 2.1 EBR和GA3对生长的影响添加不同浓度EBR的微拟球藻生长状况如图 1所示。曲线使用Origin 7.0软件非线性拟合得到,光密度值代表细胞密度,曲线斜率变化代表生长速率。当EBR浓度小于15 mg/L时,随着EBR浓度升高,微拟球藻对数生长期不断延长。培养至第10天,15 mg/L EBR处理组光密度较5 mg/L处理组和对照组分别提高了6.44%和17.45%。由此可见,15 mg/L EBR对其生长促进最明显。而50 mg/L EBR对微拟球藻生长产生了抑制作用,培养仅至第4天,光密度就下降至初始值的47%,显微观察发现藻细胞已裂解。
|
| 图 1 不同浓度EBR对微拟球藻藻液光密度的影响 |
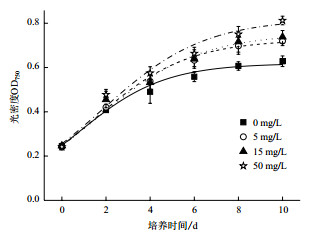
与EBR不同,较对照组,本实验中所设3种浓度的GA3均能促进微拟球藻生长,对数生长期延长(图 2)。培养10 d后,添加了5、15和50 mg/L GA3的处理组光密度分别比对照组高出14.54%,17.51%和29.28%;50 mg/L GA3处理下光密度达到最大。说明GA3对微拟球藻的细胞增殖十分有效。
|
| 图 2 不同浓度GA3对微拟球藻液光密度的影响 |
本实验所设50 mg/L EBR显著抑制微拟球藻生长,藻液浓度过低,以致无法收集测定后续指标。如表 1所示,添加较低浓度(5、15 mg/L)的EBR后,该藻生物量较对照组显著增加,分别增加了9.19%、13.97%,而总脂含量并未发生显著变化。综合生物量和总脂含量来看,添加5和15 mg/L EBR后该藻产油率较对照组分别增加了7.85%和13.97%。生物量增幅与产油率增幅相近,由此推测EBR对微拟球藻产油率的提高主要归功于其对该藻生物量积累的促进,并不影响单位质量藻细胞的总脂含量。
由表 1可知,在实验浓度范围内,GA3处理组微拟球藻生物量较对照组显著提高,且随GA3浓度增加而增加;当GA3为50 mg/L时,生物量最高达0.337 g/L。而总脂含量与之不同,5、15、50 mg/L处理组较对照组均没有显著变化。综合生物量和总脂含量分析,产油率在GA3为15 mg/L时达到最大值(8.184 mg/(L·d)),显著高于对照组及5和50 mg/L处理组。以上结果表明,实验所设浓度GA3均显著促进了微拟球藻生物量的积累,而对总脂含量影响不大。产油率的差异主要是来自GA3对微拟球藻生长的影响。总体来看,15 mg/L GA3对产油率提高效果最显著。
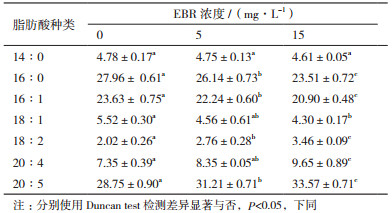
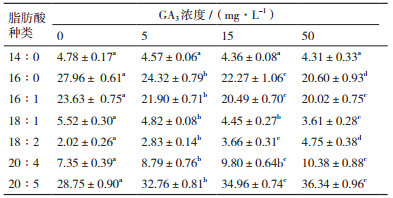
2.3 EBR和GA3对脂肪酸组成的影响不同浓度EBR和GA3对微拟球藻脂肪酸组成的影响如表 2和表 3所示。与对照相比,不同浓度的EBR和GA3对14: 0(十四烷酸,其中14代表脂肪酸碳链长度,0代表双键的数量;以此类推)所占比例基本无影响,16: 0、16: 1、18: 1所占比例随着EBR和GA3浓度升高而显著降低,而18: 2、20: 4、20: 5(EPA)所占比例显著提高。特别是EPA含量显著提高,培养仅10 d,15和50 mg/L GA3处理组中其含量即分别达到了34.96%和36.34%。
EBR是一种广谱、无毒的高活性植物激素,其最突出的作用是促进细胞伸长与分裂、促进植物光合作用及增加植物抗逆性[10-12]。范新照等[13]认为2 μmol/L EBR即可显著促进微茫藻(Micractinium sp.)生长;而10 μmol/L EBR则显著抑制其生长,最大生物量较对照组减少了72.83%。王小飞等[14]研究表明,在0-0.2 mg/L范围内,随EBR浓度升高,三角褐指藻(Phaeodactylum tricornutum)生物量呈先增后减之趋势。本实验发现,在5、15 mg/L时,EBR显著促进微拟球藻生长;而50 mg/L EBR则会抑制该藻生长。这与前人研究结果相似,但因不同藻种对EBR敏感性有差异,其最适作用浓度也不同。
GA3是重要的植物激素之一,其主要作用是促进细胞分裂。Falkowska等[15]研究了GA3对镉铅胁迫条件下普通小球藻(Chlorella vulgaris)的影响,结果表明,GA3可促进细胞增殖和光合色素及单糖的积累。Park等[16]发现,1 mg/L GA3对莱茵衣藻(Chlamydomonas reinhardtii)生长促进效果最显著。范新照等[13]使用GA3处理微茫藻后发现,1 μmol/L GA3对藻株生长有明显促进作用;增加GA3浓度至5 μmol/L则会显著抑制该藻生长,其最大生物量比对照组减少了60.70%。据报道,在一定浓度范围(0.01-10 mg/L)内,随GA3浓度升高,其对铜绿微囊藻(Microcystis aeruginosa)生长促进越明显;浓度过高则会抑制其生长[17]。在本实验浓度范围内,GA3对微拟球藻生长促进效果也随GA3浓度增大而增强,这与低浓度EBR在其他藻中的作用效果相似。但本实验中浓度尚未达到抑制微拟球藻生长的临界值,更高浓度GA3的作用效果有待后期探索。
3.2 EBR和GA3对微拟球藻总脂含量及产油率的影响除调节微藻生长外,适宜浓度EBR和GA3对其总脂含量也有显著影响。郝宗娣等[6]研究表明,EBR能显著提高原始小球藻(Chlorella protothecoides)的总脂含量。王小飞等[14]认为0.1 mg/L EBR能显著提高三角褐指藻的产量和总脂含量。本实验发现,EBR处理下的微拟球藻产油率和生物量是同步增加的,而单位质量藻细胞的总脂百分含量并未发生明显改变,推测EBR提高微拟球藻产油率是通过促进其细胞增殖实现的。
目前,GA3对微藻总脂含量影响的研究较少。据报道,1.0 μmol/L GA3处理下,微茫藻油脂含量较对照组有所降低;GA3浓度为5.0 μmol/L时,其生物量降低但油脂含量却显著提高[13]。在本研究中,50 mg/L GA3虽促进了微拟球藻生物量积累,但显著抑制了单位质量藻细胞的总脂含量,而15 mg/L GA3处理下总脂含量和产油率达到最高,效果较好,且优于EBR处理组的效果。综上,适宜浓度GA3对于促进该藻生长、总脂积累作用显著。
3.3 EBR和GA3对微拟球藻脂肪酸组成的影响多不饱和脂肪酸是形成生物膜的必备条件之一,在维持生物膜流动性中起关键作用[18]。此外,参与多个重要生理过程,如物质转运[19]和叶绿体形成[20]等。本实验中,添加EBR(5和15 mg/L)和GA3(5、15和50 mg/L)后,微拟球藻中饱和及单不饱和脂肪酸(16: 0、16: 1、18: 1)占比随浓度升高而逐渐下降,多不饱和脂肪酸(18: 2、20: 4、20: 5)占比则显著提高。培养10 d后,15和50 mg/L GA3处理组中EPA含量即分别达到了34.96%和36.34%。结果表明,一定浓度EBR和GA3可促进微拟球藻生长和油脂积累并优化其脂肪酸组成。EPA属于ω3系长链多不饱和脂肪酸,具有维持生物膜的结构和功能、预防心脑血管疾病、提高机体免疫力和改善视力等功效[21]。作为EPA主要来源,现有鱼油难以满足人们的持续需求[22],微拟球藻作为一类重要的经济微藻,在EPA生产上潜力巨大。
4 结论本研究发现,5、15 mg/L EBR能显著促进微拟球藻生长和提高其产油率,但对单位质量藻细胞总脂含量影响不大。50 mg/L EBR则显著抑制该藻生长。5、15和50 mg/L GA3均显著促进微拟球藻生物量积累。15 mg/L GA3对微拟球藻产油率提升效果最显著。50 mg/L GA3处理组生物量最高,但总脂积累受到一定抑制。添加EBR和GA3浓度后,饱和和单不饱和脂肪酸占比下降,多不饱和脂肪酸占比显著提高。
| [1] |
陈程浩, 吴嘉仪, 汤明星, 等. 八株海洋微藻Nannochloris sp.生长及生化性状评价[J]. 生物技术通报, 2016(6): 231-237. |
| [2] |
郭兵, 龚阳, 万霞, 等. 光强和温度对球等鞭金藻(Isochrysis sphaerica)生长及其脂肪酸的影响[J]. 中国油料作物学报, 2011, 33(3): 295-301. |
| [3] |
陈传红, 吴洪, 李青, 等. 三株栅藻属藻株光合自养产油脂的比较研究[J]. 生物技术通报, 2016, 32(6): 238-243. |
| [4] |
刘菲菲, 冯慕华, 尚丽霞, 等. 温度对铜绿微囊藻(Microcystis aeruginosa)和鱼腥藻(Anabaena sp.)生长及胞外有机物产生的影响[J]. 湖泊科学, 2014, 26(5): 780-788. DOI:10.18307/2014.0517 |
| [5] |
Salama ES, Kabraa N, Ji MK, et al. Enhancement of microalgae growth and fatty acid content under the influence of phytohormones[J]. Bioresource Technology, 2014, 172: 97-103. DOI:10.1016/j.biortech.2014.09.002 |
| [6] |
郝宗娣, 刘平怀, 时杰, 等. 不同植物激素对原始小球藻生长及油脂含量的影响[J]. 广东农业科学, 2012, 39(8): 104-107. |
| [7] |
Ferreira M, Coutinho P, Seixas P, et al. Enriching rotifers with "premium" microalgae. Nannochloropsis gaditana[J]. Marine Biotechnology, 2009, 11(5): 585-595. DOI:10.1007/s10126-008-9174-x |
| [8] |
何文栋, 朱葆华, 等. 微拟球藻富油藻株筛选及柱状光生物反应器培养评价研究[J]. 水生生物学报, 2017, 4(5): 1112-1117. DOI:10.7541/2017.139 |
| [9] |
Guillard RRL, Ryther JH. Studies of marine planktonic diatoms. Ⅰ. Cyclotella nana Hustedt, and Detonula confervacea(cleve)Gran[J]. Canadian Journal of Microbiology, 1962, 8: 229-239. DOI:10.1139/m62-029 |
| [10] |
张琳. 油菜素内酯的生理效应及发展前景[J]. 北方园艺, 2011, 20: 188-191. |
| [11] |
郑洁, 王磊. 油菜素内酯在植物生长发育中的作用机制研究进展[J]. 中国农业科技导报, 2014, 16(1): 52-58. |
| [12] |
李辉, 左钦月, 涂升斌. 油菜素内酯生物合成和代谢研究进展[J]. 植物生理学报, 2015, 51(11): 1787-1798. |
| [13] |
范新照, 费小雯, 吴小霞, 等. 植物生长调节剂EBR和GA3对微茫藻18A8(Micractinium sp.)生长和油脂积累的影响[J]. 热带农业科学, 2013, 33(2): 4-8. |
| [14] |
王小飞, 张问, 等. 2, 4-表油菜素内酯对三角褐指藻生长及有机质积累的影响[J]. 植物生理学报, 2015, 9: 1482-1488. |
| [15] |
Falkowska M, Pietryczuk A, Piotrowska A, et al. The effect of gibberellic acid(GA3)on growth, metal biosorption and metabolism of the green algae Chlorella vulgaris(Chlorophyceae)beijerinck exposed to cadmium and lead stress[J]. Polish Journal of Environmental Studies, 2011, 20(1): 53-59. |
| [16] |
Park WK, Yoo G, Moon M, et al. Phytohormone supplementation significantly increases growth of Chlamydomonas reinhardtii cultivated for biodiesel production[J]. Applied Biochemistry & Biotechnology, 2013, 171(5): 1128-1142. |
| [17] |
王勤. 植物生长调节剂对铜绿微囊藻(Microcystis aeruginosa)生长特性影响的研究[D]. 南京: 南京农业大学, 2009.
|
| [18] |
Chang YT, Chang MC, et al. Distinctive roles of unsaturated and saturated fatty acids in hyperlipidemic pancreatitis[J]. World J Gastroenterol, 2015, 21(32): 9534-9543. DOI:10.3748/wjg.v21.i32.9534 |
| [19] |
Xiao YF, Ke Q, Wang SY, et al. Single point mutations affect fatty acid block of human myocardial sodium channel alpha subunit Na+ channels[J]. Proc Natl Acad Sci USA, 2001, 98: 3606-3611. DOI:10.1073/pnas.061003798 |
| [20] |
Wallis JG, Browse J. Mutants of Arabidopsis reveal many roles for membrane lipids[J]. Prog Lipid Res, 2002, 41: 254-278. DOI:10.1016/S0163-7827(01)00027-3 |
| [21] |
李文宗, 王磊. 长链多不饱和脂肪酸EPA、DHA的基因工程研究进展[J]. 生物技术通报, 2016, 32(8): 1-7. |
| [22] |
胡亚平, 吴刚, 张丽, 等. 长链多不饱和脂肪酸的替代来源———转基因油料作物[J]. 生物技术通报, 2016, 6: 1-6. |