昆虫是自然界中最大的生物种群,约占整个生物种类的85%,诸多昆虫还具有很高的药用价值[1-2]。蜚蠊(Blatta)是传统的中药材,俗名“蟑螂”,为节肢动物门昆虫纲蜚蠊目昆虫。主要分布于我国广东、福建、云南、广西等南部地区,大多具有家栖或半家栖习性,是一种生命力和繁衍能力都特别强的昆虫类群,文献报道其体内也存在大量内生微生物[3]。微杆菌(Microbacterium)大多存在于土壤、污水、乳制品中,有关昆虫肠道内生微杆菌的报道很少见。我们课题组从蜚蠊代表性虫种美洲大蠊(Periplaneta Americana)肠道中分离得到了8株微杆菌,并发现有6株微杆菌对常见致病细菌和真菌的生长具有抑制作用,现对整个分离纯化、分子生物学鉴定和抑菌活性实验等过程进行如下报道。
1 材料与方法 1.1 材料 1.1.1 昆虫样品采集广东省广东药科大学室外捕捉野生美洲大蠊,观察其形态特征,经广东药科大学寄生虫学教研室老师鉴定,与美洲大蠊成虫体貌特征相符合,鉴定为美洲大蠊(Periplaneta americana)。
1.1.2 培养基菌株分离采用高氏合成Ⅰ号培养基(广东环凯微生物科技有限公司),为了抑制真菌和其他细菌的生长,加入了65 μg/mL的重铬酸钾;菌株纯化和保藏采用不含抗生素的高氏合成Ⅰ号培养基(广东环凯微生物科技有限公司);菌株发酵采用链霉菌培养基2号(ISP-2):葡萄糖4 g,酵母提取物4 g,麦芽提取物10 g,无菌水1 000 mL,pH7.2-7.4;种子培养基:葡萄糖10 g,酵母提取物2 g,胰蛋白胨12 g,无菌水1 000 mL,pH7.2-7.4。
1.1.3 供试菌株包括4株细菌和4株真菌,分别为金黄色葡萄球菌(Staphylococcus aureus ATCC 25923)、耐甲氧西林金黄色葡萄球菌(Methicillin-resistant S.Aureus ATCC 25213)、枯草芽孢杆菌(Bacillus subtilis ATCC 6633)、肺炎克雷伯杆菌(Klebsiella pneumoniae ATCC 13883),以及白色念珠菌(Candida albicans ATCC10231)、红色毛癣菌(Trichophyton rubrum NBRC 5467)、黑曲霉(Aspergillus niger ATCC16404)和烟曲霉(Aspergillus fumigatus ATCC16404)。
1.1.4 实验试剂及仪器Ezup柱式细菌基因组DNA抽提试剂盒(上海生工生物工程技术服务有限公司)、Taq PCR Master mix、DNA Marker(TaKaRa公司)、PCR仪(美国Bio-Rad公司)、电泳仪(北京六一仪器厂)、GelDoc凝胶成像系统(美国Bio-Rad公司)、台式高速离心机(Eppendorf)。
1.2 方法 1.2.1 蜚蠊肠道内生微杆菌的分离纯化与形态学观察采用表面消毒法对美洲大蠊进行预处理:用蒸馏水将虫体冲洗干净;75%乙醇将虫体漂洗1-2 min进行消毒;无菌水冲洗3-5次;15%次氯酸钠漂洗3 min;无菌水冲洗3-5次。剪去足、翅、触角等部位,将其腹部从侧面切开并取出肠道,放入匀浆器中进行充分研磨。将研磨液采用倍比稀释的方法逐步稀释至所需浓度(1×10-3 g/mL,2×10-3 g/mL,4×10-3 g/mL),每个浓度3个平行试验。取200 μL均匀涂布于平板上,放置在28℃培养箱内培养3-7 d,参照《常见细菌鉴定手册》[4]挑取平板上的目标菌株的单菌落接种于铺满高氏Ⅰ号培养基的平板上进行进一步的分离纯化。经纯化后的菌株,同时采用插片法[5]和显微镜观察的方法对菌株进行形态学的观察。对纯化后的8株内生微杆菌进行革兰氏染色,用光学显微镜进行观察。
1.2.2 菌株16S rDNA系统发育树的构建及同源性BLAST比对参照Ezup柱式细菌基因组DNA抽提试剂盒说明书中的操作步骤提取8株蜚蠊肠道内生微杆菌的DNA,采用通用保守引物(27f:AGAGTTTGATCCTGGCTCAG;1492r:TACGGCTAC CTTGTTACGACTT)[6-7]进行目标菌株16S rDNA基因扩增。PCR反应体系(50 μL):Taq PCR Master mix 25 μL,ddH2O 18 μL,上游引物、下游引物各2.5 μL,模板DNA 2 μL,同时设立阴性对照组。反应条件:94℃ 4 min、94℃ 30 s、57℃ 70 s、72℃ 30 s,进行35个循环;72℃延伸5 min后放置4℃保存。PCR得到的产物用1%琼脂糖凝胶电泳进行分析。电泳条件:120 V,200 mA,15 min。将PCR产物交由上海上海英潍捷基公司进行测序,将结果与GenBank数据库中已知的序列进行BLAST同源性比对。选取种属接近和比对指标靠前的16S rDNA序列,利用MEGA 5.0[8]软件的邻接法(Neighbor-Joining)进行系统发育树的构建。采用Mothur DOS[9]工具划分操作分类单元(OTU),与其他基因序列相似度低于98%定义为一个独立的OUT,以此其进行聚类分析。
1.2.3 蜚蠊肠道内生微杆菌抑菌活性的筛选将分离得到的微杆菌接种到种子培养基中,置于摇床中,28℃,180 r/min培养2 d,然后转接到ISP-2培养基中进行发酵,培养7 d。取出发酵液,于4℃台式离心机4 000 r/min离心20 min。上清液用乙酸乙酯(1: 1.5)萃取3次,萃取后的有机层进行悬蒸浓缩并称重,于4℃冰箱保存备用。采用牛津杯法进行活性测定。将浓缩的粗提物配制成20 mg/mL的甲醇溶液,置于4℃备用。每个含有受试菌的平板均匀放置4-5个牛津杯,每个牛津杯加200 μL抑菌液,阳性药物分别为环丙沙星和两性霉素B。细菌受试菌于37℃培养箱培养12-16 h,真菌受试菌于28℃培养箱培养72 h,观察牛津杯周围有无抑菌圈,平行测定3次。
1.2.4 最低抑菌浓度(Minimum inhibitory concentra-tion,MIC)的测定采用微量稀释法测定6株活性菌株粗提物对8株常见致病菌的MIC值[10]。真菌按照美国CLSI制定的标准方案[11],用无菌研磨器将真菌的菌丝研磨均匀后置于无菌生理盐水中,用计数板计数后使得细菌菌液浓度为108 CFU/mL,真菌浓度为104 CFU/mL。于不同96孔板的1-10列每孔中分别加入100 μL MHB液体培养基/RPMI-1640液体培养基用于细菌及真菌的培养,50 μL受试细菌/真菌菌液以及50 μL倍比稀释后的32-0.0625 mg/mL的活性菌株粗提物溶液,第11列分别加入100 μL MHB液体培养基/RPMI-1640液体培养基作为生长对照孔,第12列加入200 μL MHB液体培养基/RPMI-1640液体培养基作为空白对照空。将细菌96孔板置于37℃培养箱培养18-24 h,真菌96孔板置于28℃培养箱培养24-72 h,通过肉眼观察,以无菌生长孔定义为该粗提物的MIC值。
1.2.5 蜚蠊肠道内生微杆菌抗生素合成关键酶基因的筛选参照Christiansen等[12-14]方法,利用Gen-Bank数据库检索已知Helogenase、非核糖体多肽合成酶(Nonribosomal peptide synthetase,NRPS)及多聚酮和酶(Polyketone synthase I,PKSI)的相关序列。利用ClustalW2进行比对,比对结果经Primer 5.0进行在线引物设计,利用DNAman对设计得到的引物进行功能评估后得出3对简并引物:Helogenase(Halo-B4-FW:TTCCCSCGSTACCASTC-GGSGAG;Halo-B7-RV:GSGGGATSWMCCAGWAC-CASCC)、NRPS(A3F:GCSTACSYSATSTACACST-CSGG;A7R:SASGTCVCCSGTSCGGTAS)、PKSI(K1F:TSAAGTCSAACATCGGBCA;M6R:CGCA-GGTTSCSGTACCAGTA)。对设计好的引物进行PCR反应。PCR反应体系(25 μL):Taq PCR Master mix 12.5 μL,ddH2O 9.5 μL,上下游引物各1 μL,模板DNA 1 μL,同时设立阴性对照组。反应条件:94℃ 3 min、94℃ 1 min、58℃ /55℃/59℃ 2 min(FADH2/PKSI/NRPS)、72℃ 1 min,进行30/35个(FADH2/PKSI、NRPS)循环;72℃延伸5 min。PCR得到的产物用1%琼脂糖凝胶电泳进行分析。FADH2约700 bp,PKSI约750 bp,NRPS约900 bp。
2 结果 2.1 蜚蠊肠道内生微杆菌的分离纯化与形态学观察从药用蜚蠊肠道中分离并经过形态学和分子生物学鉴定得到了8株肠道内生微杆菌,将8株微杆菌在高氏合成Ⅰ号培养基平板上进行划线,于28℃培养箱培养3-4 d,观察菌落颜色及形态。将各菌株分别进行革兰氏染色均呈阳性,菌株的革兰氏染色结果如图 1所示,符合微杆菌的形态特征。

|
| 图 1 分离菌株的革兰氏染色(10×100) |
将提取的8株微杆菌的DNA进行PCR扩增,16S rDNA基因序列扩增产物进行琼脂糖凝胶电泳分析,目的基因扩增的片段为1 000-2 000 bp之间。通过BLAST比对,选取GenBank中与目标菌株同源性高的已知菌株,利用MEGA 5.0软件进行系统发育树的构建,如图 2所示。构建出的系统发育树表明,8株微杆菌与其亲缘关系最近的菌株的相似性均>98%,其中WA12-1-7与其最亲缘菌株的相似性高达100%,分析结果如表 1所示。发育树的分析结果进一步确证了8株菌均为微杆菌。

|
| 图 2 目的菌株16S rDNA基因序列N-J系统发育树 |
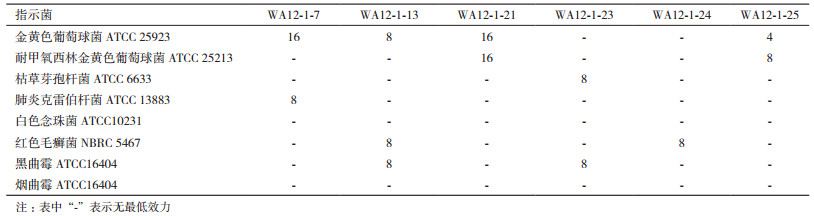
在相同浓度条件下,分离得到的8株蜚蠊肠道内生微杆菌中有6株微杆菌的次级代谢产物对一种或多种真菌和细菌均表现出了不同程度的抑菌活性,活性菌株占总分离菌株的75%。如表 2-3所示,其中,对金黄色葡萄球菌有活性的菌株有4株;对耐甲氧西林金黄色葡萄球菌活性的菌株有2株;对肺炎克雷伯杆菌有活性的菌株有1株;对枯草芽孢杆菌有活性的菌株有1株;对红色毛癣菌有活性的菌株有2株;对黑曲霉有活性的菌株有2株。
通过对6株活性菌株粗提物进行最低抑菌浓度(MIC)测定,得出不同浓度的菌株粗提物对8株常见病原菌具有不同程度的抑菌活性,其中活性较强的为WA12-1-13、WA12-1-13、WA12-1-13及WA12-1-25(表 4)。
经过筛选得出8株蜚蠊肠道内生微杆菌中有6株具有卤化酶的阳性菌株,并且这6株菌菌对NRPS(约900 bp)及PKSI(约750 bp)表达为阳性(表 5),表明这些菌株具有良好的合成聚酮类物质或多肽类物质的潜力。
近年来,有关昆虫肠道微生物的研究报道逐渐增多,国内外研究学者陆续从蜜蜂、甲壳虫、白蚁等昆虫体内发现了具有抗菌活性的内生菌[15-17]。本研究从药用昆虫蜚蠊肠道中分离得到了8株内生微杆菌,微杆菌是一种稀有的放线菌,诸多文献报道微杆菌主要用于修复被油污染的地表水[18]、印染废水的处理[19]及有机脱硫[20]等,未见其有关其抗菌活性的报道。本实验发现,有6株至少对其中一种病原菌具有抑菌活性,有5株对其中2种或2种以上的病原菌具有抑制活性,MIC值测定的结果也表明活性菌株粗提物对8株常见致病菌具有不同程度的抑菌活性,体现出了蜚蠊肠道内生微杆菌次级代谢产物的广谱抗菌活性。不同的抗菌谱也表明蜚蠊肠道内生微杆菌能产生多种抗菌成分,而不是只有单一的活性成分。
目前,已发现且结构明确的微生物次级低些产物高达50 000多个,具有活性的有20 000多个。其中,绝大多数为具有抗菌或抗肿瘤的卤化次级代谢产物[21-22]。FADH2依赖性卤化酶被认为是卤化次级代谢产物中最重要的卤化酶[23]。本研究对8株微杆菌进行FADH2依赖性卤化酶基因筛选发现有6株呈阳性,为进一步评估菌株产生卤化次级代谢产物的潜力,以非核糖体多肽合成酶及Ⅰ型聚酮合酶为例,进一步进行其他关键代谢酶基因的筛选,发现8株微杆菌全部对PKSI基因表达为阳性,3株对NRPS基因表达呈阳性,结合活性测定结果,进一步证实菌株产生活性卤化代谢产物的能力。本研究结果表明,蜚蠊肠道内生微杆菌的次级代谢产物对细菌及真菌均有不同程度的抑菌活性,说明从微杆菌次级代谢产物中寻找新型活性化合物具有可行性。下一步拟采用柱层析、高效液相、质谱、核磁共振等现代波谱技术对微杆菌抗菌活性物质进行进一步研究。
4 结论本实验以8株美洲大蠊肠道内生微杆菌为研究对象,经实验发现6株微杆菌次级代谢产物对8种常见致病病原菌具有不同程度的抑制作用并从基因水平分析了其产生活性次级代谢产物的潜力。
| [1] |
吴逸群, 马兰, 于东帅. 药用昆虫的价值与研究[J]. 湖北农业科学, 2013, 52(24): 5966-5969. DOI:10.3969/j.issn.0439-8114.2013.24.004 |
| [2] |
张振玲. 药用昆虫的经济价值及养殖前景[J]. 甘肃畜牧兽医, 2016, 46(17): 41-41. DOI:10.3969/j.issn.1006-799X.2016.17.021 |
| [3] |
陈启亮, 唐东昕, 龙奉玺. 土家药蜚蠊的研究进展[J]. 时珍国医国药, 2015(7): 1719-1721. |
| [4] |
沙莎, 宋振辉. 动物微生物实验教程[M]. 重庆: 西南师范大学出版社, 2011.
|
| [5] |
陈红军. 野生刺五加内生真菌分离与鉴定[J]. 实用中医药杂志, 2016, 32(7): 740-741. |
| [6] |
Chen L, Zhang H, Liu G, et al. First report on the bacterial diversity in the distal gut of dholes(Cuon alpinus)by using 16S rRNA gene sequences analysis[J]. J Appl Genet, 2016, 57(2): 275-283. DOI:10.1007/s13353-015-0319-0 |
| [7] |
王超男, 任争光, 李兴红, 等. 葡萄酸腐病相关细菌的分离鉴定及其拮抗菌作用机理[C]//中国植物病理学会第十二届青年学术研讨会论文选编. 2015.
|
| [8] |
Arun J, Selvakumar S, et al. In vitro antioxidant activities of an exopolysaccharide from a salt pan bacterium Halolactibacillus miurensis[J]. Carbohydr Polym, 2017, 155: 400-406. DOI:10.1016/j.carbpol.2016.08.085 |
| [9] |
Vilanova C, et al. The generalist inside the specialist: Gut bacterial communities of two insect species feeding on toxic plants are domin-ated by Enterococcus sp. [J]. Frontiers Microbiol, 2016, 7: 1005.
|
| [10] |
Janardhanan S, Mahendra J, Girija AS, et al. Antimicrobial effects of garcinia Mangostana on cariogenic microorganisms[J]. J Clin Diagn Res, 2017, 11(1): ZC19-ZC22. |
| [11] |
Duraipandiyan V, Aldhabi NA, Ignacimuthu S. New antimicrobial anthraquinone 6, 61-bis(1, 5, 7-trihydroxy-3-hydroxymethylanthr-aquinone)isolated from Streptomyces sp. isolate ERI-26[J]. Saudi J Biol Sci, 2016, 23(6): 731. DOI:10.1016/j.sjbs.2016.02.008 |
| [12] |
Hornung A, Bertazzo M, Dziarnowski A, et al. A genomic screening approach to the structure-guided identification of drug candidates from natural sources[J]. Chembiochem, 2007, 8(7): 757-766. DOI:10.1002/(ISSN)1439-7633 |
| [13] |
王海强, 安向向, 等. 39株内生放线菌次级代谢产物的合成潜能[J]. 河北大学学报:自然科学版, 2017(3): 254-261. |
| [14] |
Xiong ZQ, Liu QX, Pan ZL, et al. Diversity and bioprospecting of culturable actinomycetes from marine sediment of the Yellow Sea, China[J]. Archives of Microbiology, 2015, 197(2): 299-309. DOI:10.1007/s00203-014-1059-y |
| [15] |
Cary JW, et al. An Aspergillus flavus secondary metabolic gene cluster containing a hybrid PKS-NRPS is necessary for synthesis of the 2-pyridones, leporins[J]. Fungal Genet Biol, 2015, 81: 88. DOI:10.1016/j.fgb.2015.05.010 |
| [16] |
孙新新, 宁娜, 谭慧军, 等. 白蚁肠道微生物多样性和作用研究进展[J]. 应用与环境生物学报, 2017(4): 764-770. |
| [17] |
Taechowisan T, Peberdy JF, Lumyong S. Isolation of endophytic actinomycetes from selected plants and their antifungal activity[J]. World J Microbiol Biotechnol, 2003, 19(4): 381-385. DOI:10.1023/A:1023901107182 |
| [18] |
张辉, 李培军, 胡筱敏, 等. 采用固定化微杆菌技术修复油污染地表水[J]. 农业环境科学学报, 2007, 26(3): 915-919. |
| [19] |
许尤厚, 周洪波. 产絮凝剂微杆菌的絮凝特性及印染废水处理应用[J]. 工业水处理, 2016, 36(12): 59-63. DOI:10.11894/1005-829x.2016.36(12).014 |
| [20] |
张通, 吴琼, 刘柯澜, 等. 微杆菌对乌海高硫煤中有机硫脱除的研究[J]. 煤炭学报, 2009(7): 957-960. |
| [21] |
Smith DR, et al. Scope and potential of halogenases in biosynthetic applications[J]. Curr Opin Chem Biol, 2013, 17(2): 276-283. DOI:10.1016/j.cbpa.2013.01.018 |
| [22] |
Schaffert L, Albersmeier A, Winkler A, et al. Complete genome sequence of the actinomycete Actinoalloteichus hymeniacidonis type strain HPA 177Tisolated from a marine sponge[J]. Standards in Genomic Sciences, 2016, 11(1): 91. DOI:10.1186/s40793-016-0213-3 |
| [23] |
Ma L, Zhang W, Zhu Y, et al. Identification and characterization of a biosynthetic gene cluster for tryptophan dimers in deep sea-derived Streptomyces sp. SCSIO 03032[J]. Appl Microbiol Biotechnol, 2017, 101(15): 1-14. |