2. 西南科技大学核废物与环境安全国防重点学科实验室,绵阳 621000
2. State Defense Key Laboratory of the Nuclear Waste and Environmental Security, Southwest University of Science and Technology, Mianyang 621000
铀(U)矿开发、提炼及放射性废弃物处理所造成的污染对人类生存的安全及整个生物圈存在严重的威胁。U因其衰变周期长、生物毒性高且难以代谢等特性,若处理不当进入体内,会引起肾肝的病变,甚至导致死亡[1-2]。因此,治理以U为代表的放射性污染与U矿的开发及利用具有同等重要的意义。与物理修复、化学修复等传统修复方法相比,微生物修复以其技术简单、费用低廉、高效、对环境影响小等优点引起人们的重视[3-5]。微生物在被污染土壤环境去毒方面具有独特的作用[6],利用微生物的对重金属的吸附及耐受能力,可最大程度压缩放射性废弃物体积[7-9]。国内外研究中发现的可富集并耐受U的菌株已有数十种,如1991年,Lovely等[10]就已发现异化Fe(Ⅲ)还原菌G. metallireducens及S. oneidensis可以通过自身还原作用富集U(Ⅵ),随后的研究表明柠檬酸杆菌[11]、酵母菌[12-13]、耐辐射奇球菌[12]、假单胞菌[14]、藻类[15]等都具有富集U(Ⅵ)的能力。一般情况下,其对U的吸附能力为细菌(400-900 mg/g)>放线菌(440 mg/g)>真菌(170-215 mg/g)>藻类(0-560 mg/g)[2, 16-21]。
U污染常伴随着其他的重金属污染,这是因为多数金属矿床和非金属矿床都含有硫化物,并常与重金属元素共生[22]。U矿中除含有大量U及U的衰变子体如226Ra、Th等带有放射性核素外还含有很多非放射性的重金属如铜、锌、锰(Mn)、镉、铅、铬、镍及砷(As)等[23-27]。Mn、As作为U的伴生元素,广泛存在于U污染区,且鲜有Mn、As在U尾矿区对微生物修复影响的报道;在国内外的研究中,微生物处理放射性核素主要是培养后静态吸附研究,对于培养过程中微生物与放射性核素的相互作用的研究甚少[15]。因此,本实验尝试利用U尾矿区分离的地衣芽孢杆菌在生活状态下耐受并富集U、Mn、As,研究其在培养条件下对U、Mn、As的富集特性,利用红外光谱(FTIR)探讨富集前后菌体的变化。并通过多因素实验,探究Mn、As对地衣芽孢杆菌U富集的影响,旨在为U污染区微生物修复,超富集植物体减容提供理论支持。
1 材料与方法 1.1 材料 1.1.1 菌种及来源地衣芽孢杆菌[Bacillus licheniformis BCRC12826(DQ309323)]来源于U尾矿腐烂植物体。由西南科技大学生命科学与工程学院分离鉴定并保存。
1.1.2 试剂乙酸锰,亚砷酸钠,乙酸双氧铀。U离子(六价)易与有机物质产生沉淀,导致培养基有效U离子浓度降低,故选取较溶菌肉汤(LB)液体培养基有机物含量少且成分简单清晰的葡萄糖尿素液体培养基[28]。取尿素1 g,葡萄糖50 g,酵母膏0.5 g,硫酸铵1.0 g,磷酸氢二钠0.5 g,蒸馏水1.5 L,121℃灭菌30 min,并将pH调整至4.5左右。
1.2 方法 1.2.1 单因素试验设计配制葡萄糖尿素培养基,调整pH为4.5。然后分别加入浓度5 000 mg/L的U、Mn、As元素母液,最终配制成U、Mn和As的初始浓度为0 mg/L、25 mg/L、50 mg/L、75 mg/L和100 mg/L,pH为4.5的澄清培养基。分装培养基于250 mL锥形瓶中,每浓度设置5个平行对照,并加入吸光度(OD)为1.0的新制地衣芽孢杆菌活化菌液5 mL。置于150 r/min的恒温震荡培养箱中培养120 h。定时取样,并用Thermo Multiskan酶标仪于600 nm处测量,绘制生长曲线;然后10 000 r/min离心10 min,测定上清液中U、Mn和As的浓度,并将沉淀烘干,称量菌体质量,计算微生物对U、Mn和As的吸附率或吸附量。重金属吸附率按如下公式计算[29]:

其中,q为吸附量(mg/g);Co为U/Mn/As溶液的初始浓度(mg/L);C为微生物吸附后的平衡浓度(mg/L);V为溶液体积(L);M为微生物质量(g)。
1.2.2 多因素实验设计实验采用为二次正交旋转组合设计,设置U(X1)、Mn(X2)、As(X3)三个因素,各因素水平值如表 1所示。
根据表 2配制各组重金属溶液,按表 1设计的水平向各培养基中加入乙酸双氧铀溶液、乙酸锰溶液及亚砷酸钠溶液,且每瓶均加入OD值为1.0的新制菌悬液5 mL,在30℃,150 r/min摇床中培养72 h。每组取20 mL培养液在10 000 r/min下离心10 min。取上清,过0.45 μm针头过滤器,测定剩余U、Mn、As的浓度。
本实验中U元素使用安捷伦7 700x电感耦合等离子体串联质谱仪进行测定[30],Mn元素使用日立Z-2000原子吸收光谱仪测定[31],As元素使用普析PF6非色散原子荧光光度计测定[32]。不同元素检出限如表 3所示。
数据均采用DPS 7.5软件进行分析,采用Tukey多重比较法。应用Origin 8.5软件作图。
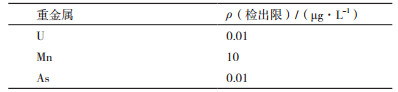
2 结果 2.1 单因素实验及分析 2.1.1 地衣芽孢杆菌对U的富集如图 1所示,地衣芽孢杆菌可在0-100 mg/L的U浓度下可生长,地衣芽孢杆菌在含U培养基中生长的前12 h,不同浓度下的细菌生长趋势与对照组相当,在细菌生长达到稳定期后,75 mg/L、100 mg/L浓度下表现出对菌体生长的抑制作用,菌体数量分别低于对照组14.58%和31.25%,差异极显著(P<0.01)。
|
| 图 1 U对地衣芽孢杆菌生长的影响 |
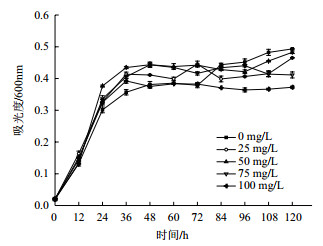
由图 2可以看出,铀酰离子(UO22+)初始浓度与地衣芽孢杆菌对UO22+的吸附率呈负相关,与吸附量呈正相关。当UO22+初始浓度为25 mg/L时,吸附率到达87%,吸附量为25.1 mg/g;UO22+初始浓度100 mg/L时吸附率达到77.89%,吸附量为243 mg/g。吸附量的大幅上升证明菌体上有大量UO22+的吸附位点,U浓度较低时菌体对U的吸附不饱和。吸附率的下降则提示UO22+的升高会抑制地衣芽孢杆菌的生长,这与图 1相符,同时,UO22+吸附量的上升使吸附更接近饱和,减弱了菌体对U的吸附作用。
|
| 图 2 地衣芽孢杆菌对U的吸附率及吸附量 |
图 3是在0 mg/L和100 mg/L的UO22+条件下培养的地衣芽孢杆菌的红外谱图。由图可知,加入U的菌体上羟基、羰基特征峰出现偏移,同时有新的特征峰出现。其中N-H的弯曲振动与C-N伸展振动的叠加在1 540 cm-1、1 654 cm-1处,此两峰提示着酰胺键的存在;1455 cm-1、1 396 cm-1处吸收峰与C-H(-CH3)的弯曲振动有关,提示含-CH3的物质和菌体U的结合存在联系。吸收峰位于1 396 cm-1处与COO-基团有关。1 064 cm-1处为P-O-C以及C-N(胺基)伸缩振动的吸收峰,可能是含磷化合物的峰位;菌体积累U后,位于1 232 cm-1处的吸收峰消失,该特征峰可能是P = O和C-S的伸缩振动或C-O与O-H的叠加吸收峰,提示U可能累积也与含磷化合物有关。在909.56 cm-1处出现的为UO22+的吸收特征峰。

|
| 图 3 在0 mg/L和100 mg/L的UO22+条件下培养的地衣芽孢杆菌红外谱图 |
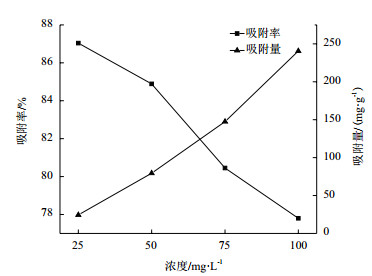
如图 4,在不同浓度Mn培养下的地衣芽孢杆菌在前36 h生长状况相当;36 h之后,25-100 mg/L Mn处理的细菌其数量均低于对照组(P<0.01),表现出Mn对其生长的胁迫,在120 h时,25 mg/L组细菌数量低于对照18.18%,差异极显著;0 mg/L组细菌数量低于对照27.27%,差异极显著;75 mg/L组菌数低于对照25.97%,差异极显著;100 mg/L组菌数低于对照29.87%,差异极显著。
|
| 图 4 Mn对地衣芽孢杆菌生长的影响及地衣芽孢杆菌对Mn的吸附率 |
地衣芽孢杆菌在25 mg/L、50 mg/L、75 mg/L和100 mg/L下吸附率均随菌体数量的上升而上升,在菌体数量稳定后逐渐趋于稳定,浓度于100 mg/L处理下出现了明显的脱附现象;地衣芽孢杆菌对Mn的吸附率随浓度变化呈递减趋势,在25 mg/L在96 h时达到最高为80.44%。
图 5是在0 mg/L和100 mg/L的Mn浓度条件下培养的地衣芽孢杆菌的红外谱图。可以看到各峰值变化不大,3 303 cm-1、1 654 cm-1处也向低波数移动,提示Mn可能会与U竞争胺基及蛋白质的固定位点,同时,1 064 cm-1处峰值变化不大,即Mn不会影响U与菌体上的含磷化合物结合。同时,2 360 cm-1处的峰消失。

|
| 图 5 在0 mg/L和100 mg/L Mn2+条件下培养的地衣芽孢杆菌红外光谱图 |
砷胁迫下地衣芽孢杆菌的生长曲线如图 6所示。前12 h内各浓度的As对细菌数量增加的影响均较小,菌体数量均接近对照,在12 h之后As胁迫体现较明显,菌体数量随浓度的提高而减少,且As浓度大于50 mg/L对菌体数量增加的影响更大。120 h时50 mg/L组菌体数相较于对照减少24.29%,75 mg/L组菌体数较于对照减少30.71%,100 mg/L组较对照减少26.61%,差异均极显著(P<0.01)。
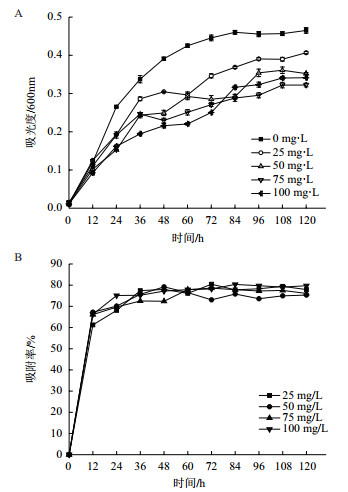
|
| 图 6 As对地衣芽孢杆菌生长的影响及地衣芽孢杆菌对As的吸附率 |
地衣芽孢杆菌对As的吸附率随浓度变化呈先下降后升高的趋势,如图 6所示,25 mg/L处理在108 h时吸附率最高达到79.44%;在120 h时,50 mg/L处理为75.31%,75 mg/L处理为76.11%,100 mg/L时达到79.73%。
图 7是在0 mg/L和100 mg/L的As条件下培养地衣芽孢杆菌的红外谱图。可知其变化主要也是3 303 cm-1、1 604 cm-1处也向低波数移动,以及2 360 cm-1峰的消失,推测其影响大致与Mn相同。
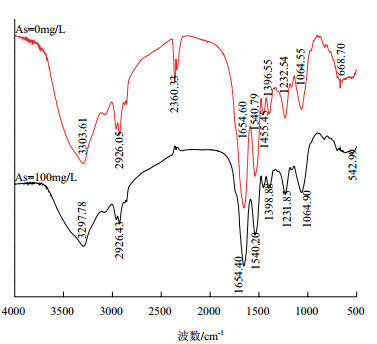
|
| 图 7 在0 mg/L和100 mg/LAs条件下培养的地衣芽孢杆菌红外光谱图 |
采用DPS软件中三元二次正交旋转组合设计方法,得到复合污染下地衣芽孢杆菌对U的吸附率与各因子之间的回归方程为:
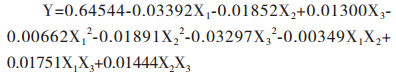
α=0.10显著性检验,简化回归方程:
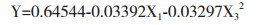
结果表明,对地衣芽孢杆菌U吸附率有显著影响的一次项因子是X1(U),有显著影响的二次项因子是X3(As)。
2.2.2 偏相关系数检验对地衣芽孢杆菌U吸附率的偏相关系数进行显著性检验,结果(表 4)表明,各因子与地衣芽孢杆菌U吸附率的相关性表现为:一次项中,X1(U)、X2(Mn)呈现为负相关,X3(As)呈现为正相关;二次项中,X1(U)、X2(Mn)呈现为负相关,X3(As)呈现为极显著负相关;交互项中,X1X2(U与Mn)呈现负相关,X1X3(U与Mn)、X2X3(Mn与As)呈现为正相关。可见U与Mn浓度对地衣芽孢杆菌U吸附率呈抑制作用,As浓度呈促进作用。
对原始回归方程采用“降维法”,得到各因子对地衣芽孢杆菌U富集的偏回归方程为:
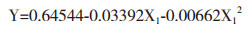
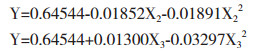
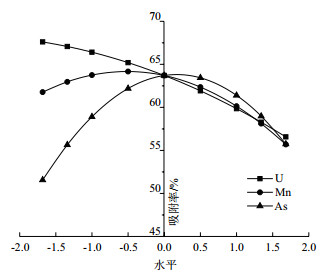
根据子方程绘制地衣芽孢杆菌U吸附率随各因子的变化趋势图。由图 8可知,地衣芽孢杆菌U吸附率与U浓度呈负相关,随U浓度的升高而降低;在Mn浓度低于40 mg/L时对U的富集呈促进作用,而在Mn浓度大于60 mg/L时呈现抑制作用,As浓度在60 mg/L以下时可以促进地衣芽孢杆菌对U的富集,而高于60 mg/L时则体现出对U吸附的抑制。
|
| 图 8 复合污染下各因子对地衣芽孢杆菌U吸附率的影响 |
地衣芽孢杆菌对U与镉有着相似的吸附趋势,红外分析显示,U与菌体的结合与含磷化合物及蛋白等含羧基甲基等的有机物有关,反映出地衣芽孢杆菌对铀的吸附主要与细胞膜及细胞壁有关。生物膜外有许多能吸附金属离子和有机物的位点,如芳香烃、脂肪族氨基酸形成的蛋白质中的疏水区,与重金属之间有较高的结合量和结合强度[33-34]。同时,存在于细胞外的胞外多聚物(EPS),特别是溶解性EPS,对重金属的结合能力更强[35],这与EPS上的羟基、磷酸基、巯基、酚羟基等官能团有关[36]。有研究表明地衣芽孢杆菌对Cd2+的富集是通过胞外各功能团及表面分泌物实现的[37]。司慧等[28]认为芽孢杆菌对U的吸附首先发生于细胞壁上,而后随着菌体代谢活动等向胞内部转移,并在胞内积累。
地衣芽孢杆菌对Mn的吸附趋势变化与黄荣[29]的研究相同。Mn、As对地衣芽孢杆菌富集U的影响可能是多方面的,首先,AsO2-形式存在的As元素不会竞争细胞表面的负电性基团,胡恋等[38]认为阳离子与UO22+竞争细胞表面有限的负电性基团导致菌体对U的富集量降低,这与多因素实验中低浓度AsO2-促进U的富集,而中等浓度以上的Mn离子抑制U的富集相符。低浓度Mn促进U的吸收可能是因为Mn作为生命所需的微量元素对细菌生长影响较小,这与Mn对地衣芽孢杆菌影响的生长曲线相符。因此在U矿的微生物修复或微生物减容中应考虑联合Mn还原菌剂及As富集菌剂[39]共同使用。其次,生长曲线显示U、Mn、As对细菌生长有抑制作用。最后,结合红外进行分析,在加入U后,3 303 cm-1、1 064 cm-1等向低波数偏移,表明菌体对UO22+的吸附位点有胺基及菌体蛋白质等位点[40]。1 064 cm-1向低波数移动,且峰值变高,证明U与菌体上磷脂等含磷化合物结合,并累积起来[38, 41-43]。值得注意的是,2 926 cm-1处的-CH2-峰值变小,而2 360 cm-1的碳碳三键或连续双键处峰明显升高,可能是U与三键或连续双键化合物结合,使其含量升高。与此对应的是,Mn与As处理的菌体在2 360 cm -1的峰均消失不见,提示Mn与As使菌体内三键或连续双键化合物含量较降低,而此过程可能会降低菌体对U的吸附,菌体内三键或连续双键化合物结果与反应机理有待进一步研究。
4 结论高于75 mg/L U、25 mg/L Mn或25 mg/L As对地衣芽孢杆菌的生长存在着抑制作用;其中U与As对生长的影响表现在延长了迟滞期,可能是其毒性影响了细胞代谢;而Mn对生长的影响体现在对数期,可能是影响了菌体的分裂。
地衣芽孢杆菌对在U、Mn和As有较好的富集作用。单因素时,最高可以吸附培养基中87%的U、80.44%的Mn,或79.73%的As。
Mn、As均在低浓度时促进地衣芽孢杆菌对U的吸附,高浓度时则表现出抑制。Mn浓度低于40 mg/L或As浓度低于60 mg/L可以促进菌体对U的吸附;反之当Mn或As浓度高于60 mg/L则抑制菌体对U的吸附。
| [1] |
Sud D, Mahajan G, Kaur MP. Agricultural waste material as potential adsorbent for sequestering heavy metal ions from aqueous solutions-A review[J]. Bioresour Technol, 2008, 14: 6017-6027. |
| [2] |
Alessi, Daniel S., Lezama-Pacheco, et al. The product of microbial uranium reduction includes multiple species with U(Ⅳ)- phosphate coordination[J]. Geochim Cosmochim Acta, 2014, 131: 115-127. DOI:10.1016/j.gca.2014.01.005 |
| [3] |
王泽煌, 王蒙, 蔡昆争, 等. 细菌对重金属吸附和解毒机制的研究进展[J]. 生物技术通报, 2016(12): 13-18. |
| [4] |
刘明学. 微生物与锶铀相互作用及其机理研究[D]. 成都: 电子科技大学, 2011: 6-8.
|
| [5] |
Wang JS, Hu XJ, Liu YG, et al. Biosorption of uranium (Ⅵ) by immobilized Aspergillus fumigatus beads[J]. Journal of Environmental Radioactivity, 2010, 101: 504-508. DOI:10.1016/j.jenvrad.2010.03.002 |
| [6] |
夏立江, 华珞, 李向东. 重金属污染生物修复机制及研究进展[J]. 核农学报, 1998(1): 60-65. |
| [7] |
柏云, 张静, 冯易君. 生物吸附法处理含铀废水研究进展[J]. 四川环境, 2003, 22(2): 9-13, 16. |
| [8] |
刘文娟, 徐伟昌, 王宝娥. 两种酵母菌吸附铀的对比研究[J]. 南华大学学报:自然科学版, 2003, 17(4): 68-71, 16. |
| [9] |
周小娇. 啤酒酵母对放射性元素铀的吸附机理研究[D]. 兰州: 兰州大学, 2014: 12-18.
|
| [10] |
Lovely DR, Phillips EJP, Gorby YA, et al. Microbial reduction of Uranium[J]. Nature, 1991, 350: 413-416. DOI:10.1038/350413a0 |
| [11] |
Xie S, Yang J, Chen C, et al. Study on biosorption kinetics and thermodynamics of uranium by Citrobacter freudii[J]. Journal of Environmental Radioactivity, 2008, 99(1): 126-133. DOI:10.1016/j.jenvrad.2007.07.003 |
| [12] |
Tawfik Z, Abu-Shady M, Haytham M. Uranium uptake by some locally isolated and some reference bacterial species[J]. Acta Pharm, 2005, 55(1): 93-105. |
| [13] |
杨杰, 董发勤, 代群威, 等. 耐辐射奇球菌对放射性核素铀的吸附行为研究[J]. 光谱学与光谱分析, 2015(4): 1010-1014. |
| [14] |
Vogel M, Gunther A, Rossberg A, et al. Biosorption of U (Ⅵ) by the green algae Chlorella vulgaris in dependence of pH value and cell activit[J]. Sci Total Environ, 2010, 409: 384-395. DOI:10.1016/j.scitotenv.2010.10.011 |
| [15] |
刘明学, 董发勤, 李琼芳, 等. 培养条件下酵母菌吸附铀的研究[J]. 环境科学与技术, 2009, 32(5): 31-34. |
| [16] |
Liu MX, Dong FQ, Yan X, et al. Biosorption of uranium by Saccharmyces cerevisiae and surface interactions under culture conditions[J]. Bioresource Technolgy, 2010, 101: 8573-8580. DOI:10.1016/j.biortech.2010.06.063 |
| [17] |
Toshihiko O, Takahiro Y, et al. Interactions of uranium with bacteria and kaolinite clay[J]. Chemical Geology, 2005, 220(3/4): 237-243. |
| [18] |
Jiang MY, Ohnuki T, Tanaka K, et al. Post-adsorption process of Yb phosphate nano-particle formation by Saccharomyces cerevisiae[J]. Geochimica et Cosmochimica Acta, 2012, 93: 30-46. DOI:10.1016/j.gca.2012.06.016 |
| [19] |
Acharya C, andwadkar P, Apte SK. Interaction of uranium with a filamentous, heterocystous, nitrogen-fixing cyanobacterium Anabaena torulosa[J]. Bioresour Technol, 2012, 116: 290-294. DOI:10.1016/j.biortech.2012.03.068 |
| [20] |
Rashmi V, Shylajanaciyar M, Rajalakshmi R, et al. Siderophore mediated uranium sequestration by marine cyanobacterium Synechococcus elongatus BDU 130911[J]. Bioresource Technolgy, 2013, 130: 204-210. DOI:10.1016/j.biortech.2012.12.016 |
| [21] |
Khani MH, Keshtkar AR, Ghannadi M, et al. study of the biosorption of uranium onto Cystoseria indica algae[J]. Journal of Hazardous Materials, 2008, 150(3): 612-618. DOI:10.1016/j.jhazmat.2007.05.010 |
| [22] |
马尧, 胡宝群, 孙占学. 浅论铀矿山的三废污染及治理方法[J]. 铀矿冶, 2007, 26(1): 35-39. |
| [23] |
胡恋, 谢水波, 张晓健, 等. 微生物吸附处理低浓度含铀废水的效能[J]. 安全与环境学报, 2007(2): 57-60. |
| [24] |
刘雨芳, 许中坚, 刘文海, 等. 铀尾矿库中重金属元素的生态迁移风险研究[J]. 水土保持学报, 2009, 23(2): 153-156. |
| [25] |
徐磊, 钱建平, 唐专武. 我国铀矿废渣石污染特点及治理方法[J]. 中国矿业, 2013, 22(1): 61-64. |
| [26] |
潘英杰. 我国铀矿冶设施退役环境治理现状及应采取的对策[J]. 铀矿冶, 1997, 16(4): 227-236. |
| [27] |
Georgiev P, Groudev S, Spasova I, et al. Ecotoxicological characteristic of a soil polluted by radioactive elements and heavy metals before and after its bioremediation[J]. Journal of Geochemical Exploration, 2014, 142: 122-129. DOI:10.1016/j.gexplo.2014.02.024 |
| [28] |
司慧, 罗学刚, 望子龙, 等. 枯草芽孢杆菌对铀的富集及机理研究[J]. 中国农学通报, 2017, 33(8): 31-38. |
| [29] |
黄荣, 聂小琴, 董发勤, 等. 枯草芽孢杆菌与水体中U(Ⅵ)的作用机制[J]. 化工学报, 2015, 66(2): 764-772. DOI:10.11949/j.issn.0438-1157.20141082 |
| [30] |
唐永金, 曾峰, 罗学刚. 施用微量元素对菊苣修复铀污染土壤的影响[J]. 核农学报, 2016, 30(10): 2012-2019. DOI:10.11869/j.issn.100-8551.2016.10.2012 |
| [31] |
邱佩丽, 彭名军, 丁怡, 等. 质量控制图在原子吸收光谱锰测定中的应用[J]. 酿酒科技, 2011(12): 76-78. |
| [32] |
邹强, 刘芳, 龚世龙, 等. 土壤总砷测定前处理方法探讨[J]. 土壤通报, 2011(6): 1341-1344. |
| [33] |
Zhang D, Wang J, Pan X. Cadmium sorption by EPSs produced by anaerobic sludge under sulfate-reducing conditions[J]. Journal of Hazardous Materials, 2006, 138(3): 589-593. DOI:10.1016/j.jhazmat.2006.05.092 |
| [34] |
Moon SH, Park CS, Kim YJ, et al. Biosorption isotherms of Pb(Ⅱ)and Zn(Ⅱ)on Pestan, an extracellular polysaccharide, of Pestalotiopsis sp. KCTC 8637P[J]. Process Biochemistry, 2006, 41(2): 312-316. DOI:10.1016/j.procbio.2005.07.013 |
| [35] |
Pan X, Liu J, Zhang D, et al. Binding of dicamba to soluble and bound extracellular polymeric substances(EPS)from aerobic activated sludge:A fluorescence quenching study[J]. Journal of Colloid and Interface Science, 2010, 345(2): 442-447. DOI:10.1016/j.jcis.2010.02.011 |
| [36] |
Bhaskar PV, Bhosle NB. Bacterial extracellular polymeric substance(EPS):a carrier ofheavy metals in the marine food-chain[J]. Environment International, 2006, 32(2): 191-198. DOI:10.1016/j.envint.2005.08.010 |
| [37] |
孙静, 李晔, 刘联国, 等. 地衣芽孢杆菌富集镉的特性及机理研究[J]. 核农学报, 2013, 27(11): 1644-1651. DOI:10.11869/hnxb.2013.11.1644 |
| [38] |
胡恋. 枯草芽孢杆菌对低浓度含铀废水中铀的吸附试验研究[D]. 衡阳: 南华大学, 2008.
|
| [39] |
邓博環, 许丽英, 王玉龙, 等. 一株芽孢杆菌对含砷矿物中砷的还原作用[J]. 生态学杂志, 2016, 35(12): 3374-3381. |
| [40] |
邓芹英, 刘岚, 邓慧敏. 波谱分析教程[M]. 第2版. 北京: 科学出版社, 2008.
|
| [41] |
Salome KR, Green SJ, Beazley MJ, et al. The role of anaerobic respiration in the immobilization of uranium through biomineralization of phosphate minerals[J]. Geochim Cosmochim, Acta, 2013, 106: 344-363. DOI:10.1016/j.gca.2012.12.037 |
| [42] |
Bargar JR, Williams KH, Campbell KM, et al. Uranium redox transition pathways in acetate-amended sediments[J]. Proc Natl Acad Sci USA, 2013, 110: 4506-4511. DOI:10.1073/pnas.1219198110 |
| [43] |
张东升, 王震, 毛东东, 等. 芽孢杆菌L15菌株发酵培养条件的优化[J]. 大连海洋大学学报, 2016, 31(3): 261-265. |