2. 陕西理工大学陕西省食药用菌工程技术研究中心,汉中 723001;
3. 陕西省汉中市公安局,汉中 723000
2. Shaanxi Sci-Tech University, Shaanxi Provincial Engineering Research Center of Edible and Medicinal Microbes, Hanzhong 723001;
3. Hanzhong Public Security Bureau, Shaanxi, Hanzhong 723000
随着机油在工业及日常生活中的广泛应用,其污染已成为人类越来越重视的问题,机油污染不仅对环境造成极大破坏,也很大程度的对人类健康造成危害[1-2]。而解决机油污染问题研究最多的是通过一系列物理及化学方法,但存在着二次污染、成本较高等诸多问题。随之兴起了一种高效、经济和生态可承受的绿色清洁技术——生物修复技术,其主要包括3大类,植物修复技术、微生物修复技术及植物与微生物联合修复技术[3-7]。植物修复技术对机油降解能力强,但植物的生长周期较长,修复效率慢,无法直接快速的分解机油,微生物修复技术不仅能很好的解决此类问题,且存在着广谱、高效、稳定、适应性强等诸多优点,同时有些菌株能很好的适应强酸强碱等极端环境,这些是植物达不到的,所以利用微生物降解机油已成为机油污染土壤治理及环境保护的研究热点[8-10]。
自然界中存在着许多能以机油及其产品为碳源和能源的土著微生物,目前已经发现能降解机油的微生物有200多种,其中细菌、放线菌、真菌等微生物均可使机油中的烃类化合物得到降解。降解机油中的烃类化合物的细菌主要有:嗜麦芽窄食单胞菌(Stenotrophomonas sp.)、微杆菌属(Microbacterium sp.)、苍白杆菌属(Ochrobactrum sp.)、假单胞菌属(Pseudomonas sp.)等,其中假单胞菌对于污染土壤中机油中烃类物质降解治理研究较多,它对烷烃及芳香烃类均具有较好的降解作用。降解机油中烃类化合物的放线菌中主要有:分支杆菌属(Mycobacterium sp.)、诺卡氏菌属(Nocardia sp.)、放线菌属(Actinomycetes sp.)等,其中研究较多的是诺卡氏菌属。降解机油中烃类化合物的真菌主要有:金色担子菌(Aureobasidium sp.)、假丝酵母属(Candida sp.)、红酵母属(Rhodotorula sp.)等,其中研究最多的是假丝酵母,因为它营养要求低,生长繁殖快且降解效果显著[11-15]。通过从自然生态环境或受机油污染的环境中筛选高效机油降解菌,并用于机油污染土壤及废水的生物处理,已经成为机油污染环境生物处理技术的重要内容之一[16-20]。
本研究以20#机油和真空泵油为唯一碳源,土壤样品采于汉中某工具厂的污水处理车间内部活性污泥,由于该土壤环境长期受各种机油类物质的污染,大大增加了土壤环境中机油降解菌的存在。从中分离筛选出机油降解菌,利用紫外分光光度仪测定各菌株机油降解率,筛选出机油高效降解菌,经细菌形态学、生理生化及16S rRNA序列分析对机油高效降解菌株进行鉴定,采用紫外分光光度仪和气相色谱质谱联用仪(GC-MS)研究菌株降解特性。本研究旨在为机油污染治理及环境生物修复提供新的菌种资源,以期为机油污染土壤的治理及生态修复提供参考。
1 材料与方法 1.1 材料 1.1.1 主要培养基及其配置牛肉膏蛋白胨培养基:牛肉膏3.0 g,蛋白胨10.0 g,氯化钠5.0 g,加水定容至1 L,120℃,1×105 Pa灭菌30 min。固体培养基中加琼脂18.0 g。
MSM培养基(基础培养基):硫酸铵2.0 g,硫酸镁0.5 g,磷酸氢二钾1.0 g,磷酸二氢钾1.0 g,氯化钠4.0 g,氯化钙0.02 g,微量元素母液1.0 mL,加水定容至1 L,120℃,1×105 Pa灭菌30 min,固体培养基中加琼脂18.0 g。微量元素母液配置:水100.0 mL,氯化铁1.2 g,氯化铜0.3 g,氯化锌0.3 g,氯化钴0.1 g,硫酸锰0.3 g,钼酸铵0.1 g。本试验用机油:等体积20#机油和真空泵油混合。
1.1.2 主要仪器及设备净化工作台(SW-CJ-2FD,苏州净化设备有限公司),电热恒温培养箱(DHP-9162,上海慧泰仪器制造有限公司),高压蒸汽灭菌器(ML-3751L-PC,日本制造),电热恒温干燥箱(101-1AS),K960热循环仪(杭州晶格科学仪器有限公司),PCR扩增仪(英国TECHEN),电泳仪(Bio-Rad),移液器(Eppendorf),4802S紫外分光光度计(龙尼科上海仪器有限公司),GC-MS气质联用仪(Thermo-H2GAJD,美国赛默飞世尔科技公司)。
1.2 方法 1.2.1 机油高效降解菌株的分离、筛选及鉴定 1.2.1.1 机油高效降解菌株的分离和筛选将污染样品接种到含机油1.0 g/L的MSM液体培养基上,30℃,160 r/min培养7 d,富集培养3次,富集培养后的菌悬液涂布于含机油1.0 g/L的MSM固体培养基,选择具有透明圈且形状不同的菌株多次在牛肉膏蛋白胨培养基上划线,纯化培养,将纯化后菌株重新转接到含机油1.0 g/L的MSM液体培养基中,将能使培养基变混浊的菌株进行甘油保藏。
将初步筛选出能以机油为唯一碳源生长的机油降解菌进行机油高效降解菌的复筛。采用紫外分光光度法测定机油的含量[21-22],挑取纯化后的菌株转接入含机油2.0 g/L的100 mL MSM液体培养基中,30℃,160 r/min培养7 d,以石油醚萃取并定容置50 mL容量瓶[23-24]。经预实验结果,在紫外分光光度计235 nm处测其吸光度。机油降解率的计算公式如下:
降解率(%)=(A-B)/A×100%
其中,A为空白对照品吸光度值,B为样品吸光度值。
1.2.1.2 机油高效降解菌株的鉴定形态特征观察:将纯化后的菌株单菌落接种在牛肉膏蛋白胨固体平板上划线,37℃恒温培养2 d,期间观察其生长情况,菌落形态,显微镜下观察菌体形态(包括菌体特殊结构芽孢、鞭毛等),以及革兰氏染色特性。
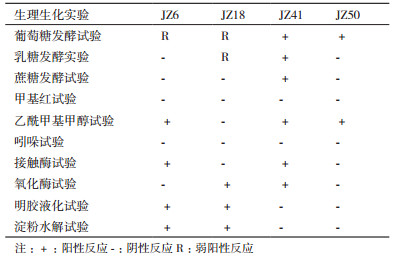
生理生化特征分析:利用氧化酶活性、吲哚试验、甲基红反应、乙酰甲基甲醇试验、糖类发酵试验、接触酶试验、硫化氢产生试验、明胶液化试验、淀粉水解试验等实验对菌株进行生理生化特性分析[9, 25-26]。
16S rRNA基因序列分析:菌株DNA提取参见细菌基因组DNA提取试剂盒(天根)。
采用细菌16S rRNA通用引物27F:5' -AGA GTT TGA TCC TGG CTC AG-3'和1492R:5' -GGT TAC CTT GTT ACG ACT T-3'对所提DNA进行16S rRNA扩增。PCR反应体系50 μL:2 × Taq Master Mix 0.25 μL,上下引物(10 µmol/L)各2 μL,模板DNA 1 μL(浓度10 ng/µL),10 × Buffer 5 μL,10 mmol/L dNTP 5 μL,dd H2O补齐至50 μL。反应条件:94℃预变性2 min;94℃ 30 s,55℃退火30 s,72℃ 1 min,32个循环;72℃延伸2 min,4℃保存。PCR产物电泳检测后送上海生工生物技术有限公司进行正、反双向测序,再于NCBI进行序列比对,确定属种,并获取GenBank号。利用MEGA 6.0,按照邻接法(Neighbor-joining)法聚类,选择1 000个重复做Bootstrap值分析,构建系统发育树。
1.2.2 机油高效降解菌株降解特性的研究 1.2.2.1 培养时间对菌株机油降解率的影响将待测菌株分别接种至pH为7.4含机油2.0 g/L的MSM液体培养基中,在30℃,转速160 r/min的恒温振荡器中分别培养1 d、2 d、3 d、4 d、5 d、6 d、7 d、8 d和9 d,定时取样,测定机油的残留浓度,观察不同培养时间下不同菌株机油降解率。
1.2.2.2 温度对菌株机油降解率的影响将待测菌株接种至初始pH为7.4的机油浓度为2.0 g/L的液体MSM培养基中,分别置于20、25、28、30、35和40℃恒温振荡器中,以转速160 r/min避光振荡培养7 d,定时取样,测定机油的残留浓度,观察不同温度下不同菌株的机油降解率[25]。
1.2.2.3 pH对菌株机油降解率的影响待测菌株接种至用1 mol/L的HCl或NaOH调好pH(5.0、6.0、7.0、7.5、8.0、9.0)的机油浓度为2.0 g/L的液体MSM培养基中,在30℃下以转速160 r/min避光振荡培养7 d,定时取样,测定机油的残留浓度,观察不同pH下不同菌株的机油降解率[26]。
1.2.2.4 机油高效降解菌株在不同机油组分中的生长特性将待测菌株接种至牛肉膏蛋白胨液体培养基,于30℃,160 r/min振荡培养2 d,12 000 r/min离心2 min,收集菌体,用生理盐水冲洗两遍后加入100 μL无菌水重悬,分别接种于单一组分的十二烷、十六烷、十八烷、二十二烷、苯、萘、芘和菲为唯一碳源的MSM培养基中,30℃,160 r/min培养5 d,取样稀释、涂平板计数,计算在不同机油组分中细菌生长数,每组3个平行,并作不加任何机油组分的MSM培养基培养细菌的空白对照。
1.2.2.5 机油高效降解菌株降解特性研究用GC-MS方法分析降解机油的残油组分。先用正己烷萃取和溶解降解后残油组分,萃取方法与1.2.1利用石油醚萃取机油的方法相同。用顶空进样器进样,DB-5MS毛细管柱30 m×0.25 mm×0.25 μm,柱温50℃,维持3 min后以15℃/min的速率升到120℃,再以8℃/min升温速率升到260℃,然后在该温度保持25 min,载气氦气,柱流量1 mL/min,分流比10: 1,进样口温度250℃,传输线温度260℃,离子源温度250℃,EI源,电离电压70 eV,扫描范围35-650 amu[27-30]。
2 结果 2.1 机油高效降解菌株的分离、筛选分离出54株均能以机油为唯一碳源生长,编号JZ1-JZ54,筛选出其中降解圈较明显且菌落形态不同的22株菌株。对初筛的22个菌株进行机油降解能力的复筛,计算各菌株的机油降解率,结果见表 1。由表 1可见,初筛的22个菌株都对机油具有一定的降解作用,但不同菌株对机油的降解能力明显不同,降解率最高的达到42.62%,最低的只有5.52%。其中JZ6、JZ18、JZ41和JZ50这4株菌的机油降解率超过30%,并且由多重比较结果可见,菌株JZ6、JZ18、JZ41和JZ50与其他菌株的机油降解率具有极显著差异(P<0.01),因此选取这4株机油高效降解菌株做进一步鉴定。
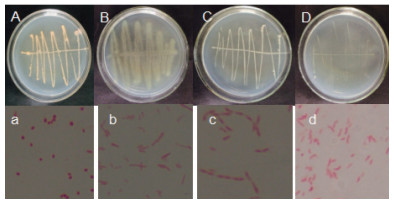
对机油高效降解菌株进行形态特征观察(图 1),4株菌株的菌落颜色,形态,菌体形态等都存在差异。其中JZ6菌落颜色为淡橘黄色,菌体形态呈球形,有芽孢,着生于细胞中央,无鞭毛,JZ18菌落颜色为淡黄色,菌体形态呈链状,无芽孢,极生鞭毛。JZ41菌落颜色为白色,菌体形态呈杆状,有芽孢,着生于细胞末端,周生鞭毛。JZ50菌落颜色为白色,菌体形态呈链状,无芽孢,极生鞭毛,4株菌株均为革兰氏阴性菌。
|
| 图 1 菌株菌落形态及革兰氏染色 A、a:JZ6的菌落形态及革兰氏染色结果;B、b:JZ18的菌落形态及革兰氏染色结果;C、c:JZ41的菌落形态及革兰氏染色结果;D、d:JZ50的菌落形态及革兰氏染色结果 |
机油高效降解菌株菌株生理生化试验结果,见表 2。
对机油高效降解菌进行16S rRNA基因测定,序列分析表明,JZ6与Massilia sp.菌属序列相似性为97%,JZ18与假单胞菌属(Pseudomonas sp.)序列相似性为99%,JZ41与鞘氨醇杆菌属(Sphingobacterium sp.)序列相似性为98%,JZ50与Shinella zoogloeoides sp.菌属序列相似性为98%。4株机油高效降解菌与亲缘相近菌株16S rRNA序列的系统发育树,如图 2。

|
| 图 2 4株机油降解菌与亲缘相近菌株16 S rRNA序列的系统发育树 |
结合4株菌的形态学特征及生理生化试验,初步确定JZ6为Massilia sp.菌属,GenBank号为KY996847,JZ18为假单胞菌属(Pseudomonas sp.),GenBank号为KY996857,JZ41为鞘氨醇杆菌属(Sphingobacterium sp.),GenBank号为996866,JZ50为Shinella zoogloeoides sp.菌属,GenBank号为996862。
2.3 机油高效降解菌株降解特性的研究 2.3.1 培养时间对菌株机油降解力的影响测定培养时间对菌株机油降解力的影响,结果见图 3。在培养第9天时,菌株JZ6、JZ18,JZ41和JZ50机油降解率分别达到44.50%、34.57%,35.33%和40.20%。菌株JZ6,JZ50在1-5 d机油降解率增长较快,第5天后,机油降率增长较平缓,处于较稳定状态,菌株JZ18,JZ41在第7天机油降率增长较平缓,处于较稳定状态。该结果表明不同菌株最佳降解时间不一致,菌株培养时间要控制在一定范围(5-7 d),菌株机油降解率不仅能够达到最好效果,且株菌投入生产时,时间短,效益高。

|
| 图 3 培养时间对菌株机油降解率的影响 |
测定培养温度对菌株机油降解力的影响,结果见图 4。菌株JZ6在培养温度为35℃时,机油降解率达到最高43.01%,菌株JZ18,JZ41和JZ50在培养温度为30℃时,菌株机油降解率达到最高,分别为32.74%、32.48%和38.94%。该结果表明菌株培养温度要控制在一定范围内(30-35℃),机油降解率才能达到最好效果。并且由于土样最初富集培养的温度为30℃,所以4株菌株在30℃时都有较好的机油降解效果。

|
| 图 4 培养温度对菌株机油降解率的影响 |
测定培养基初始pH对菌株机油降解率的影响,结果见图 5。菌株JZ6、JZ18、JZ50的机油降解率在培养基初始pH 7.5时达到最大,分别为42.12%,34.73%,41.18%,菌株JZ41机油降解率在pH 7时达到最大值34.04,此外偏弱酸性或弱碱性的环境均不利于菌株的机油降解,要控制培养基的初始pH在7.0-7.5之间。

|
| 图 5 pH对菌株机油降解率的影响 |
菌株在不同机油组分中的生长特性结果,见表 3,4株菌株均能以十二烷、十六烷、十八烷及苯和萘为唯一碳源的培养基中生长,JZ6和JZ50还能在以芘和菲为唯一碳源的培养基中生长。
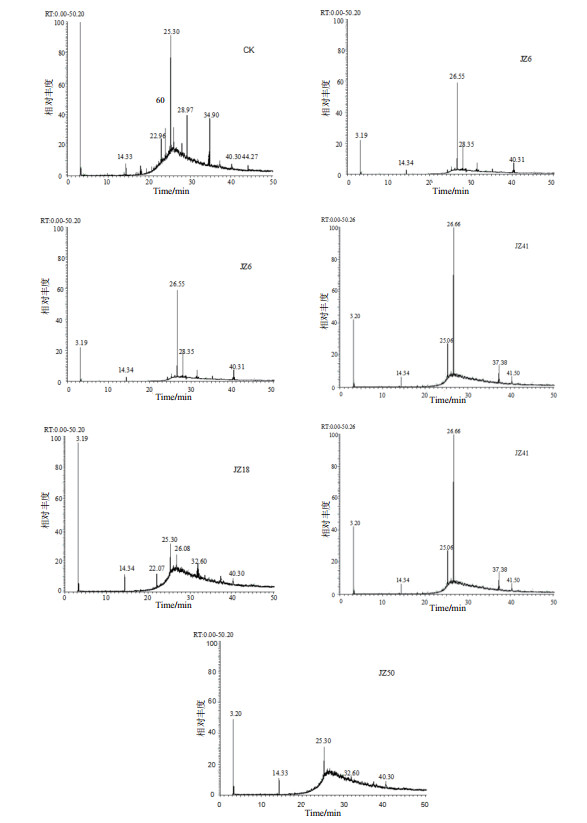
研究机油高效降解菌株对机油具体组分的降解,菌株接种于机油浓度为2.0 g/L的MSM培养基,振荡培养7 d,用正己烷萃取并溶解培养液中的机油残油组分进行GC-MS分析,结果见图 6。GC-MS分析机油残油组分,发现机油主要组分为直链烷烃;其次为支链烷烃和环烷烃,以及一定量的芳香烃和非烃类物质,其中的直链烷烃主要为正十二烷、十四烷、十五烷、二十烷、二十四烷、二十七烷、二十八烷及三十六烷,烷烃占原油总量59.89%.菌株JZ6、JZ18、JZ41和JZ50对总烷烃的降解率分别达到68.66%、52.69%、49.37%和61.40%,对直链烷烃的降解率分别为86.89%、55.98%、58.42%和89.13%,表明4株菌对烷烃具有很强的降解效果,对直链烷烃的降解作用尤为明显,对于中链、C16-C28长链烷烃都有较显著地降解作用,菌株JZ6和JZ50对除烷烃类的其他芳香烃类物质也有一定的降解作用。
|
| 图 6 菌株降解机油的GC-MS分析 |
随着石油开采及石油工业的发展,石油污染问题日趋严重,而机油作为石油非常重要的一个馏分,在机械制造、维修等行业被广泛应用,产生的大量含油废水不仅污染环境,同时也给人类及其他生物带来很大的危害。分离、驯化出高效的机油降解菌成为机油污染环境生物修复的一个重要的研究方向。目前,对于石油降解菌的研究较多,而对于机油降解菌的研究较少。Quatrini等[31]从机油污染地区中分离出几株能对十二烷、十五烷和十六烷等烷烃类物质具有很好的降解作用的红球菌属,但不能降解芳香烃类物质。Soudi等[32]从机油污染地区分离出一株对苯酚有很强的降解能力的菌株SKO-1,在含苯酚1.0 g/L的培养基中培养2 d后对苯酚降解率为99%以上,但对中长链烷烃及其他的芳香烃类物质的降解能力不明显。孙华庆等[33]从首钢焦化厂的污水处理系统中分离1株能降解吡啶的菌株BC026,经鉴定为Shinella zoogloeoides菌属,当吡啶浓度为1 800 mg/L,投菌量为0.06 g/L时,BC026可在46 h内将吡啶完全降解。苏莹等[34]从山东胜利油田的机油污染水体中分离出10株降解机油的细菌,培养6 d后,其中最高机油降解率为54.74%,其余菌株均在40%以下。本研究所获得的4株机油高效降解菌株JZ6、JZ18、JZ41和JZ50分别属于Massilia sp.、Pseudomona sp.、Sphingobacterium sp.和Shinella sp.,有关Pseudomona sp.属的降解菌中,Lin等[35]对菌株Pseudomona sp. P29的研究结果表明,菌株P29对短链烷烃有较好的降解效果,而本研究所筛选菌株JZ18对长链烷烃也有很好的降解效果。与孙华庆等[33]研究结果相比,本研究所筛得的菌株JZ50除能降解吡啶外,还能以十二烷、十六烷、十八烷、芘,菲及苯和萘为唯一碳源生长。有关Massilia sp.属的降解菌中,罗小艳等[25]对多环芳烃中菲具有很好的降解作用,48 h菲的降解率迗96.78%,而本研究所筛选菌株JZ6对多环芳烃中芘,菲,苯和萘都具有一定降解作用。
4 结论从长期受机油污染地区分离筛选出4株机油高效降解菌株,经鉴定4株菌株分别为Massilia sp.、Pseudomona sp.、Sphingobacterium sp.和Shinella zoogloeoides sp.,在含机油培养基中30℃培养7 d后,机油降解率分别为42.62%、33.67%、33.36%和40.52%。在温度20-40℃,pH5-9条件下菌株都具有降解机油的能力,4株菌株均能以十二烷、十六烷、十八烷及苯和萘为唯一碳源生长。GC-MS分析发现4株菌株对总烷烃的降解率分别达到68.66%、52.69%、49.37%和61.40%。4株菌株具有较强的机油降解能力,适应能力强,对于利用微生物治理机油污染环境具有潜在的应用前景。
| [1] |
冯晋阳. 石油烃优良降解菌的筛选分离及其降解性能的研究[D]. 西安: 西安建筑科技大学, 2004.
|
| [2] |
Maragkidou A, Arar S, Al-Hunaiti A, et al. Occupational health risk assessment and exposure to floor dust PAHs inside an educational building[J]. Sci Total Environ, 2016(16): 1492-1499. |
| [3] |
李颖. 石油污染土壤的生物修复[D]. 北京: 北京化工大学, 2008.
|
| [4] |
冯俊生, 张俏晨. 土壤原位修复技术研究与应用进展[J]. 生态环境学报, 2014, 23(11): 1861-1867. DOI:10.3969/j.issn.1674-5906.2014.11.021 |
| [5] |
Montenegro IP, Mucha AP, Reis I, et al. Effect of petroleum hydrocarbons in copper phytoremediation by a salt marsh plant(Juncus maritimus)and the role of autochthonous bioaugmentation[J]. Environ Sci Pollut Res Int, 2016, 23(19): 19471-1980. DOI:10.1007/s11356-016-7154-7 |
| [6] |
Ma J, Yang Y, Dai X, et al. Effects of adding bulking agent, inorganic nutrient and microbial inocula on biopile treatment for oil-field drilling waste[J]. Chemosphere, 2016, 150: 17-23. DOI:10.1016/j.chemosphere.2016.01.123 |
| [7] |
唐金花, 于春光, 张寒冰. 石油污染土壤微生物修复的研究进展[J]. 湖北农业科学, 2011, 50(20): 4125-4128. DOI:10.3969/j.issn.0439-8114.2011.20.006 |
| [8] |
李宝明. 石油污染土壤微生物修复的研究[D]. 北京: 中国农业科学院, 2007.
|
| [9] |
阮志勇. 石油降解菌株的筛选、鉴定及其石油降解特性的初步研究[D]. 北京: 中国农业科学院, 2006.
|
| [10] |
崔丽虹. 石油烃降解菌的筛选、鉴定及复合菌群降解效果的研究[D]. 北京: 中国农业科学院, 2009.
|
| [11] |
秦芳玲, 曹丽娟, 燕永利, 等. 几株机油降解菌及其处理含油废水的效果[J]. 油田化学, 2007, 24(3): 269-271. |
| [12] |
辛蕴甜. 石油降解菌的降解性能、固定化及降解动力学研究[D]. 上海: 东华大学, 2013.
|
| [13] |
Chen M, Xu P, Zeng G, et al. Bioremediation of soils contaminated with polycyclic aromatic hydrocarbons, petroleum, pesticides, chlorophenols and heavy metals by composting:Applications, microbes and future research needs[J]. Biotechnol Adv, 2015, 33(6): 45-55. |
| [14] |
Ameen F, Hadi S, Moslem M, et al. Biodegradation of engine oil by fungi from mangrove habitat[J]. J Gen Appl Microbiol, 2015, 61(5): 85-92. |
| [15] |
邓绍云, 徐学义, 邱清华. 我国石油污染土壤修复研究现状与展望[J]. 北方园艺, 2012(4): 184-190. |
| [16] |
赵硕伟, 沈嘉澍, 沈标. 复合菌群的构建及其对石油污染土壤修复的研究[J]. 农业环境科学学报, 2011, 30(8): 1567-1572. |
| [17] |
张秀霞, 徐娜娜, 秦丽姣. 固定化微生物降解石油的影响因素研究[J]. 安全与环境学报, 2011, 11(5): 77-81. |
| [18] |
Vigneron A, Alsop EB, Chambers B. Complementary microorganisms in highly corrosive biofilms from an offshore oil production facility[J]. Appl Environ Microbiol, 2016, 82(8): 45-54. |
| [19] |
Cui C, Li Z, Qian J. Complete genome of Martelella sp. AD-3, a moderately halophilic polycyclic aromatic hydrocarbons-degrading bacterium[J]. Biotechnol, 2016, 225: 29-30. |
| [20] |
Lambo AJ, Patel TR. Isolation and characterization of a biphenyl-utilizing psychrotrophic bacterium, Hydrogenophaga taeniospiralis IA3-A, that cometabolize dichlorobiphenyls and polychlorinated biphenyl congeners in Aroclor 1221[J]. Journal of Basic Microbiology, 2006, 46(2): 94-107. DOI:10.1002/(ISSN)1521-4028 |
| [21] |
吴玉新. 紫外分光光度法测定污水中油含量的研究[J]. 环境保护, 1998. |
| [22] |
展惠英. 紫外分光光度法测定废水中油的含量[J]. 甘肃联合大学学报, 2007, 21(1): 65-67. |
| [23] |
韩寒冰, 刘杰凤. 机油降解菌的分离及其降解特性研究[J]. 安徽农业科学, 2009, 37(21): 9883-9884. DOI:10.3969/j.issn.0517-6611.2009.21.018 |
| [24] |
徐冯楠, 冯贵颖, 马雯, 等. 高效石油降解菌的筛选及其降解性能研究[J]. 生物技术通报, 2010(7): 221-223. |
| [25] |
罗小艳. Massilia sp. WFl对菲的降解特性研究[D]. 杭州: 浙江大学, 2015.
|
| [26] |
伍凤姬. 一株芘高效降解菌的筛选及其降解途径研究[D]. 上海, 华南理工大学, 2015.
|
| [27] |
杨智, 陈吉祥, 秦波, 等. 3株石油降解红球菌(Rhodococcus spp.)特性及相关基因分析[J]. 应用与环境生物学报, 2015, 21(5): 805-812. |
| [28] |
Kuiper I, Lagendijke EL, Bloemberg GV, et al. Rhizoremedi-ation:abeneficialplant-microbe interaction[J]. Molecular Plant-Microbe Interactions, 2004, 17(1): 6-14. DOI:10.1094/MPMI.2004.17.1.6 |
| [29] |
Cappello S, Santisi S, Calogero R, et al. Characterisation of oil-degrading bacteria isolatedWater[J]. Air, & Soil Pollution, 2012, 223(6): 3219-3226. |
| [30] |
Plotnikova EG, Altyntseva OV, Kosheleva IA, et al. Bacteria—degraders of polycyclic aromatic hydrocarbons, isolated from soil and bottom sediments in salt-mining areas[J]. Mikrobiologiia, 2000, 70(1): 61-69. |
| [31] |
Quatrini P, Scaglione G, De Pasquale C, et al. Isolation of Gram-positive n-alkane degraders from a hydrocarbon-contaminated Mediterranean shoreline[J]. J Appl Microbiol, 2008, 104(1): 251-259. |
| [32] |
Soudi MR, Kolahchi N. Bioremediation potential of a phenol degrading bacterium, Rhodococcus erythropolis SKO-1[J]. Prog Biol Sci, 2011, 1(1): 31-40. |
| [33] |
孙庆华, 柏耀辉, 赵翠, 等. Shinella zoogloeoides BC026对吡啶的降解特性研究[J]. 环境科学, 2008, 29(10): 2939-2943. |
| [34] |
苏莹, 陈莉, 汪辉, 刘兆普. 海洋石油降解菌的筛选与降解特性[J]. 应用与环境生物学报, 2008, 14(4): 518-522. |
| [35] |
Lin X, Yang B, Shen J, et al. Biodegradation of crude oil by an Arctic psychrotrophic bacterium Seudoalteromomas sp. P29[J]. Curr Microbiol, 2009, 5(3): 341-345. |