纤维素是地球上丰富的可再生资源,纤维素类物质的利用对解决全球性的能源危机具有十分重要的意义。我国是个农业大国,秸秆总产量居世界首位,每年产生约8×107 t以上秸秆[1]。当前秸秆的利用方式主要有秸秆还田、秸秆作饲料、秸秆栽培食用菌、秸秆作能源和秸秆作工业原料,但是仍然存在秸秆利用率低、秸秆作为能源转化效率低等问题[2]。
纤维素酶是由多种可降解纤维素生成葡萄糖的水解酶组成的复杂酶系,因此定义为纤维素酶系。根据纤维素酶组分在降解纤维素过程中作用的不同,将纤维素酶分为3类,分别为内切葡聚糖酶、外切葡聚糖酶、β-葡萄糖苷酶[3]。自然界中存在着大量的能产生纤维素酶的菌株,因此从中筛选产纤维素酶较高的菌株在纤维素的高效利用领域具有十分重要的意义。目前常见的产纤维素酶菌株主要有真菌、细菌和放线菌。由于真菌产纤维素酶具有酶系全,产量高等优点,因此对真菌产纤维素酶的研究最多。但真菌产纤维素酶也存在着培养周期长的缺点,而细菌产纤维素酶的培养周期较短。因此,研究细菌产纤维素酶或者改良细菌产纤维素酶菌株具有十分重要的现实意义。
目前,国内DNS测纤维素酶活法多使用分光光度计来测量吸光值,且反应体系都在试管中进行。测量过程步骤复杂,耗时时间长、粗酶液样品需求量大,不利于大批量样品快速检测酶活。本实验采用Kim[4]改良后的DNS测酶活法即酶标仪高通量测酶活法,可提高筛选效率,且实验结果更直观,将此法应用于离子束诱变初筛实验中,以期高效快速筛选出高产CMC酶活的突变菌株。
近年来,离子束在改良生物材料方面的应用与发展十分迅速。离子束具有损伤轻、突变率高、突变谱广、诱变育种技术稳定可靠、简便易行、重复性好等优点,且诱变效应是局部、可选择、可控的[5]。本研究从含腐败秸秆的土壤中分离纤维素酶产生菌,并采用离子束诱变法辐照出发菌株,以期提高出发菌株产CMC酶活的能力。
1 材料与方法 1.1 材料 1.1.1 样品采集样品采自含腐败秸秆的土壤。
1.1.2 培养基CMC-Na初筛培养基(g/L):CMC-Na 10.0 g/L,NaCl 5.0 g/L,KH2PO4 1.0 g/L,MgSO4 0.2 g/L,酵母粉10.0 g/L,琼脂18.0 g/L,pH 7.0;CMC-Na生长培养基(g/L):CMC-Na 10.0 g/L,NaCl 5.0 g/L,KH2PO4 1.0 g/L,MgSO4 0.2 g/L,酵母膏10.0 g/L,琼脂18.0 g/L,pH 5.0;产酶培养基(g/L):CMC-Na 15.0 g/L,NaCl 5.0 g/L,KH2PO4 1.0 g/L,MgSO4 0.2 g/L,酵母膏10.0 g/L,pH 5.0。
1.1.3 试剂配制方法3,5-二硝基水杨酸试剂(DNS)配置方法:酒石酸钾钠182.0 g,溶于500 mL蒸馏水中,加热(不超过50℃),于热溶液中依次加入3,5-二硝基水杨酸6.3 g、NaOH 21.0 g、苯酚5.0 g、无水亚硫酸钠5.0 g,搅拌至完全溶解,冷却后用蒸馏水定容至1 000 mL,贮于棕色瓶中,避光室温保存两周后使用[6]。
刚果红试剂:刚果红1 g/L。亚甲基蓝染色剂:亚甲基蓝1 g/L。
1.1.4 仪器设备ZHP-230落地冷冻摇床:常州普天仪器制造公司;YXQ-LS-SOSII型立式压力蒸汽灭菌锅:上海博讯实业有限公司医疗设备厂;离心机AllegraTM 64R Centrifuge:BECKMAN COULTER;PH计:Seven Excellence,Switzerland;酶标仪VARIOS-KAN LUX:Thwemo。
1.2 方法 1.2.1 样品的采集将收集到的土样与无菌水充分混合,过滤去除残渣。收集样品过滤后的滤液,取适量滤液上清液进行梯度稀释,将稀释液涂在CMC-Na初筛培养基上,30℃恒温培养,出现菌落后反复划线、纯化培养,获得纯菌落。
1.2.2 产纤维素酶菌株的筛选将纯化后的菌落分别点种在CMC-Na初筛培养基上,每个培养基点3个样,30℃培养3 d,用1 g/L刚果红染液染色20 min,弃去染液,加入1 mol/L NaCl溶液,洗涤5 min后弃去NaCl溶液,测量菌落直径和透明圈直径,分别用D和H来表示。根据透明水解圈直径和菌落直径的比值(D/H)大小初步判断菌株产纤维素酶的能力,选取比值大的菌株进行后续研究。
1.2.3 菌种鉴定将出发菌株进行分子鉴定,取摇瓶180 r/min,培养3 d的菌液离心,提取DNA。以所提取的DNA为模版,使用细菌的通用引物27F和1492R进行16S rRNA基因的PCR扩增。扩增体系为50 μL(10×Buffer 5.0 μL,MgCl2 3.0 μL,dNTPs 4.0 μL,引物各1.5 μL,Taq酶0.4 μL,DNA模板1.0 μL,ddH2O 33.6 μL)。PCR条件:95℃ 5 min;94℃ 40 s,55.3℃ 40 s,72℃90 s,72℃ 5 min;共32个循环;72℃ 10 min。PCR产物测序由武汉华大基因科技公司完成。将测序得到的序列,通过NCBI进行BLAST比对与已知16S rRNA序列进行同源性的比较,并用Mega软件构建系统发育进化树。
1.2.4 离子束诱变将出发菌株在CMC-Na生长培养基上30℃培养2 d。用接种环挑取适当菌体到4 mL的诱变保护剂中,并用震荡器使菌体在诱变保护剂中均匀分布制成菌悬液,然后测量菌悬液的OD600值。适当加入菌体或诱变保护剂使菌悬液的OD600在0.5-0.8之间,以保证辐照过程中,菌体单层平铺于培养皿中。取50 μL菌悬液在培养皿中央均匀涂布,涂布形成直径为2 cm的圆形区域,在超净工作台中自然晾干。N+注入剂量分别为1×1014 N+/cm2、5×1014 N+/cm2、1×1015 N+/cm2、5×1015 N+/cm2、1×1016 N+/cm2和5×1016 N+/cm2,此诱变剂量的选择参照离子束诱变细菌的剂量[7]。辐照后在培养皿中加入4 mL无菌水,并用灭菌后的橡胶块擦拭培养皿底部辐照过的菌斑。最后将菌液倒入含30 mL产酶培养基的锥形瓶中,在37℃,160 r/min条件下摇瓶培养12 h。
1.2.5 诱变致死率与正负突变率的测定方法将诱变前的菌悬液梯度稀释涂布于CMC-Na生长培养基上。培养48 h后计数得出诱变前菌液浓度。将诱变过后橡胶块擦拭完全的菌液震荡均匀后,稀释涂布于CMC-Na生长培养基上,培养48 h后计数得出诱变后菌液浓度。在测定正突变率时,将突变菌株中CMC酶活高于出发菌株的突变菌株定义为正突变菌株。
诱变致死率公式:致死率=1-诱变后存活菌株数/原始菌株数
正突变率公式:正突变率=发生正突变的菌株数/样本菌株数
1.2.6 诱变前后菌株的形态特征用接种环点种出发菌株与突变菌株在CMC-Na生长培养基上30℃培养96 h后,观察单菌落形态特征。同时用亚甲基蓝试剂对菌体进行染色,并在1 000倍显微镜下进行镜检。
1.2.7 突变菌株的初筛和复筛初筛:辐照后的菌株在CMC-Na液体产酶培养基中37℃,160 r/min摇床培养12 h后,稀释涂布于CMC-Na生长培养基上。30℃培养48 h后,从平板上挑取单菌落进行编号,通过画线扩大培养。将培养好的菌株用无菌枪头或牙签接种至装有2 mL CMC-Na产酶培养基的试管中。放入37℃,180 r/min的摇床中培养24 h后,酶标仪测其酶活。复筛:将初筛CMC酶活较高的突变菌株挑出,传代培养5代后。每个突变菌株以5%的接种量,在37℃,180 r/min摇床培养24 h后,测其CMC酶活。
1.2.8 CMC酶活测定法本实验所测CMC酶活为内切葡聚糖酶活,CMC酶活测定采用酶标仪高通量测定法。测定样品如图 1所示。

|
| 图 1 菌株DNS显色图 红色越深表示DNS显色反应中的还原糖越多,即酶活越高 |
取待测粗酶液20 μL于96孔板中,加入20 μL 1%的羧甲基纤维素钠溶液(pH为5.0的磷酸缓冲液配置)。40℃水浴反应30 min,然后加人160 μL DNS试剂,用铝箔包好96孔板,防止挥发,放入120℃的鼓风干燥箱中烘烤20 min,然后用酶标仪在540 nm波长下测定光吸收值,并从葡萄糖标准曲线上计算得出相对应的葡萄糖含量,进而计算酶活[4]。
酶活力定义为:在适当的温度和pH值条件下,每1 min内1 mL酶液水解相应的底物转化成1 μg还原糖的酶量定义为1个酶活力单位(U)。
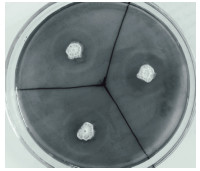
2 结果 2.1 菌株的筛选与鉴定从含腐败秸秆的土壤中分离出7株纤维素酶产生菌,它们的透明圈直径(D)、菌落直径(H)、D/H,以及培养24 h后CMC酶活的测定结果,如表 1所示。其中S-1的D/H比值为2.33,CMC酶活为6.88 U/mL,S-1表现出较高的产纤维素酶的能力。S-1在初筛培养基上的菌落形态及刚果红染色后形成的透明圈如图 2所示。
|
| 图 2 菌株S-1刚果红染色后形成透明圈图 |
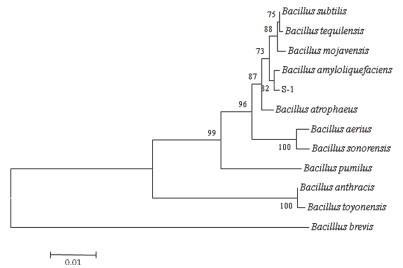
根据出发菌株S-1的16S rRNA的序列,选择同源性较高的菌株构建系统发育树如图 3所示。结合理化特征,将菌株S-1鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
|
| 图 3 基于16S rRNA序列构建的系统发育树 标尺表示分支长度;树枝上的数字表示Bootstrap值 |
选择CMC酶活较高的S-1作为出发菌株,进行离子束诱变,诱变剂量的选择参照离子束诱变细菌的剂量,离子束诱变在6个不同N+注入剂量下的诱变致死率,见表 2。随着剂量的增加,致死率基本呈升高趋势。当剂量在(5×1014-5×1015)N+/cm2之间时,诱变致死率基本维持在70%-85%左右,正突变率均在28%以上。在剂量为5×1014 N+/cm2时,正突变率最高为44%。在剂量为1×1016 N+/cm2与5×1016 N+/cm2时,致死率较高,正突变率较低。因此,在筛选突变菌株过程中尽可能多选辐照剂量在(1×1014-1×1016)N+/cm2之间的突变菌株。
在离子束诱变后的单菌落传代培养过程中,发现有部分菌株菌落形态发生变化,如突变菌株308。如图 4所示,出发菌株S-1单菌落呈白色,圆形,中央突起,不透明,突变菌株308单菌落呈乳白色,圆形,表面粗糙,有皱褶,中央突起,边缘透明。突变菌株308与出发菌株S-1相比形成的单菌落较小。将出发菌株S-1与突变菌株308用亚甲基蓝溶液染色后在1 000倍显微镜下进行观察,发现突变菌株308的芽孢形态发生变化。出发菌株S-1的芽孢呈椭圆形,而诱变菌株308的芽孢呈圆形。低能N+注入前后突变菌株形态学差异较大,这种变化表示离子束诱变可能导致出发菌株S-1内部基因序列发生改变。

|
| 图 4 离子束诱变前后菌落形态差异 A:出发菌株S-1单菌落形态;B:突变菌株308单菌落形态;C:出发菌株S-1的芽孢在1 000倍镜下的形态;D:突变菌株308的芽孢在1 000倍镜下的形态 |
低能N+注入后,挑取400株诱变后菌株,选取酶活较高的15株突变菌株传代培养5代后,其CMC酶活数据见表 3。如表 3所示,15株突变菌株的CMC酶活与出发菌株S-1的CMC酶活相比均有升高。其中CMC酶活增长率在1%-25%的有8株菌,CMC酶活增长率在25%-50%的有5株菌,CMC酶活增长率在50%-75%的有1株菌,CMC酶活增长率大于75-1相比,CMC酶活增长极显著,增长率达到了84.40%。将突变菌株308继续传代培养,突变菌株308与出发菌株S-1在第6、8、10代的CMC酶活见图 5。突变菌株308的CMC酶活在第6、8、10代均保持稳定,基本维持在16.0-17.5 U/mL左右。因此,可认为离子束诱变提高解淀粉芽孢杆菌产CMC酶活的能力具有遗传稳定性。

|
| 图 5 突变菌株的遗传稳定性 传代次数 |
近年来,通过诱变法提高产纤维素酶菌株产纤维素酶能力的研究取得了较好的进展。埃及科学家El-Ghonemy等[8]采用紫外照射与化学诱变剂的复合诱变方法提高了米曲霉NRRL3484产纤维素酶的能力,所得突变株UNAC4K的滤纸酶活是出发菌的4倍多。Sangwijit等[9]采用低能等离子体诱变解淀粉芽孢杆菌,突变菌株的D/H是出发菌株的2倍,诱变后菌株比出发菌株具有更高的产纤维素酶能力。上述研究表明通过诱变提高菌株产纤维素酶的能力是一种有效的诱变方法。低能离子束具有独特的质量沉积效应,通过与靶分子或自由基发生反应,参与其分子结构而沉积下来[10]。本研究采用低能N+注入法诱变解淀粉芽孢杆菌S-1,得到比出发菌株S-1的CMC酶活提高84.40%的突变菌株308,表明N+注入法提高菌株的CMC酶活是一种有效的诱变育种手段,菌种性能的改变可能与N+的质量沉积效应等有关。
与传统的分光光度计测酶活法相比,运用酶标仪高通量测CMC酶活法提高了工作效率,克服初筛过程中样品量大的问题,也使初筛结果更为直观。选用CMC酶活作为初筛指标可以更直观的筛选出产酶较高的突变菌株,使整个筛选体系更简便,筛选数据具有更高的说服力。
4 结论从含腐败秸秆的土壤中筛选出产纤维素酶较高的菌株S-1,经鉴定为解淀粉芽孢杆菌。并运用低能N+注入突变菌株S-1,低能N+注入前后部分突变菌株菌落形态变化较大。其中,突变菌株308与出发菌株S-1相比菌落变小。运用酶标仪高通量测酶活法测定突变菌株的CMC酶活作为初筛指标,测定5代后突变菌株的CMC酶活作为复筛指标,最终筛选得到突变菌株308,与出发菌株S-1相比,其CMC酶活增长率达到了84.40%。表明离子束诱变是一种有效的诱变育种手段。
| [1] |
毕于运, 王亚静, 高春雨. 中国主要秸秆资源数量及其区域分布[J]. 农机化研究, 2010(3): 1-7. |
| [2] |
彭春艳, 罗怀良, 孔静. 中国作物秸秆资源量估算与利用状况研究进展[J]. 中国农业资源与区划, 2014(3): 14-20. DOI:10.7621/cjarrp.1005-9121.20140303 |
| [3] |
梁艳玲. 产纤维素酶细菌的分离、鉴定及地类芽孢杆菌ME27-1产酶条件优化[D]. 南宁: 广西大学, 2014.
|
| [4] |
Kim JJ, Kwon YK, Kim JH, et al. Effective microwell plate-based screening method for microbes producing cellulase and xylanase and its application[J]. J Microbiol Biotechnol, 2014, 24(11): 1559-1565. DOI:10.4014/jmb.1405.05052 |
| [5] |
周国丽. 离子束诱变技术研究进展[J]. 现代农业科技, 2009(19): 342. DOI:10.3969/j.issn.1007-5739.2009.19.237 |
| [6] |
罗长才, 李莲, 刘亚力, 等. 琼脂糖扩散法测定加酶饲料中微量纤维素酶活力的研究[J]. 饲料博览, 2003(9): 24-27. |
| [7] |
杨慧晓. 苜蓿青贮用乳酸菌的选育[D]. 开封: 郑州大学, 2016.
|
| [8] |
El-Ghonemy DH, Ali TH, El-Bondkly AM, et al. Improvement of Aspergillus oryzae NRRL 3484 by mutagenesis and optimization of culture conditions in solid-state fermentation for the hyper-production of extracellular cellulase[J]. Antonie Van Leeuwenhoek, 2014, 106(5): 853-864. DOI:10.1007/s10482-014-0255-8 |
| [9] |
Sangwijit K, Jitonnom J, Pitakrattananukool S, et al. Low-energy plasma immersion ion implantation modification of bacteria to enhance hydrolysis of biomass materials[J]. Surface and Coatings Technology, 2016, 306: 336-340. DOI:10.1016/j.surfcoat.2016.07.068 |
| [10] |
李欢琴, 王文磊, 王昭凯, 等. 低能离子束生物技术的应用[J]. 氨基酸和生物资源, 2016(2): 1-6. |







