2. 中国科学院微生物研究所 微生物生理与代谢工程重点实验室,北京 100010
2. Key Laboratory of Microbial Physiological and Metabolic Engineering, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100010
传统的制革工艺会产生大量污染,其中,以脱毛环节产生的污染最为严重[1]。近年来研究的清洁脱毛工艺主要有酶法脱毛[2]、灰碱法基础上的保毛脱毛、有机胺脱毛、过氧化氢氧化脱毛等方法[3]。其中,蛋白酶法脱毛因条件温和,对真皮中角蛋白水解少,且毛可回收,是目前为止最有可能代替灰碱法实现清洁脱毛工业化的方法[4]。然而酶法脱毛也有一些缺点,如酶蛋白质量不稳定、纯度较低、专一性差等,会造成小毛脱不净或烂面、松面、毛孔扩大等问题,尤其是酶系中含有水解皮胶原的胶原蛋白酶,在大规模应用中如工艺控制不严会造成松面、烂皮现象[5]。因此酶脱毛在实际生产过程中的操作控制难度较大。但从环保角度出发,酶法脱毛仍然是未来脱毛技术清洁化的发展方向。
近年来,国内外的一些学者关于信号肽载体构建[6-10]和分子伴侣共表达[11-14]来提高外源蛋白在宿主菌中的表达做了很多研究。研究表明,针对不同的蛋白质应该选择合适的信号肽来实现有效的分泌表达。Nagarajan等[15]选择了4种不同的酶蛋白信号肽,以芽孢杆菌BE1510为宿主菌,分别表达重组链霉抗生物素蛋白(Streptavidin),结果中性蛋白酶信号肽的分泌效率最高;Brockmeier等[16]尝试了来源于枯草芽孢杆菌的173种信号肽对角质酶分泌表达的影响,其中有39种信号肽不能实现角质酶的分泌。研究表明,分子伴侣能够帮助蛋白正确折叠,提高蛋白的可溶性表达,减少包涵体的形成。Pfeffer等[17]在E. coli表达目的蛋白的同时表达分子伴侣蛋白,提高了目的蛋白的可溶性表达比例;陈飞等[18]的研究表明,在摇瓶中,相对于无分子伴侣的菌株,单独整合分子伴侣PDI及同时整合分子伴侣Ero1、PDI菌株的CiP酶活分别提高了2.43和2.62倍,活力达到316 U/mL和340 U/mL。
鉴于此,本研究室前期构建了一株产中性蛋白酶的枯草芽孢杆菌菌株WB800N/pHT43-npr[19],酶法脱毛与传统的灰碱法效果相当,并且该菌株剔除了胶原蛋白酶基因,不表达胶原蛋白酶,不会造成松面、烂皮、毛孔扩大等问题。但是,该菌株中性蛋白酶几千的酶活表达能力较野生菌上万的酶活力还有很大差距,在实际应用中成本较高,难以实现规模化生产。因此,在原有研究的基础上,本研究拟通过筛选信号肽和整合分子伴侣来提高中性蛋白酶基因在枯草芽孢杆菌中的表达,有助于实现重组中性蛋白酶的工业化生产,进而促进清洁化脱毛工艺的推广。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒本实验所用菌株与质粒及其相关特性描述见表 1。大肠杆菌T1用于质粒的扩增和PCR片段的克隆。解淀粉芽孢杆菌AS1.398作为供体菌,WB800N作为宿主菌。
高保真DNA mix聚合酶,购自MCLAB公司;限制性内切酶Xma I、BamH I、高保真DNA组装预混液、胶回收试剂盒、质粒小提试剂盒购自NEB公司;DNA maker、Protein maker购自Thermo公司;IPTG购自天根公司;Yeast和Tryptone购自OXOID公司;其他为国产分析纯试剂;PCR仪购自东胜创新生物科技有限公司;核酸电泳仪购自北京六一公司;蛋白电泳仪购自君意公司;凝胶成像仪购自天能公司;引物合成和DNA测序由北京擎科生物科技公司完成。
1.1.3 培养基LB培养基(L):10 g胰蛋白胨,5 g酵母粉,10 g NaCl,121℃灭菌20 min;固体培养基加20 g/L的琼脂粉。牛奶平板培养基(L):脱脂奶粉20 g,琼脂20 g,115℃灭菌20 min。
1.1.4 PCR引物本实验所用PCR引物见表 2。
常规分子生物学操作参照《分子克隆手册》[20]。
1.2.1 不同信号肽重组质粒的构建以pHT43-npr重组质粒为模版,设计特定引物QC-F和QC-R进行PCR,去除质粒上原有的信号肽基因,得到新的质粒命名为pHT43-npr-N;然后,采用Quick Change引物设计方法,设计5组信号肽引物(表 2,signal peptide primer),以pHT43-npr-N为模版进行PCR,得到5个重组质粒,分别为pHT43-npr-aprE、pHT43-npr-sacB、pHT43-npr-nprE、pHT43-npr-amyE、pHT43-npr-yncM。
1.2.2 不同分子伴侣重组质粒的构建(1)克隆分子伴侣基因PrsA和DnaK:以枯草芽孢杆菌AS1.398基因组为模版,设计两组分子伴侣引物进行PCR(表 2,molecular chaperone primer),核酸电泳验证,使用胶回收试剂盒回收分子伴侣片段。(2)质粒酶切和新重组质粒的构建:对pHT43-npr质粒进行BamH I和Sma I双酶切,得到pHT43片段和npr片段;再以npr片段和分子伴侣片段为模版,设计连接引物进行PCR(表 2,connected primer),得到npr+分子伴侣片段;最后采用Gibson连接方法将pHT43片段和npr+分子伴侣片段进行连接,得到新的重组质粒。
1.2.3 重组质粒转化到大肠杆菌T1中重组质粒采用热激法进行转化,然后涂布于LB固体平板(含100 μg/mL氨苄青霉素),37℃过夜培养。
1.2.4 菌液PCR初步鉴定用移液抢挑取转化子单克隆至LB液体培养基中培养6-8 h后,进行菌液PCR。菌液PCR引物如表 2。反应结束后将PCR产物进行1%琼脂糖电泳检测验证,验证正确的菌落。
由于信号肽片段较短,无法通过此方法进行验证,所以直接测序验证。
1.2.5 重组质粒DNA测序及检验实验的正确性将菌落PCR鉴定为阳性克隆的转化子进行5 mL LB液体试管培养12-16 h,并送往擎科生物(北京)股份有限公司进行DNA测序,测序引物如表 2(sequencing primer);将测序后获得的序列用DNAMAN软件进行比对以验证序列的正确性和该方法的可靠性。
1.2.6 转化枯草芽孢杆菌WB800N将验证正确的菌株37℃培养8-12 h,用NEB公司Plamid Miniprep Kit试剂盒小量提取质粒,取10 μL质粒加入到400 μL枯草芽孢杆菌WB800N感受态中,37℃,220 r/min培养2 h;涂布于LB固体平板(含10 μg/mL氯霉素),37℃过夜培养。
1.2.7 牛奶平板初步验证用移液枪挑取转化子于牛奶平板验证中性蛋白酶活性,37℃培养1-3 h,有水解圈生成的菌落即为阳性转化子。
1.2.8 重组菌株表达中性蛋白酶酶活性的测定及蛋白电泳分析将对照菌株(WB800N/pHT43-npr)与重组菌株按4%的比例接种于10 μL/mL CmR的50 mL LB液体培养基中,37℃、180 r/min培养。当菌体OD600=0.5左右时,添加1‰IPTG诱导产酶,诱导24 h后取样,采用Folin-酚法测定中性蛋白酶酶活性,并对重组菌株表达的中性蛋白酶进行SDS-PAGE电泳分析。
2 结果 2.1 不同信号肽重组质粒的构建、验证、转化及诱导表达结果 2.1.1 pHT43-npr质粒中原有信号肽基因剔除的结果以pHT43-npr质粒为模版,设计引物进行PCR剔除原有的信号肽序列,将PCR产物进行1%琼脂糖凝胶电泳,电泳结果(图 1)显示,pHT43-npr-N质粒的基因大小为9 428 bp,条带清晰,无杂带,与预期结果一致。

|
| 图 1 pHT43-npr-N质粒电泳分析 M:DNA maker;1:pHT43-npr-N质粒 |
由图 2可知,5个重组质粒经过双酶切电泳后,均有两条特异性条带,并且中性蛋白酶基因npr的条带位置正确;同时,测序结果用DANMAN进行比对,5个信号肽片段测序结果与实际序列完全重合,说明了重组质粒构建成功,并成功转化到大肠杆菌T1中。
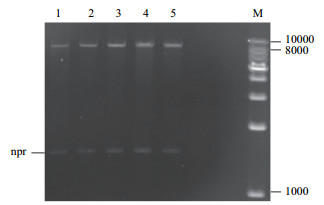
|
| 图 2 不同信号肽重组质粒双酶切电泳验证 1:pHT43-npr-aprE;2:pHT43-npr-nprE;3:pHT43-npr-yncM;4:pHT43-npr-sacB;5:pHT43-npr-amyE;M:DNA maker |
由图 3可知,与对照菌株(WB800N/pHT43-npr)相比,5株重组菌株涂牛奶平板后虽有菌落生成,但均无水解圈生成,说明5株菌没有分泌中性蛋白酶。

|
| 图 3 不同信号肽重组菌株涂牛奶平板结果 1:WB800N/pHT43-npr;2:WB800N/pHT43-npr-sacB;3:WB800N/pHT43-npr-yncM;4:WB800N/pHT43-npr-aprE;5:WB800N/pHT43-npr-nprE;6:WB800N/pHT43-npr-amyE |
以LB液体培养基作为发酵培养基,通过添加诱导剂IPTG进行诱导产酶,24 h后测酶活性。由表 3可知,两株重组菌株的发酵酶活性均显著低于对照菌株(WB800N/pHT43-npr),3株重组菌株不表达中性蛋白酶。
分子伴侣PrsA片段基因长度为876 bp,DnaK片段长度为1 836 bp,两个分子伴侣位置条带正确(图 4)。

|
| 图 4 克隆分子伴侣片段电泳验证 1-5:PrsA片段位置;M:Maker;6-10:DnaK片段位置 |
npr+PrsA片段基因长度为2 352 bp,npr+DnaK片段基因长度为3 312 bp。由图 5可知,通过菌液PCR、核酸电泳验证,两条片段在相应位置均有特异性条带,且大小与预期相符。

|
| 图 5 菌液PCR验证电泳图 1、2:npr+PrsA片段3、4:npr+DnaK片段 |
由图 6可以看出,牛奶平板有水解圈生成,说明菌落周围有中性蛋白酶存在。
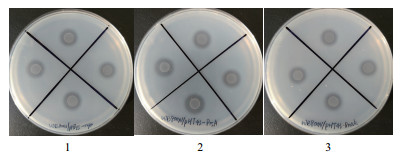
|
| 图 6 不同分子伴侣重组菌株涂牛奶平板结果 1:WB800N/pHT43-npr 2:WB800N/pHT43-npr-PrsA 3:WB800N/pHT43-npr-DnaK |
由图 7可知,两株重组菌株和对照菌株在30-40 kD之间均有一条特异性条带,说明两株重组菌株成功后表达了中性蛋白酶。与对照菌株相比,两株重组菌株发酵酶活都有所增加,分别增加了23%和33%(图 8)。
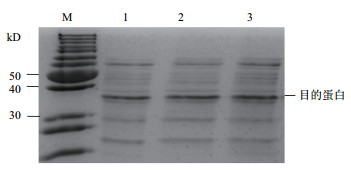
|
| 图 7 不同重组菌株中性蛋白酶SDS-PAGE结果 1:WB800N/pHT43-npr 2:WB800N/pHT43-npr-PrsA 3:WB800N/pHT43-npr-DnaK |

|
| 图 8 不同重组菌株发酵酶活对比结果 A:WB800N/pHT43-npr;B:WB800N/pHT43-npr-PrsA;C:WB800N/pHT43-npr-DnaK |
随着制革业对清洁化生产工艺的需求,酶法脱毛制革因酶制剂来源广泛、易获得、无毒害和污染小等优点成为替代传统灰碱法脱毛工艺的首选[21-22]。目前市场中的脱毛酶如1398中性蛋白酶和来源于其他枯草芽孢杆菌的中性蛋白酶,虽然可以完成脱毛工艺,但是酶制剂中有胶原蛋白酶的存在,会造成皮面烂面、毛孔粗大等问题,使得酶法脱毛很难在制革工艺中规模化推广。目前大多数研究集中在菌株发酵条件优化[23-24]、菌种诱变选育[25-26]和不同外源系统表达[27-28]等技术来提高中性蛋白酶的表达上。虽然这些技术能在一定程度上提高酶的产量,但利用信号肽和分子伴侣来提高中性蛋白酶的表达还罕见报道。枯草芽孢杆菌表达系统已经是一种成熟的外源蛋白表达系统,本研究选用的宿主菌为剔除胶原蛋白酶基因的枯草工程菌株WB800N,从源头上消除了胶原蛋白酶对皮胶原的影响。然而外源蛋白在进行分泌表达过程中往往水平较低,大量研究表明[15-18, 29-36],选择适合的信号肽和分子伴侣可以提高蛋白的表达。本文通过筛选信号肽和整合分子伴侣两种技术手段,来提高中性蛋白酶基因(npr)的胞外表达。构建的5株信号肽重组菌株虽然不能表达中性蛋白酶,但对以后的科研提供了一定的参考;成功构建的2株整合分子伴侣的重组质粒对中性蛋白酶的表达均有一定的提高,整合PrsA和整合DnaK使目的蛋白酶活分别提高了23%和33%,说明两个分子伴侣成功地帮助了中性蛋白酶基因进行更快速的折叠和组装。
本研究通过筛选信号肽和整合分子伴侣促进蛋白转运和正确折叠从而提高中性蛋白酶表达量,为该酶的工业化生产及应用打下基础,对促进其他外源蛋白在枯草芽孢杆菌中的分泌表达提供了新的思路和借鉴。本文通过研究信号肽和分子伴侣对中性蛋白酶分泌表达的影响,得到了一些有意义的结果,但仍有一下几方面有待进一步研究:
(1)重组菌株WB800/pHT43-npr-PrsA和WB-800/pHT43-npr-DnaK的发酵培养采用的是LB培养基,为了提高分泌量,可以对培养基成分及发酵条件进行优化;(2)本研究仅选取了5种信号肽来替换原始信号肽amyQ基因,得到的结果不理想。下一步研究可选取更多具有代表性的信号肽或者以高通量的手段建立载体库,系统化的分析在不同信号肽的引导下,具有不同结构蛋白质分泌效率的规律;(3)本研究只做了整合一种分子伴侣重组菌株的构建,对于整合两种或多种分子伴侣对目的蛋白的分泌表达的影响可作为将来的研究方向;(4)本文未对重组酶的酶学性质和应用做进一步研究,此可作为下一步的研究方向。
4 结论通过筛选信号肽和整合分子伴侣到重组质粒上,成功构建了两株整合分子伴侣的重组菌株,中性蛋白酶发酵酶活比对照分别提高了23%和33%。
| [1] |
Saran S, Mahajan RV, Kaushik R, et al. Enzyme mediated beam house operations of leather industry:a needed step towards greener technology[J]. Journal of Cleaner Production, 2013, 54(9): 315-322. |
| [2] |
Kumar MM, Saranraj P. Commercial production and application of bacterial alkaline protease:an overview[J]. Quaternary Science Reviews, 2015, 3(34): 1-23. |
| [3] |
张玉红, 刘萌, 但卫华, 等. 4种典型脱毛工艺的对比(续)[J]. 中国皮革, 2015, 44(14): 20-23. |
| [4] |
Pandeeti EV, Pitchika GK, Jotshi J, et al. Enzymatic depilation of animal hide:Identification of elastase(LasB)from Pseudomonas Aeruginosa MCM B-327 as a depilating protease[J]. PLoS One, 2011, 6(2): e16742. DOI:10.1371/journal.pone.0016742 |
| [5] |
于士强, 桂俊鸿, 王海燕. 短小芽孢杆菌胞外蛋白质组双向电泳分析及碱性胁迫下胞外差异蛋白鉴定[J]. 应用与环境生物学报, 2014, 20(2): 217-222. |
| [6] |
Ohmura K, Shiroza T, Nakamura K, et al. A Bacillus subtilis secretion vector system derived from the Bacillus subtilis α-amylase promoter and signal sequence region, and secretion of Escherichia coli β-lactamase by the secretion vector system[J]. J Bio chem, 1984, 95: 87. |
| [7] |
He XS, Bruckner R, Doi RH. The protease genes of Bacillus subtilis[J]. Res Microbiol, 1991, 142: 797. DOI:10.1016/0923-2508(91)90058-I |
| [8] |
Palva I, Sarvas M, Lehtovaara P, et al. Secretion of Escherichia coli β-lactamase from Bacillus subtilis by the aid of α-amylase signal sequence[J]. Proc Natl Acad Sci USA, 1982, 79: 5582. DOI:10.1073/pnas.79.18.5582 |
| [9] |
Breitling R, Gerlach D, Hartmann M, et al. Secretory expression in Escherichia coli and Bacillus subtilis of human interferon αgenes directed by staphylokinase signals[J]. Mol Gen Genet, 1989, 217: 384. DOI:10.1007/BF02464908 |
| [10] |
Palva I, Sarvas M, Lehtouaara P, et al. Production and secretion of pertussis toxin subunits in Bacillus subtilis[J]. FEMS Microbiol Lett, 1990, 68: 143-148. DOI:10.1111/j.1574-6968.1990.tb04138.x |
| [11] |
Zhang JH, Wu D, Chen J, et al. Enhancing functional expression of β-glucosidase in Pichia pastoris by co-expressing protein disulfide isomerase[J]. Biotechnol Bioproc E, 2011, 16(6): 1196-1200. DOI:10.1007/s12257-011-0136-1 |
| [12] |
Wu M, Liu W, et al. Engineering of a Pichia pastoris expression system for high-Level secretion of HSA/GH fusion protein[J]. Appl Biochem Biotechnol, 2014, 172(5): 2400-2411. DOI:10.1007/s12010-013-0688-y |
| [13] |
郭永华, 陈济琛, 贾宪波, 等. 分子伴侣共表达对嗜热环糊精葡萄糖基转移酶异源可溶性表达的影响[J]. 微生物学通报, 2016, 43(3): 518-526. |
| [14] |
张网罗. 铜绿假单胞菌甲酸脱氨酶的分子伴侣共表达、纯化及酶活检测[D]. 上海: 复旦大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10246-1015419698.htm
|
| [15] |
Nagarajan N, Ramaley R, Albertson H, et al. Secretion of streptavi-din from Bacillus subtilis[J]. Applied and Environmental Microbiology, 1993, 59(11): 3894-3898. |
| [16] |
Brockmeier U, Caspers M, Freudl R, et al. Systematic screening of all signal peptides from Bacillus subtilis:A powerful strategy in optimizing heterologous protein secretion in gram-positive bacteria[J]. J Mol Biol, 2006, 362: 393-402. DOI:10.1016/j.jmb.2006.07.034 |
| [17] |
Pfeffer J, Rusnak M, Hansen CE, et al. Functional expression of lipase A from Candida antarctica in Escherichia coli-A pre-requisite for high-throughput screening and directed evolution[J]. Journal of Molecular Catalysis B:Enzymatic, 2007, 45: 62-67. DOI:10.1016/j.molcatb.2006.11.006 |
| [18] |
陈飞, 胡美荣, 江贤章, 等. 共表达分子伴侣PDI和Ero1对灰盖鬼伞过氧化物酶在毕赤酵母中表达的影响[J]. 生物工程学报, 2015, 31(12): 1682-1689. |
| [19] |
郑翔, 杨何宝, 胡美荣, 等. 一种新型蛋白酶的酶学特性及脱毛应用[J]. 生物技术通报, 2017, 33(5): 183-189. |
| [20] |
Sambrook J, Russell DW. Molecular Cloning:A Laboratory Manual[M]. 3rd ed. Beijing: Cold Spring Harbor Laboratory Press, 2001.
|
| [21] |
Soerensen NH, Hoff T, Oestergaard PR, et al. Dehairing of skins and hides: US, 9267182B2[P]. 2016-2-23.
|
| [22] |
Dettmer A, Cavalli É, Ayub MAZ, et al. Environmentally friendly hide unhairing:enzymatic hide processing for the replacement of sodium sulfide and delimig[J]. Journal of Cleaner Production, 2013, 47(5): 11-18. |
| [23] |
刘颖, 张彬彬, 孙冰玉, 等. 枯草芽孢杆菌高产中性蛋白酶发酵条件的优化[J]. 食品科学, 2014, 35(13): 166-170. DOI:10.7506/spkx1002-6630-201413032 |
| [24] |
马宏颖. 中性蛋白酶高产菌株的诱变选育及发酵条件研究[D]. 保定: 河北农业大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-11920-2008074542.htm
|
| [25] |
陈鸿图. 高产中性蛋白酶菌株选育及产酶特性研究[D]. 广州: 华南理工大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10561-1012451715.htm
|
| [26] |
李艳丽, 许少春, 许尧兴. 中性蛋白酶高产菌株的筛选及产酶酶系分析[J]. 生物技术, 2007, 17(1): 20-23. |
| [27] |
许波. 中性蛋白酶基因的克隆及其在毕赤酵母中的高效表达[D]. 昆明: 云南师范大学, 2004. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y656980
|
| [28] |
杜珊珊, 王颖, 张东杰. 解淀粉芽孢杆菌中性蛋白酶基因的克隆与表达[J]. 黑龙江八一农垦大学学报, 2015, 27(1): 51-54. |
| [29] |
段春燕. 枯草芽孢杆菌信号肽筛选载体的构建木聚糖基因(xynA)的表达[D]. 杨凌: 西北农林科技大学, 2010. http://cdmd.cnki.com.cn/article/cdmd-10712-2010149802.htm
|
| [30] |
祝发明. 枯草芽孢杆菌Tat分泌表达青霉素G酰化酶初步研究[D]. 杨凌: 西北农林科技大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10712-2006179929.htm
|
| [31] |
EllisJ. Proteins as molecular chaperones[J]. Nature, 1991, 328(6129): 378-379. |
| [32] |
张海军, 杨君, 等. 应用分子伴侣共表达系统表达pfu基因及酶活性测定[J]. 云南植物研究, 2009, 31(6): 499-503. |
| [33] |
万娟, 邓会群, 张碧乾, 等. 分子伴侣协助下抗肿瘤抗生素美达霉素生物合成中的糖基转移酶Med-ORF8的原核表达[J]. 微生物学通报, 2011, 38(2): 221-227. |
| [34] |
曾伶俐. 不同信号肽对脂肪酶A在枯草芽孢杆菌中分泌表达的影响[D]. 无锡: 江南大学, 2009. http://www.paper.edu.cn/html/releasepaper/2009/08/208/
|
| [35] |
崔硕硕, 张镱, 林学政, 等. 分子伴侣共表达对低温脂肪酶Lip-837异源可溶性表达的影响[J]. 海洋科学进展, 2011, 29(1): 105-112. |
| [36] |
蒋红亮, 张虹, 赵辅昆, 等. 分子伴侣CsaA过表达及wprA蛋白酶的缺失对枯草芽孢杆菌分泌表达外源蛋白的影响[J]. 浙江理工大学学报, 2011, 28(2): 260-266. |






