2. 暨南大学生物工程学系,广州 510632;
3. 日照职业技术学院 海洋工程学院,日照 276826
2. Department of Biotechnology, Jinan University, Guangzhou 510632;
3. Rizhao Polytechnic, Department of Marine Engineering, Rizhao 276826
蛋白酶是一类能够催化水解肽键的酶,基本可分为酸性、中性、碱性蛋白酶3种,广泛应用于工业生产,如医药、皮革、食品加工、饲料、洗涤剂等多个生产领域[1-4],其来源广泛,主要存在于动物内脏、植物茎叶及果实和微生物中[5]。相比较于利用动植物生产蛋白酶,微生物生产蛋白酶具有高产菌株选育简单快速,培养条件简单易扩大培养,生产周期短,且产出的蛋白酶多为胞外酶,分离纯化简单经济,是工业蛋白酶的重要来源[6]。
海洋是生命的起源地,不仅面积广阔,而且蕴藏着极为丰富的微生物资源。在海沉积环境、红树林以及深海热液喷口、冷泉口等,都发现了新颖微生物的存在[7]。利用丰富的海洋资源,从种类繁多的海洋微生物中分离纯化出生物酶制剂,已经成为国内外酶制剂研究领域的发展方向和研究热点[8]。目前已分离得到的海洋微生物酶有:蛋白酶、脂肪酶、纤维素酶、果胶酶、DNA聚合酶和溶菌酶等[9]。且由于海洋特殊的极端环境,与陆地微生物产的蛋白酶相比较,海洋来源的酶通常具有耐盐、耐碱、耐热和耐低温等优良特性。
从大亚湾红树林土壤样品中筛选出一株产蛋白酶菌株,鉴定该蛋白酶粗酶液的酶学性质,并对该菌株的产酶条件进行优化,以期获得优良性能的海洋微生物蛋白酶。
1 材料与方法 1.1 材料 1.1.1 菌株大亚湾红树林根际土壤分离得到产蛋白酶菌株DH-2。
1.1.2 培养基脱脂奶粉培养基:配置1%琼脂糖、1%脱脂奶粉溶液,高压灭菌待冷却到合适温度后倒平板。种子培养基(1 L):胰蛋白胨10.0 g,酵母粉5.0 g,NaCl 10.0 g。基础发酵培养基(1 L):可溶性淀粉5.0 g,胰蛋白胨10.0 g,NaCl 10.0 g,KH2PO4 0.5 g,MgSO4·7H2O 0.3 g,CaCl2 0.5 g,pH为7.0。
1.1.3 试剂实验所用试剂皆为国产分析纯。
1.2 方法 1.2.1 产蛋白酶菌株初筛[10]在无菌操作环境下,取一定量土壤于试管中,加入10 mL无菌水,在37℃,150 r/min条件下震荡1 h,静置一定时间后,取上清液1 mL,依次梯度稀释成10-1、10-2和10-3,取200 μL各梯度的稀释样品,分别涂布于脱脂奶粉培养基平板上,每个梯度设置3个平行组,于37℃培养箱培养24 h,观察平板长出的菌落以及其周围形成的透明圈大小。选取菌落周围具有明显蛋白水解圈的菌株于平板进行3次以上画线纯化培养,直至纯化后保菌。
1.2.2 产蛋白酶菌株复筛挑选平板上水解圈较大的菌株接入种子培养基,200 r/min,37℃培养24 h。然后按照1%的接种量,将扩大培养后的菌液接种到发酵培养基,200 r/min,37℃培养24 h,发酵液12 000 r/min离心制得粗酶液,测定其酶活,选取酶活最高的菌株进行后续的研究。
1.2.3 酶活测定采用国标GB /T23527-2009规定的福林酚显色法测定蛋白酶活[11]。酶活定义:40℃,pH7.0条件下,每分钟水解酪蛋白产生1 µg酪氨酸的酶量即为1个蛋白酶活力单位[12]
1.2.4 菌株16S rRNA序列测定采用16S rRNA通用引物27F:5'-AGAGTTTATCCTGGCTCAG-3';和1492R:5'-GGTTACCTTGTTACGACTT-3'对其进行PCR扩增。PCR扩增条件:95℃预变性10 min;95℃ 30 s,55℃ 30 s,72℃ 3 min,循环30次;72℃延伸10 min。扩增产物经1%琼脂糖凝胶电泳,进行检测,然后送至生工生物工程有限公司进行测序。测序结果利用BLAST获得相近的菌株16S rRNA序列,然后利用Mega 5.0构建菌株的系统发育树。
1.2.5 DH-2菌株生长曲线测定1%的接种量于发酵培养基,200 r/min,37℃培养,每隔2 h测定其生物量OD600。
1.2.6 粗酶液酶学性质的测定 1.2.6.1 蛋白酶的最适反应pH和pH稳定性发酵粗酶液经过高速离心后稀释一定倍数,在不同pH(5、6、7、8、9和10)条件下测定其酶活,粗酶液在不同pH(3-10)下置于4℃冰箱12 h,测定残余酶活,检测其pH稳定性。
1.2.6.2 蛋白酶的最适反应温度和热稳定性发酵粗酶液在高速离心后稀释一定倍数,在不同温度(40-75℃)水浴条件下测定其酶活,以确定其最适反应温度。粗酶液在(25-60℃)条件下水浴处理1 h,然后测定其剩余酶活,查看粗酶液的热稳定性。
1.2.6.3 金属离子、有机溶剂和表面活性剂对蛋白酶酶活的影响将稀释后的粗酶液与不同金属离子混合(Na+、Li+、K+、Ni2+、Mg2+、Ca2+、Ba2+、Fe2+、Co2+、Zn2+、Cu2+和Mn2+),使其终浓度达到5 mmol/L;与不同有机溶剂混合(甲醇、乙醇、正丁醇、正庚醇、正癸醇、丙酮、二甲基甲酰胺、二甲基亚砜、二氯甲烷、三氯甲烷、正己烷、环己烷、正庚烷、正辛烷、正癸烷、甲苯和四氢呋喃),使其终浓度为10%(V/V);与不同表面活性剂混合(Triton-100、Tween-20、tween-80、SDS、SDBS和三聚磷酸钠),使其终浓度为0.1%(V/V),对照组加水处理。各组都在室温下处理2 h,然后在最适条件下测定各组的酶活,考察其对蛋白酶酶活的影响。
1.2.7 菌株发酵培养基的确定单因素试验研究不同碳源(葡萄糖、木糖、可容性淀粉、麦芽糖和蔗糖),不同氮源(酵母提取粉、牛肉膏、酵母粉、氯化铵和硫酸铵),不同碳源含量(0、0.5%、1.0%、1.5%和2.0%),不同氮源含量(0、1.0%、2.0%、3.0%和4.0%),不同初始pH(4.5、5.0、5.5、6.0和6.5)和不同氯化钠含量(0、0.5%、1.0%、1.5%、2.0%和2.5%)对DH-2菌株产蛋白酶的影响。菌株扩大培养后按照1%的接种量,37℃,200 r/min条件下发酵培养24 h,然后测定酶活,以每组中酶活最高的为100%。根据单因素试验结果设计正交试验,确定最适发酵培养基。
1.2.8 菌株发酵条件的确定单因素试验研究不同发酵时间(12 h、24 h、36 h、48 h、60 h、72 h、84 h和96 h),不同接种量(1%、2%、3%、4%、5%、6%、7%、8%、9%和10%)和不同发酵温度(20℃、25℃、30℃、35℃、37℃、40℃和45℃)对DH-2菌株产蛋白酶的影响。根据单因素试验结果设计正交试验,确定最适发酵条件。
2 结果 2.1 筛选结果复筛过程中,得到一株产蛋白酶酶活较高的菌株,其酶活约为30 U/mL,标记为DH-2。
2.2 菌株的系统发育分析菌株DH-2的16S rRNA与NCBI数据库上已知的菌株的16S rRNA对比,结果显示其与枯草芽孢杆菌Bacillus subtilis NJ1的16S rRNA的同源性达到99%。由图 1可知,菌株DH-2与Bacillus subtilis NJ1处在系统发育进化树的同一分支上。

|
| 图 1 基于16S rRNA序列的系统进化树 |
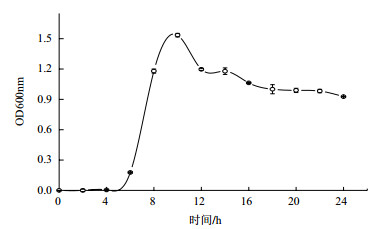
在4-10 h,菌液的OD值随着时间的增加呈指数增长,10 h进入稳定期,之后逐渐进入衰亡期(图 2)。
|
| 图 2 DH-2菌株的生长曲线 |
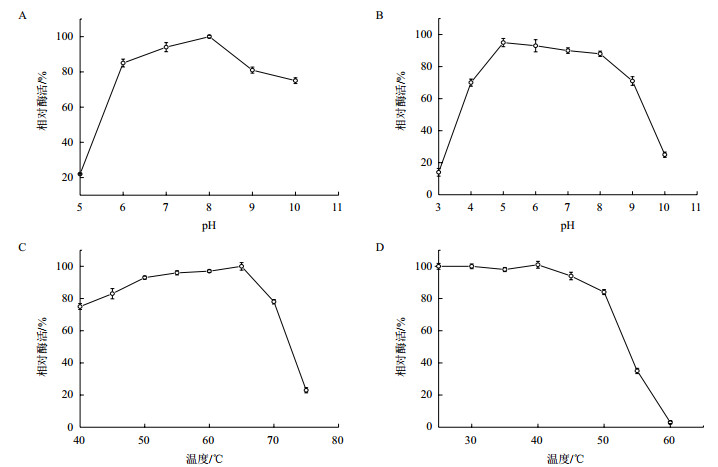
由图 3-A可知,该蛋白酶在pH 8.0有最高的催化活性;在pH 6.0-9.0时,相对酶活都保持在80%以上,能够发挥较大的催化活性;在pH为10.0时,该蛋白酶仍能保持75%的相对酶活。由图 3-B可知,在pH为4-9之间时,该酶较为稳定;pH小于4或大于10时,严重失活。
|
| 图 3 发酵液中蛋白酶粗酶液的酶学性质测定 A.蛋白酶粗酶液最适反应pH;B.蛋白酶粗酶液的pH耐受性;C.蛋白酶粗酶液最适反应温度;D.蛋白酶粗酶液温度耐受性 |
由图 3-C可知,在较低温度下,蛋白酶随着温度的升高酶活逐渐增大,在65℃时达到最大值。当温度大于65℃后,酶的蛋白结构受到高温的影响,酶活性有所降低。由图 3-D可知,粗酶液稀释一定倍数后在不同温度梯度下水浴处理60 min,然后在最适反应条件下测定其剩余酶活,对照组放置在4℃处理,并以对照组的酶活定义为100%。蛋白酶在25-40℃条件下处理后酶活不受影响,45-50℃处理后仍保持80%以上的催化活性,之后随着处理温度的升高,酶活有损失。
2.4.3 金属离子对蛋白酶活性的影响由表 1可知,5 mmol/L的Na+、Mg2+、Ca2+、Ba2+和Li+对酶活性具有一定的促进作用,其余金属离子对该酶的活性影响较小,总体上该蛋白酶对所检测的金属离子均有很好的耐受性。
由表 2可知,该蛋白酶对所检测的有机溶剂均具有较好的耐受性,蛋白酶活性受有机溶剂的影响较小。由表 3可知,该蛋白酶对所检测的表面活性剂均具有较好的耐受性,其中Tween-80对该酶的活性具有一定的促进作用。
碳源不仅供给微生物生长所需的能量,还对微生物的产酶具有诱导或是阻遏作用。因此,我们需要对培养基的碳源进行选择,从而获得适合菌株生长和产酶的发酵培养基。由图 4-A可知,菌株在可溶性淀粉作为碳源的发酵液中产蛋白酶情况最好。

|
| 图 4 发酵培养基的优化 A:碳源对菌株DH-2产酶的影响;B:氮源对菌株DH-2产酶的影响;C:可溶性淀粉含量对菌株DH-2产酶的影响;D:胰蛋白胨含量对菌株DH-2产酶的影响;E:初始pH对菌株DH-2产酶的影响;F:NaCl浓度对菌株DH-2产酶的影响 |
影响蛋白酶产酶的另外一个重要因素是氮源。由图 4-B可知,该菌株选择性利用有机氮源作为能量物质,几乎无法利用无机氮源进行生长和生产,其中对胰蛋白胨的利用较为高效,产酶情况最好,因此选择胰蛋白胨作为氮源。
2.5.3 碳源和氮源含量对发酵产酶的影响碳源和氮源的含量对菌株发酵液具有一定的影响。因此,在确定最佳碳源和氮源后,分别设计实验研究其最适浓度。由图 4-C可知,可溶性淀粉含量为0.5%时发酵液有最大酶活,随着其含量的继续增大,其酶活先下降后保持不变。由图 4-D可知,高浓度的胰蛋白胨不仅不能促进菌株的产酶,反而对其有抑制作用,因此确定胰蛋白胨含量为1%。
2.5.4 初始pH对发酵产酶的影响分析图 4-E,菌株在初始pH为5.0-6.0时产酶情况较为稳定,当pH>6.0或<5.0时,菌株所产蛋白酶的量显著下降,由此可知pH过高或过低都不利于菌株的产酶,因此选择发酵液的初始pH为5.5。
2.5.5 NaCl浓度的确定由图 4-F可知,在一定浓度范围内,菌株的产酶情况受NaCl浓度的影响较小,产酶较为稳定,其中当发酵液的NaCl浓度在低于1%左右时对菌株产酶具有较好的促进作用,但当NaCl浓度较高时对菌株的产酶具有抑制作用。
2.5.6 优化培养基的正交试验结果采用L9(34)正交试验研究碳源、氮源、pH值和NaCl这4个因素对DH-2菌株产蛋白酶的影响。由表 4可知,DH-2菌株产蛋白酶的最佳发酵培养基组成为可溶性淀粉10 g/L,胰蛋白胨10 g/L,发酵液初始pH 5.5,NaCl 10 g/L。各因素对菌株产酶的影响,由大到小依次为氮源含量、碳源含量、pH值、NaCl浓度。
根据图 5-A结果,随着发酵时间的不断增加,菌株所产蛋白酶的量不断增加,当发酵时间为36-48 h时,蛋白酶活力基本达到最大值,之后再延长发酵时间,蛋白酶活力呈下降的趋势。因此,发酵时间选择36 h。

|
| 图 5 发酵条件的优化 A:发酵时间对菌株DH-2产酶的影响;B:接种量菌株DH-2产酶的影响;C:发酵温度对菌株DH-2产酶的影响 |
图 5-B表明,菌液的接种量对DH-2菌株发酵产酶的影响不大,接种量在6%-8%时菌株产酶情况基本相同,在8%时发酵液酶活有最大值。
2.6.3 不同发酵温度对产酶的影响由图 5-C可知,该菌株在较低温度(低于25℃)下基本不产蛋白酶,随着温度的不断升高,菌株所产蛋白酶活力不断增大,当发酵温度为37℃时蛋白酶活力最大。此后随着温度的升高,酶活略有下降,但影响很小。
2.6.4 优化发酵条件的正交试验结果采用L9(34)正交试验研究发酵时间、发酵温度、接种量3个因素对DH-2菌株产蛋白酶的影响。由表 5可知,DH-2菌株产蛋白酶的最佳发酵条件为发酵温度为40℃,发酵时间为36 h,接种量为7%,各因素主次顺序为C>B>A。该菌株分泌的胞外蛋白酶在最适培养基和反应条件下的酶活为236.30 U/mL,是初筛中表现的酶活的近8倍。
海洋来源微生物所产的酶类通常具有较好的稳定性,适合工业化应用,是当下的一个研究热点。Chellappan等[13]从海洋微生物Engyodontium album BTMFS10中分离到产丝氨酸蛋白酶的菌株,该蛋白酶具有良好的热稳定性,在60℃保存8 h后仍保持80%以上的酶活;并且对大多数有机溶剂、表面活性剂显示出较好的耐受性。Hames-Kocabas等[14]从土耳其伊兹密尔湾海洋沉积物样品中分离得到一株产蛋白酶的放射菌MA1-1,该蛋白酶在pH(8.0-13.0)和较高温度(35-50℃)条件下具有较好的酶活性。Amoozegar等[15]从NaCl含量为17%的湖水中筛选得到盐弧菌AF-2004菌株,它产生的蛋白酶具有高耐盐性,在初始NaCl浓度为10%时产酶效果达到最佳状态(NaCl浓度为1%)的70%以上,且同时具有较为宽广的反应pH(5.0-10.0)。这些海洋或者极端环境获得的蛋白酶都具有良好的耐盐、耐热等性能,显示出较好的稳定性,是许多陆地微生物蛋白酶所不能比拟的。
红树林是具有丰富而特殊微生物资源的海洋生态环境,本研究从大亚湾红树林样品中筛选到一株产蛋白酶的枯草芽孢杆菌菌株DH-2,经测定,该蛋白酶的粗酶液表现出良好的耐热性,并且对多种金属离子、有机溶剂和表面活性剂中所具有的高耐受性,使其在洗涤业和纺织业等众多工业应用领域具有很好的应用潜能。由于游离酶本身存在的稳定性差、分离回收困难和难以实现反复连续利用等缺陷,很大程度上限制了其在工业生产中的实际应用,将其制备成固定化酶很有必要[16-18]。本课题后续将对该海洋菌株所产蛋白酶进行分离纯化以及固定化制剂研究,以期实现该海洋微生物蛋白酶的产业化制备。
4 结论从大亚湾红树林分离得到的枯草芽孢杆菌菌株DH-2,其最佳发酵条件是1%(m/V,下同)可溶性淀粉,1%胰蛋白胨、1% NaCl,初始发酵pH 5.5,7%的接种量,在40℃培养36 h。在最适条件下,测得发酵液的酶活为236.30 U/mL,约为初筛时的酶活的8倍。该菌株分泌的蛋白酶最适反应pH和温度分别为8.0和65℃,50℃处理1 h后,仍保留80%以上的相对酶活。该蛋白酶具有较为宽广的作用pH,pH在6.0-9.0时能发挥80%以上的相对酶活;作用温度范围广,在40-70℃时,能发挥75%以上的相对酶活。同时,该蛋白酶对多种金属离子、有机溶剂及表面活性剂均有较好的耐受性。
| [1] |
谢超, 刘鹭. 几种肉类蛋白酶嫩化剂的比较[J]. 肉类工业, 2003, 2: 29-31. |
| [2] |
郑翔, 杨何宝, 胡美荣, 等. 一种新型蛋白酶的酶学特性及脱毛应用[J]. 生物技术通报, 2017, 33(5): 183-189. |
| [3] |
Banik RM, Prakash M. Laundry detergent compatibility of the alkaline protease from Bacillus cereus[J]. Microbiol Res, 2004, 159(2): 135-140. DOI:10.1016/j.micres.2004.01.002 |
| [4] |
Ghazi S, Rooke JA, Galbraith H, et al. The potential for the improvement of the nutritive value of soya-bean meal by different proteases in broiler chicks and broiler cockerels[J]. British Poultry Science, 2002, 43(1): 70-77. DOI:10.1080/00071660120109935 |
| [5] |
万文结, 薛芷筠, 张泽文, 等. 一株产碱性蛋白酶菌株的筛选鉴定及酶学特性研究[J]. 2017, 57(5): 737-747. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=wsxb201705012&dbname=CJFD&dbcode=CJFQ
|
| [6] |
肖怀秋, 林亲录, 李玉珍, 等. 微生物碱性蛋白酶研究进展[J]. 中国食品添加剂, 2005(5): 60-64. |
| [7] |
张力元. 海洋来源产蛋白酶的菌株筛选及其产酶条件的优化研究[D]. 保定: 河北农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10086-1015517905.htm
|
| [8] |
张子瑞. 一株产壳聚糖酶的海洋菌株Y-116的鉴定、产酶条件和酶学性质研究[D]. 上海: 上海海洋大学, 2016. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D01094262
|
| [9] |
郇惠杰, 钟泓波, 雷芬芬, 等. 产蛋白酶海洋细菌的筛选、鉴定及发酵培养基的研究[J]. 食品工业科技, 2013, 34(24): 181-185. |
| [10] |
陈明霞, 李和阳, 陈维维, 等. 68株北极产蛋白酶菌株的筛选、鉴定以及部分酶学性质[J]. 微生物学报, 2013, 53(7): 702-709. |
| [11] |
中华人民共和国国家监管技术局. GB/T 23527-2009 ICS67. 220. 22X69-2009. 蛋白酶制剂[S]. 北京标准出版社, 2009.
|
| [12] |
柯野, 伍嘉慧, 曾松荣, 等. 一株产蛋白酶菌株的筛选鉴定及酶学性质分析[J]. 广东农业科学, 2015(2): 137-141. |
| [13] |
Chellappan S, Jasmin C, Basheer SM, et al. Characterization of an extracellular alkaline serine protease from marine Engyodontium album BTMFS10[J]. J Ind Microbiol Biotechnol, 2011, 38(6): 743-752. DOI:10.1007/s10295-010-0914-3 |
| [14] |
Hameş-Kocabaş EE, Uzel Ataç. Alkaline protease production by an actinomycete MA1-1 isolated from marine sediments[J]. Annals of Microbiology, 2007, 57(1): 71-75. DOI:10.1007/BF03175053 |
| [15] |
Ali Amoozegar M, Zahra Fatemi A, Reza Karbalaei-Heidari H, et al. Production of an extracellular alkaline metalloprotease from a newly isolated, moderately halophile, Salinivibrio sp. strain AF-2004[J]. Microbiol Res, 2007, 162(4): 369-377. DOI:10.1016/j.micres.2006.02.007 |
| [16] |
曾淑, 杨江科, 闫云军. 固定化脂肪酶性质及其应用研究[J]. 生物加工过程, 2007, 5(1): 45-49. |
| [17] |
Kim H, Choi N, Oh SW, et al. Synthesis of alpha-linolenic acid-rich triacylglycerol using a newly prepared immobilized lipase[J]. Food Chemistry, 2017, 237: 654-658. DOI:10.1016/j.foodchem.2017.05.161 |
| [18] |
Mendes AA, De Castro HF, Rodrigues DD, et al. Multipoint covalent immobilization of lipase on chitosan hybrid hydrogels:influence of the polyelectrolyte complex type and chemical modification on the catalytic properties of the biocatalysts[J]. Journal of Industrial Microbiology & Biotechnology, 2011, 38(8): 1055-1066. |









