2. 中国热带农业科学院环境与植物保护研究所 农业部热带作物有害生物综合治理重点实验室 海南省热带作物病虫害生物防治工程技术研究中心 热带农业有害生物监测与控制重点实验室,海口 571101
2. Environment and Plant Protection Institute, China Academy of Tropical Agricultural Sciences/Key Laboratory of Pests Comprehensive Governance for Tropical Crops, Ministry of Agriculture/Hainan Engineering Research Center for Biological Control of Tropical Crops Diseases and Insect Pests/Key Laboratory for Monitoring and Control of Tropical Agricultural Pests, Haikou 571101
木瓜秀粉蚧(Paracoccusmarginatus Williams and Granara de Willink),又名木瓜粉蚧,属半翅目Hemi-ptera,粉蚧科Pseudococcidae,秀粉蚧属Paracoccus,是重要的世界危险性检疫有害生物,其寄主多达35个科,超过55个属[1-2]。该虫主要以若虫和雌成虫刺吸为害植物的茎叶和果实,造成叶片褪绿黄化,枝条干枯,果实品质下降,危害损失可达20-80%,严重时整株死亡[3]。木瓜秀粉蚧原产于墨西哥和中美洲地区,目前在我国云南、海南、广西、广东及台湾等地造成的为害日趋严重,严重威胁当地木薯、木瓜产业可续持发展[4]。
寄主植物所含次生代谢物质对害虫具有驱避、抑食甚至致死效应,而对应地害虫在长期的协同进化中体内形成了一套保护酶系统以形成寄主取食选择性。目前,研究较多的保护酶系主要有过氧化物酶(Peroxidase,POD)、多酚氧化酶(Polyphenol oxidase,PPO)、超氧化物歧化酶(Superoxide dismutase,SOD)和过氧化氢酶(Catalase,CAT)[5]。大量研究表明,害虫取食寄主作物时其体内保护酶活性显著升高可以减轻或者免受寄主有毒物质毒害,这在木薯-朱砂叶螨(SOD、CAT)[6]、桃蚜-辣椒(SOD、CAT、POD)[7]、棉蚜-西瓜(SOD、CAT)[8]、茶尺蠖-茶树(PPO)[9]、的互作研究中得到了印证。而害虫保护酶活性显著被抑制则不利于其进一步取食为害,这在木薯-二斑叶螨(POD、PPO)[10],橡胶树-六点始叶螨(SOD、CAT)[11]的互作研究中被证实。然而迄今为止,尚缺乏木瓜秀粉蚧取食不同木薯品种前后保护酶活性变化的研究,以致无法深入了解木瓜秀粉蚧的寄主选择性机理。因此,本研究分析测定了木瓜秀粉蚧取食不同木薯品种前后保护酶POD、PPO、CAT和SOD活性变化,旨为深入探讨木瓜秀粉蚧的寄主选择性机理奠定良好的前期工作基础。
1 材料与方法 1.1 材料 1.1.1 供试粉蚧木瓜秀粉蚧P.marginatus为中国热带农业科学院环境与植物保护研究所特色热带作物害虫研究室室内用木薯品种BRA900继代饲养的实验种群。将木瓜秀粉蚧按每叶100头雌成虫分别接于长×宽为25 cm × 19 cm的白瓷盘中湿润海绵上的不同木薯品种叶片背面,并饲养于25±1℃、相对湿度为75±5%、光照周期14(L):10(D)的人工气候箱中。饲养48 h后收集发育一致的雌成虫用于酶液提取,每个品种设置3个重复。
1.1.2 供试木薯品种木薯品种BRA900,SC205、ZM9066、C1115、瑞士F21和缅甸种均由中国热带农业科学院热带品种资源研究所国家木薯种质资源圃提供,其中BRA900为本研究的对照品种。
1.2 方法 1.2.1 酶液提取将各处理木瓜秀粉蚧,在冰浴状态下按100头/1.5 mL用20%的灭菌蔗糖溶液提取(0.5 mL研磨,再分别用0.5 mL洗两次),然后将提取液置于2 mL离心管中,在4℃条件下7 000 r/min离心15 min,取上清液并用20%的灭菌蔗糖溶液定容至2 mL,置于-20℃保存,用于POD、PPO、CAT和SOD活性测定。
1.2.2 POD活性测定参考陈青等[12]方法。在1.5 mL离心管中依次加入0.2 mL醋酸缓冲液(0.2 mol/L,pH 5.0),0.1 mL 1 g/L邻甲氧基苯酚,0.04 mL酶液,0.1 mL 0.08%的过氧化氢溶液,而对照管中将过氧化氢溶液改为0.1 mL蒸馏水,反应60 min,470 nm波长测OD值。
1.2.3 PPO活性测定参考Liang等[10]方法。在1.5 mL离心管中依次加入0.2 mL 0.02 mol/L邻苯二酚溶液,0.2 mL磷酸缓冲液(0.05 mol/L,pH 6.8),0.05 mL酶液,而对照管中不加酶液处理。在30℃下反应2 min,398 nm波长下测OD值。
1.2.4 CAT活性测定参考Lu等[6]方法。在1.5 mL离心管中依次加入0.2 mL磷酸缓冲液(pH 7.2),0.133 3 mL过氧化氢溶液(0.1 mol/L),0.04 mL酶液,而对照管将酶液改为0.04 mL蒸馏水。于30℃水浴15 min后,用10%硫酸0.266 7 mL终止反应,摇匀,在415 nm下测OD值。
1.2.5 SOD活性测定参照Lu等[6]的方法。邻苯三酚自氧化速率的测定:吸取1.50 mL Tris缓冲溶液于一个1.5 mL离心管中作为零管,另吸取1.45 mL Tris缓冲溶液于另一个1.5 mL离心管中作为测定管。将两离心管放入25℃恒温水浴10 min后取出,于测定管中加入0.05 mL邻苯三酚溶液,迅速混匀,立即于325 nm波长,以零管调零,在4 min内每30 s测OD值一次。
1.2.6 样品测定吸取Tris缓冲溶液1.00 mL于一个1 cm石英比色杯中,作为零管;另吸取Tris缓冲溶液0.933 mL于另一个1 cm石英比色杯中,作为测定管。将两比色杯放入25℃恒温水浴中,10 min后取出,于测定管中加入0.10 mL样品滤液,混匀,再加入0.033 mL邻苯三酚溶液,迅速混匀,立即于325 nm波长,以零管调零,在4 min内每30 s测OD值1次。
1.2.7 数据分析采用SPSS软件Duncan’s新复极差法进行差异显著性检验,比较和统计分析取食不同木薯品种后木瓜秀粉蚧雌成虫体内保护酶活性相对比率(%),其中木瓜秀粉蚧取食对照木薯品种BRA900后的保护酶活性设定为100%,取食其它木薯品种后的对应保护酶活性相对比率(%)=取食其他木薯品种保护酶活性/取食对照木薯品种BRA900保护酶活性×100%。显著性水平为α=0.05。
2 结果 2.1 木瓜秀粉蚧取食不同木薯品种前后雌成虫体内POD活性差异分析由图 1可以看出,取食不同品种木薯叶片后木瓜秀粉蚧体内POD活性存在显著差异。与取食木薯品种BRA900相比,取食SC205和ZM9066品种后木瓜秀粉蚧体内POD活性无显著差异,而取食C1115、瑞士F21和缅甸种后虫体内POD活性仅分别为取食BRA900后POD活性的44.0%、42.2%和43.8%并且差异显著(P<0.05)。

|
| 图 1 木瓜秀粉蚧取食不同木薯品种后POD活性差异 木瓜秀粉蚧取食不同木薯品种后的酶活性变化以取食BRA900的酶活的相对百分率表示,误差线上不同字母表示酶活性变化在不同木薯品种上差异显著(P<0.05),下同 |
由图 2可以看出,取食不同品种木薯叶片后的木瓜秀粉蚧体内PPO活性存在显著差异。与取食木薯品种BRA900相比,取食SC205和ZM9066品种后木瓜秀粉蚧体内PPO活性无显著差异,而取食C1115、瑞士F21和缅甸种后虫体内POD活性仅分别为取食BRA900后PPO活性的62.3%、62.7%和63.5%并且差异显著(P<0.05)。
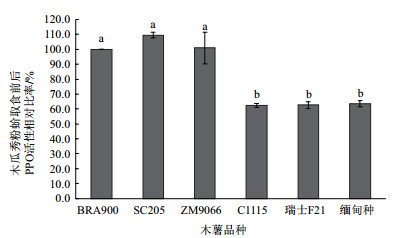
|
| 图 2 木瓜秀粉蚧取食不同木薯品种后PPO活性差异 |
由图 3可以看出,取食不同品种木薯叶片后的木瓜秀粉蚧体内CAT活性存在显著差异。与取食木薯品种BRA900相比,取食SC205和ZM9066品种后木瓜秀粉蚧体内CAT活性无显著差异,而取食C1115、瑞士F21和缅甸种后虫体内CAT活性仅分别为取食BRA900后CAT活性的52.9%、35.9%和44.0%并且差异显著(P<0.05)。
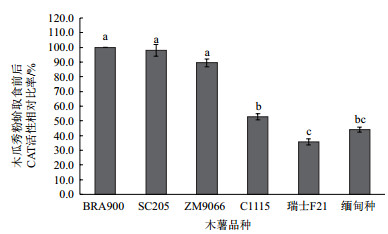
|
| 图 3 木瓜秀粉蚧取食不同木薯品种后CAT活性差异 |
由图 4可以看出,取食不同品种木薯叶片后的木瓜秀粉蚧体内SOD活性存在显著差异。与取食木薯品种BRA900相比,取食SC205和ZM9066品种后木瓜秀粉蚧体内SOD活性无显著差异,而取食C1115、瑞士F21和缅甸种后虫体内SOD活性仅分别为取食BRA900后SOD活性的55.7%、50.3%和50.8%并且差异显著(P<0.05)。
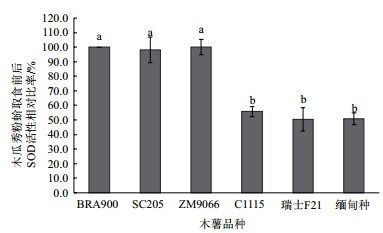
|
| 图 4 木瓜秀粉蚧取食不同木薯品种后SOD活性差异 |
POD、PPO、CAT和SOD活性差异分析结果一致,木薯品种C1115、瑞士F21和缅甸种对木瓜秀粉蚧体内SOD活性具有显著抑制作用,不适宜木瓜秀粉蚧取食,而SC205、ZM9066和BRA900对木瓜秀粉蚧体内SOD活性无显著抑制作用,均适宜木瓜秀粉蚧取食。
3 讨论作物被害虫为害时,体内的次生代谢物质能够对害虫产生趋避和抑食作用[13-14],其中一个重要的途径是抑制害虫体内保护酶活性[15-16]。在害虫体内,SOD是害虫对抗活性氧自由基(Reacticve oxygen species,ROS)为害的第一道防线[17],CAT和POD将活性氧分解为水和氧气以减轻氧化损伤[18],而PPO则是昆虫体内重要的免疫蛋白[19]。这些保护酶一旦被抑制,将极大影响害虫对作物的取食能力。例如对森林天幕毒蛾和白斑毒蛾的研究表明[20],两种毒蛾取食寄主植物时摄入的单宁酸均能够显著抑制中肠SOD、CAT和POD的活性而不利于其为害。刘佳妮等[15]研究发现马铃薯块茎蛾幼虫取食含有烟碱的寄主植物后SOD和CAT活性被显著抑制,且抑制随着饲养代数的增加呈先升高后降低的趋势。Aucoin[21]研究发现綠缺口尺蛾幼虫取食富含金丝桃素的贯叶连翘后发现POD和PPO的活性均受到显著抑制,并且抑制程度与摄入的浓度大小成正比。我们前期研究也发现,朱砂叶螨取食抗螨木薯品种后,体内SOD、CAT、POD和PPO活性均被显著抑制,而取食感螨木薯品种后活性无显著变化[6, 10];六点始叶螨取食抗螨橡胶树品种后,同样发现体内上述4种保护酶的活性与取食感螨橡胶树品种相比收到显著抑制[11]。本研究结果表明,取食不同木薯品种后木瓜秀粉蚧体内的保护酶存在明显差异,取食木薯品种C1115、瑞士F21和缅甸种的木瓜秀粉蚧体内POD、PPO、SOD和CAT的活性较取食品种BRA900、SC205和ZM9066的木瓜秀粉蚧保护酶活性显著降低,表明木瓜秀粉蚧取食BRA900、SC205和ZM9066后能够正常启动活性氧清除机制以应对摄入的次生代谢物质造成的氧化损伤,从而有利于其在上述3种木薯品种上发生为害,而摄入C1115、瑞士F21和缅甸种后木瓜秀粉蚧自身保护机制受到显著抑制,不适宜木瓜秀粉蚧取食,
本研究中木瓜秀粉蚧4种保护酶受到显著抑制的变化趋势与此前在木薯和橡胶害螨上的研究结果相似,但由于寄主和害虫(螨)种类的差别,其机理是否具有一致性仍有待进一步研究。此外,吴丰年[22]等研究了不同离体寄主及对亚洲柑桔木虱存活的影响,发现九里香嫩梢离体后对卵的孵化率影响较大,而酸桔和马水桔离体叶片使柑桔木虱若虫的发育历期延长,作者推断这可能与离体叶片营养成分较植株缺乏有关。因此,本研究采用离体木薯叶片展开平行试验虽然也能反应出木瓜秀粉蚧对不同寄主植物的潜在取食趋性,为深入探讨其寄主选择性奠定前期工作基础。后续研究中还应进一步考虑离体叶片饲养对木瓜秀粉蚧生长发育及保护酶活性的影响,以便全面客观反应木瓜秀粉蚧取食不同木薯叶片的保护酶变化趋势。
4 结论本研究发现木瓜秀粉蚧取食木薯品种C1115、瑞士F21和缅甸种后体内POD、PPO、SOD和CAT的活性较取食品种BRA900、SC205和ZM9066的木瓜秀粉蚧相同保护酶活性显著降低(P<0.05),表明BRA900、SC205和ZM9066对该虫保护酶活性无显著抑制作用,易于被取食为害,而C1115、瑞士F21和缅甸种因其对保护酶的较强抑制作用不利于其取食。
| [1] |
Saengyot S, Burikam I. Host plants and natural enemies of papaya mealybug, Paracoccus marginatus(Hemiptera:Pseudococcidae)in Thailand[J]. Thai Journal of Agricultural Science, 2011, 44(3): 197-205. |
| [2] |
Galanihe LD, Jayasundera MUP, Vithana A, et al. Occurrence, distribution and control of papaya mealybug, Paracoccus marginatus(Hemiptera:Pseudococcidae), an invasive alien pest in Sri Lanka[J]. Tropical Agricultural Research & Extension, 2011, 13(3): 81-86. |
| [3] |
Mastoi MI, Azura AN, Muhamad R, et al. Survey of papaya mealybug, Paracoccus marginatus(Hemiptera:Pseudococcidae)and its natural enemies in Penninsular Malaysia[J]. Pakistan Journal of Agriculture Agricultural Engineering Veterinary Sciences, 2014, 21(6): 72-78. |
| [4] |
卢辉, 卢芙萍, 梁晓, 等. 木瓜秀粉蚧在海南的适生性及空间分布型研究[J]. 热带作物学报, 2016, 37(10): 62-68. |
| [5] |
Lu F, Chen Q, Chen Z, et al. Effects of heat stress on development, reproduction and activities of protective enzymes in Mononychellus mcgregori[J]. Exp Appl Acarol, 2014, 63(2): 267-284. DOI:10.1007/s10493-014-9784-0 |
| [6] |
Lu F, Liang X, Lu H, et al. Overproduction of superoxide dismutase and catalase confers cassava resistance to Tetranychus cinnabarinus[J]. Scientific Reports, 2017, 7(40179). |
| [7] |
陈青, 张银东. 3种氧化酶与辣椒抗蚜性的相关性[J]. 热带作物学报, 2004, 25(3): 42-46. |
| [8] |
徐雪莲, 张银东, 符悦冠, 等. 蚜虫侵害对西瓜保护酶活性的影响[J]. 北方园艺, 2014, 12(1): 109-111. |
| [9] |
Yang ZW, Duan XN, Jin S, et al. Regurgitant derived from the tea geometrid Ectropis obliqua suppresses wound-induced polyphenol oxidases activity in tea plants[J]. Journal of Chemical Ecology, 2013, 39(6): 744-752. DOI:10.1007/s10886-013-0296-x |
| [10] |
Liang X, Chen Q, Lu H, et al. Increased activities of peroxidase and polyphenol oxidase enhance cassava resistance to Tetranychus urticae[J]. Exp Appl Acarol, 2017, 71(3): 195-203. DOI:10.1007/s10493-017-0125-y |
| [11] |
Lu F, Chen Z, Lu H, et al. Effects of resistant and susceptible rubber germplasms on development, reproduction and protective enzyme activities of Eotetranychus sexmaculatus (Acari:Tetranychidae)[J]. Exp Appl Acarol, 2016, 69(4): 427-433. DOI:10.1007/s10493-016-0049-y |
| [12] |
陈青. 几种生化物质与辣椒抗蚜性的相关性[J]. 园艺学报, 2002, 29(6): 533-536. |
| [13] |
王琦, 董合忠. 棉花次生代谢物质及其抗虫活性研究进展[J]. 棉花学报, 2013, 25(6): 557-563. |
| [14] |
郭广君, 孙帅, 王孝宣, 等. 番茄抗B型烟粉虱相关叶表腺毛性状及其次生代谢物质分析[J]. 园艺学报, 2016, 43(8): 1493-1503. |
| [15] |
刘佳妮, 黄鹤平, 华金珠, 等. 烟碱对马铃薯块茎蛾幼虫保护酶和解毒酶的影响[J]. 贵州农业科学, 2015, 2(3): 78-81. |
| [16] |
张秀丽, 王炎, 徐东, 等. 桑叶提取物1-DNJ对甜菜夜蛾幼虫生长和保护酶活性的影响[J]. 中国农学通报, 2014, 30(22): 316-320. DOI:10.11924/j.issn.1000-6850.2014-0413 |
| [17] |
Apel K, Hirt H. Reactive oxygen species:metabolism, oxidative stress, and signal transduction[J]. Annual Review of Plant Biol, 2004, 55(4): 373-382. |
| [18] |
Mittler R. Oxidative stress, antioxidants and stress tolerance[J]. Trends in Plant Science, 2002, 7(9): 405-410. DOI:10.1016/S1360-1385(02)02312-9 |
| [19] |
Heng-Moss T, Sarath G, Baxendale F, et al. Characterization of oxidative enzyme changes in buffalograsses challenged by Blissus occiduus[J]. J Econ Entomol, 2004, 97(3): 1086-1095. DOI:10.1093/jee/97.3.1086 |
| [20] |
Barbehenn RV. Gut-based antioxidant enzymes in a polyphagous and a graminivorous grasshopper[J]. Journal of Chemical Ecology, 2002, 28(7): 1329-1335. DOI:10.1023/A:1016288201110 |
| [21] |
Aucoin RR, Philogène BJR, Arnason JT. Antioxidant enzymes as biochemical defenses against phototoxin-induced oxidative stress in three species of herbivorous lepidoptera[J]. Archives of Insect Biochemistry & Physiology, 1991, 16(2): 139-152. |
| [22] |
吴丰年, 岑伊静, 梁广文. 不同离体寄主及其成熟度对亚洲柑桔木虱存活的影响[J]. 应用昆虫学报, 2015(3): 679-685. DOI:10.7679/j.issn.2095-1353.2015.079 |




