2. 内蒙古大学哺乳动物生殖生物学及生物技术教育部重点实验室,呼和浩特010070
2. Key Laboratory of Mammalian Reproductive Biology and Biotechnology of Ministry of Education, Inner Mongolia University, Huhehot 010070
毛囊组织被称为动态的微小器官,随着机体的一生不断周期性生长[1]。它不仅具有保护皮肤组织受损、感觉、免疫防护等重要的生物学功能,还包含多种干细胞维持着毛囊组织的体内平衡。而毛囊的形态发生和再生均离不开毛囊干细胞(Hair follicle stem cells,HFSCs)。HFSCs因其获取方便、创伤小、增殖能力强、可在体外多向分化等优势,日渐成为生物学与医学领域的前沿[2-4]。国际上主要以小鼠和人的HFSCs为研究对象,对其鉴定标记、分化能力、应用等方面有了较多的研究。对其它大动物如山羊、绵羊、马等的毛囊研究较少。
阿尔巴斯绒山羊是内蒙古地区肉绒兼备的优良品种,所产的高品质羊绒具有柔软、光滑、纤细的特性[5]。绒山羊是羊绒产品的主要来源。绒毛生长是一个复杂的过程,受环境、营养和遗传等因子的影响[6]。随着近些年自然环境的破坏、品种间的杂交,绒山羊的绒毛品质也受到了不同程度的影响。保护绒山羊纯种和保证绒毛优良品质是畜牧业及其产品发展的前提。在体外分离培养毛囊干细胞并对其进行生物学特性研究是探索毛发形态发生机制和毛囊多样性的基础。在之前的研究中,我们分离培养了阿尔巴斯绒山羊毛囊干细胞(gHFSCs),并对其进行了分化能力和多能性分析[7-8]。但目前gHFSCs的研究还较少,因此鉴定标记也较模糊。
本研究参考小鼠和人毛囊学领域的研究,选取了广泛被应用的标记Krt15、Krt19、CD34[9]和Sox9[10],检测它们在阿尔巴斯绒山羊皮肤组织中的表达情况,旨在为今后在体外分类培养毛囊细胞提供鉴定标记选择的实验依据。
1 材料与方法 1.1 材料 1.1.1 仪器冰冻切片机Leica CM1900,共聚焦显微镜Nikon A1 confocal。
1.1.2 试剂包埋剂(Tissue-Tek4583,OCT,SAK-URA),4%多聚甲醛(P6148,Sigma),TritonX-100(9002-93-1,Sigma),山羊血清(SL2-10,Solarbio),PBS(SH30028,Hyclone)。RNAiso Plus(9109),Prime ScriptTM RT reagent kit(RR047A)和SYBRR-Premix Ex Taq(RR820A)均购自宝生物技术有限公司。实验中所用到的Sox9抗体(ab185966)、Krt15抗体(ab52816)、krt19抗体(ab52625)、CD34抗体(ab81289)及Cy3标记二抗(ab6939)均购自Abcam(USA,Cambridge)公司。
1.1.3 皮肤样阿尔巴斯绒山羊皮肤组织由内蒙古亿维白绒山羊种羊场提供。
1.1.4 细胞gHFSCs为实验室保存(gHFSCs的分离鉴定及培养方法见参考文献[7]。
1.2 方法 1.2.1 冰冻切片免疫组化待切片机温度降至-20℃,进行组织包埋(-20℃,15 min)将其固定在切片机圆盘上。调厚度为8 μm进行切片。小心将切片贴附于载玻片上,滴加4%多聚甲醛室温固定15 min后,0.5% TritonX-100通透10 min,PBS清洗(×3)。10%正常山羊血清(PBS稀释)室温封闭1 h,倾去血清,滴加1:300稀释的(封闭液稀释)相应的一抗,4℃孵育过夜。次日滴加1:500稀释的(PBS稀释)Cy3标记的二抗37℃避光孵育45 min。PBS清洗(×3次)。最后1:1 000稀释(PBS稀释)的DAPI避光复染10 min,PBS清洗。全部染色结束后,进行共聚焦显微镜照相(A1 confocal microscope,Nikon,Japan)。
1.2.2 gHFSCs复苏培养紫外灯照射超净工作台30 min,预热细胞培养液后,将其放入超净台。从液氮罐中取出冻存管,于37℃水浴锅中快速解冻。待管内液体全部融化后,移至超净台中。吸取适量细胞培养液与解冻细胞按1:10比例加入离心管中,轻轻混匀,800 r/min离心5 min,去上清。加入适量培养液重悬细胞,接种到六孔板中,置于37℃、5% CO2培养箱中培养,次日换液。细胞汇合度达到80%时进行传代培养。
1.2.3 生长曲线检测细胞传代的同时一部分细胞进行计数,按1×104个/mL量接种到24孔板中。每24 h消化3个孔进行细胞计数。连续计数8 d,以每次所计平均数和时间绘制细胞生长曲线。
1.2.4 细胞免疫组化按1×105个/mL将细胞接种到24孔板(圆盖玻片)中,当细胞汇合度达70%左右,弃掉培养液,加入4%多聚甲醛在室温固定10 min。弃掉固定液,PBS清洗(×3),加入0.05% Triton X-100,室温通透10 min(标记为膜蛋白时不做通透)。封闭、孵抗体、复染步骤与冰冻切片免疫组化操作相同,不再赘述。
1.2.5 实时定量PCR根据GenBank中基因序列设计了绒山羊Krt15、CD34和Sox9特异引物(NCBI中未找到山羊krt19的序列),通过实时定量PCR的方法检测选取的标记基因在个gHFSCs中RNA水平表达。引物序列见表 1。RNAiso Plus裂解细胞提取总RNA。用PrimeScriptTM RT反转录试剂盒将提取的RNA反转录成cDNA备用。实时定量PCR反应体系为2×SYBR Green混合液10 μL,上下游引物各0.5 μL,模板1 μL,无酶水8 μL,总体积为20 μL。实时定量PCR程序为95℃预变性30 s后进行40个95℃5 s,60℃30 s的循环。以GAPDH为内参基因,同一组织来源的角质细胞(Goat keratinocytes,gKCs)为对照细胞,每个基因mRNA相对水平通过3次重复实验的数据,用2-ΔΔCt法计算。
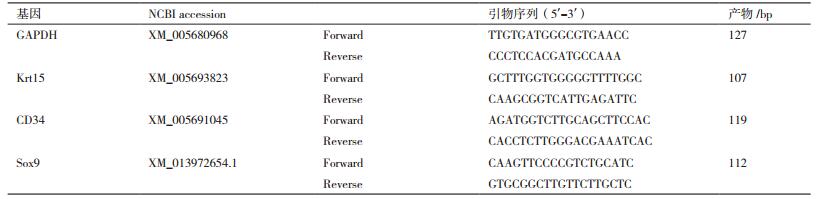
冰冻切片免疫组化显示(图 1),4个标记蛋白在初级毛囊外根鞘中均表达,且可区别。Krt15和Krt19表达位置相似,均在隆突部较强表达,且稳定,在隆突部下端呈不连续表达;CD34在隆突部和隆突部下端都有表达,且在隆突部下端的表达较强;Sox9集中在隆突部表达,在毛球部也有少许表达。即Krt15、Krt19、CD34和Sox9在隆突部均表达。
|
| 图 1 皮肤组织冰冻切片免疫组化 Krt角蛋白,bulge隆突部;红色为对应的标记,蓝色为DAPI染核。标尺100 μm |
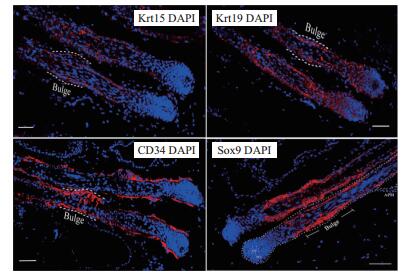
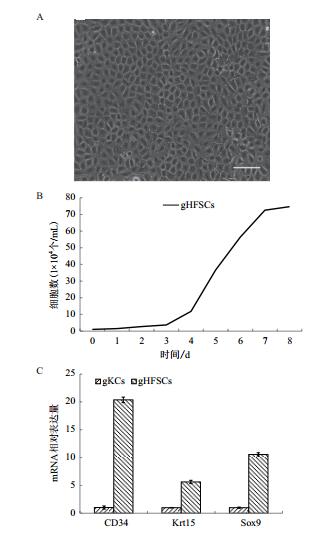
对应皮肤组织冰冻切片实验,在体外培养的gHFSCs中进行了细胞免疫组化染色。复苏培养后的细胞铺路状生长,细胞连接紧密,贴附能力好,立体形态似巢,保持着毛囊干细胞的形态特征(图 2-A)。从接种1-3 d,细胞生长缓慢,处于潜伏期;第4天开始迅速增殖进入对数生长期;从第7天开始细胞生长速度减慢,出现少量凋亡,逐渐进入平台期,呈现典型的潜伏期、对数生长期和平台期(图 2-B),说明生长状态良好,可以用于后续检测试验。实时定量PCR检测了Krt15、Krt19、CD34和Sox9在gHFSCs中转录水平的表达(图 2-C)。对其进行细胞免疫组化实验,结果(图 3)显示Krt15、Krt19、CD34和Sox9在gHFSCs中均呈阳性表达。
|
| 图 2 体外分离培养的阿尔巴斯绒山羊毛囊干细胞(gHFSCs) A:复苏培养的gHFSCs。标尺100 μm;B:生长曲线 |
|
| 图 3 体外培养的gHFSCs细胞免疫组化染色 红色为对应标记,蓝色为DAPI染核。标尺100 μm |
根据以上免疫组化的结果,绘制了可作为内蒙古绒山羊毛囊干细胞候选鉴定标记的Krt15、Krt19、CD34和Sox9在阿尔巴斯绒山羊毛囊组织中的表达位置示意图(图 4)。
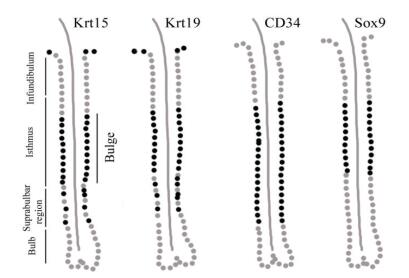
|
| 图 4 Krt15、Krt19、CD34和Sox9表达位置的示意图 Bulb:毛球部;Suprabulbar region:毛球上端或隆突底端;Isthmus:峡部;Infundibulum:漏斗部;黑色表示对应标记的阳性表达 |
由于物种之间的差异和毛囊中干细胞种类较多,选取标记蛋白时存在一定难度。在小鼠的研究中发现,表达Krt15的细胞可参与皮肤及附件组织的发生和再生所需的全部细胞系,具有较强的克隆形成能力[11]。Krt19是另一个主要的鉴定标记,在隆突部和隆突部底端表达[12]。在已有的皮肤基底层细胞培养中用Krt15和Krt19作为鉴定标记[13]。整合素β1也被用于人HFSCs的鉴定,但整合素β1在基底层细胞研究中应用较多,被报道与基底层细胞增殖能力相关[14]。在我们之前的研究中也发现,整合素β1在体外培养的gHFSCs中转录水平和蛋白水平表达均较少,因此在本实验中未对其进行检测。CD34是小鼠皮肤干细胞的标记物,且在毛囊隆突部中与Krt15共表达[15]。随着干细胞特性、多能性维持的不断研究,转录因子成为了热点,而干细胞自我更新和分化之间的平衡是通过一些转录因子的动态调控来维持的[16]。在小鼠中的研究得出Sox9是毛囊干细胞超级增强子(Super-enhancers)中关键的染色质“变阻器”,是毛囊干细胞中动态的、密集的转录因子结合平台,调控谱系决定和分化中干细胞的时空状态、干性和可塑性[17]。在发育时期和成体中,毛囊干细胞的发生和分化均受Sox9的影响[10]。
根据以上分析,本实验选取了Krt15、Krt19、CD34和Sox9作为gHFSCs候选鉴定标记,对其进行了皮肤组织和细胞的免疫组化实验。从皮肤组织冰冻切片结果可以看出,Krt15、Krt19、CD34和Sox9均表达的部位为毛囊隆突部。隆突部来源的干细胞应为以上4个候选标记均阳性。复苏后的gHFSCs形态和生长情况均良好,细胞免疫组化结果显示,体外培养的gHFSCs为Krt15、Krt19、CD34和Sox9均阳性,与毛囊组织切片的结果吻合,证明在我们之前实验中得到的细胞确实为隆突部毛囊干细胞,且这4种蛋白可作为隆突部来源的毛囊干细胞的鉴定标记。冰冻切片的结果表明,Krt15和Krt19在隆突部表达情况相同,在今后的实验中可以选择Krt15、Krt19两者或其一作为gHFSCs鉴定标记;CD34在隆突部下端的表达比隆突部强,所以CD34需与其他标记结合起来应用于gHFSCs鉴定;在毛囊组织中Sox9集中在隆突部表达,是最理想的gHFSCs鉴定标记。已有的研究和本研究中的细胞免疫组化实验证明,Krt15、Krt19主要在细胞质内表达;Sox9在细胞质和细胞核内均表达;CD34为细胞膜蛋白。毛囊细胞的分离方法主要有流式分选、组织贴壁培养,因此根据具体分离方法和抗体的情况选择标记蛋白。流式分选可选择CD34+Krt15(Krt19)、Sox9或者CD34+Sox9;组织贴壁培养可选择与流式分选相同的抗体,也可选择细胞质蛋白和核蛋白的组合。
4 结论本研究借助免疫组化的方法确定了Krt15、Krt19、CD34和Sox9均表达的部位为隆突部,且在体外培养的gHFSCs中均呈阳性表达,因此可作为阿尔巴斯绒山羊毛囊隆突部来源的毛囊干细胞的鉴定标记。综合分离方法及实验需求建议在体外分离培养绒山羊毛囊干细胞时选择Krt15/Krt19、CD34和Sox9作为的鉴定标记。
| [1] |
Schneider MR, Schmidt-Ullrich R, Paus R. The hair follicle as a dynamic miniorgan[J]. Curr Biol, 2009, 19: R132-R142. DOI:10.1016/j.cub.2008.12.005 |
| [2] |
Amoh Y, Li L, Katsuoka K, et al. Multipotent nestin-positive, keratin-negative hair-follicle bulge stem cells can form neurons[J]. PNAS, 2005, 102: 5530-5534. DOI:10.1073/pnas.0501263102 |
| [3] |
Bajpai VK, Mistriotis P, Andreadis ST. Clonal multipotency and effect of long-term in vitro expansion on differentiation potential of human hair follicle derived mesenchymal stem cells[J]. Stem Cell Res, 2012, 8: 74-84. DOI:10.1016/j.scr.2011.07.003 |
| [4] |
Mistriotis P, Andreadis ST. Hair follicle:a novel source of multipotent stem cells for tissue engineering and regenerative medicine[J]. Tissue Eng Part B Rev, 2013, 19: 265-278. |
| [5] |
刘晓芳, 张萍, 刘少卿, 等. 内蒙古白绒山羊保种及开发利用的研究与应用[J]. 中国畜牧兽医, 2005, 32(10): 34-36. DOI:10.3969/j.issn.1671-7236.2005.10.015 |
| [6] |
王宏博, 高雅琴. 影响绒山羊产绒性能和绒毛品质的因素及其研究进展[J]. 中国食草动物, 2007, 27(4): 62-63. |
| [7] |
He N, Dong Z, Tao L, et al. Isolation and characterization of hair follicle stem cells from Arbas Cashmere goat[J]. Cytotechnology, 2016, 68: 2579-2588. DOI:10.1007/s10616-016-9981-2 |
| [8] |
He N, Dong Z, Zhu B, et al. Expression of pluripotency markers in Arbas Cashmere goat hair follicle stem cells[J]. In Vitro Cell Dev Biol-Animal, 2016, 52: 782-788. DOI:10.1007/s11626-016-0023-3 |
| [9] |
Purba TS, Haslam IS, Poblet E, et al. Human epithelial hair follicle stem cells and their progeny:Current state of knowledge, the widening gap in translational research and future challenges[J]. Bioessays, 2014, 36: 513-525. DOI:10.1002/bies.v36.5 |
| [10] |
Vidal VP, Chaboissier MC, et al. Sox9 is essential for outer root sheath differentiation and the formation of the hair stem cell compartment[J]. Current Biology, 2005, 15: 1340-1351. DOI:10.1016/j.cub.2005.06.064 |
| [11] |
Bose A, Teh MT, et al. Keratin k15 as a biomarker of epidermal stem cells[J]. Int J Mol Sci, 2013, 14(10): 19385-98. DOI:10.3390/ijms141019385 |
| [12] |
Commo S, Gaillard O, Bernard BA. The human hair follicle contains two distinct K19 positive compartments inthe outer root sheath:a unifying hypothesis for stem cell reservoir?[J]. Differentiation, 2000, 66: 157-164. DOI:10.1111/(ISSN)1432-0436 |
| [13] |
乃门塔娜, 梁红宇, 等. 阿尔巴斯绒山羊胎儿皮肤干细胞的分离培养及鉴定[J]. 中国细胞生物学学报, 2016, 38(2): 143-149. |
| [14] |
Ernst N, Yay A, Bíró T, et al. β1integrin signaling maintains human epithelial progenitor cell survival in situ and controls proliferation, apoptosis and migrationof their progeny[J]. PLoS One, 2013, 8(12): e84356. DOI:10.1371/journal.pone.0084356 |
| [15] |
Poblet E, Jimenez F, et al. The immunohistochemical expression of CD34 in human hair follicles:A comparative study with the bulge marker CK15[J]. Clin Exp Dermatol, 2006, 31(6): 807-12. DOI:10.1111/ced.2006.31.issue-6 |
| [16] |
Warren AW, David AO, Denes H, et al. Master transcription factors and mediator establish super enhancers at key cell identity genes[J]. Cell, 2013, 153(2): 307-319. DOI:10.1016/j.cell.2013.03.035 |
| [17] |
Rene CA, Hanseul Y, Shira R, et al. Pioneer factors govern super-enhancer dynamics in stem cell plasticity and lineage choice[J]. Nature, 2015, 521(7552): 366-370. DOI:10.1038/nature14289 |