随着城市化提高和对空气质量的要求,许多城市对家庭和餐饮店油烟机尾气排放提高要求。我国食用油在2016年消耗约3 000万t,按照15%的排放量,则产生约450万t地沟油,其中约30万t来自清洗抽油烟机时倒入下水道产生的[1]。大量的抽油烟机废油直接排入下水道,没有适当的处理,这对市政的生物废水处理过程有较大负面影响。因此,抽油烟机废油的回收和有效处置已经成为迫切解决的问题。抽油烟机废油的主要成分为顺式、反式游离脂肪酸、脂肪甘油酯和盐,能被铜绿假单胞杆菌利用生产生物表面活性剂鼠李糖脂[2]。
生物表面活性剂(Biosurfactant)是一种天然的具有亲水、亲脂性质的物质,主要通过微生物发酵获得,常见有鼠李糖脂、槐糖脂、脂肽、中性类脂衍生物或多糖脂等[3],其中研究最早和最多的是铜绿假单胞菌所产生的鼠李糖脂[4]。鼠李糖脂是一种阴离子生物表面活性剂,其结构由1-2个鼠李糖(亲水基)链接1-2个饱和或不饱和的脂肪酸(疏水基)构成[5],主要通过假单胞菌、伯克氏菌、不动杆菌和肠动杆菌属代谢产生,但是不同的菌株代谢活性差异较大,鼠李糖脂的产量、表面活性及同系物的组成也会有所不同[6-8]。鼠李糖脂在石油工业、日用化工、食品领域和农业领域拥有广阔的应用前景,但鼠李糖脂的工业化生产受限于较高的原料成本、泡沫控制成本和高昂的提取纯化费用。目前鼠李糖脂的发酵一般以油料为底物,如豆油[9]、棕榈油[10]、玉米油[11]和葵花籽油[12],其中以豆油为碳源生产的鼠李糖脂的产量可达70.6 g/L。但是以油料为底物存在发酵成本过高、产品提取纯化工艺复杂的问题。近几年来,寻找鼠李糖脂发酵的廉价替代碳源已经成为研究热点,如地沟油、植物油炼油废弃物、工业废弃脂肪酸[13]和厨房油炸剩下废食用油[14-16]。此外,制造生物柴油的副产物甘油也可以应用鼠李糖脂发酵,只是发酵周期比较长且泡沫难以控制[17]。总体来看,发酵产鼠李糖脂的原料占据较高成本,阻碍其大规模应用。
目前很少有文献和专利报道抽油烟机废油再利用技术,相对简单的利用有做肥皂[18]和固体酒精[19],或作为增塑剂合成的原料[20]。本研究主要探讨利用从中式抽油烟机收集的废油脂为底物发酵产鼠李糖脂的可能性,旨在降低生产鼠李糖脂的成本,解决因抽烟机废油直接倒入下水道所造成的环境污染问题。当然,从分散的家庭中收集油烟机废油所需成本较大,因此,在未来可以考虑特制简易微好氧发酵系统用于家庭独立发酵处理油烟机废油,本研究前期测试表明这种微好氧系统可以正常利用油烟机废油进行鼠李糖脂发酵。
1 材料与方法 1.1 材料以铜绿假单胞菌(Pseudomonas aeruginosa)WB505为出发菌体,保藏于江南大学生物工程学院生化工程研究室。
斜面培养基(g/L):氯化钠5,酵母粉5,胰蛋白胨5,琼脂20,pH 7.0(灭菌前)。
种子培养基(LB培养基,g/L):氯化钠5,酵母粉5,胰蛋白胨5,pH 7.0(灭菌前)。
发酵培养基(g/L):抽油烟机废油40,NaNO3 6,Na2HPO4·12H2O 1,KH2PO4 1,FeSO4·7H2O 0.01,MgSO4·7H2O 0.1,pH7.0(灭菌前)。
1.2 方法 1.2.1 鼠李糖脂的提取方法发酵液于12 000 r/min离心,15 min后,取上清液调节pH为2.0,加入3倍体积的乙酸乙酯试剂萃取3次。收集有机相,于60℃旋转蒸发仪去除乙酸乙酯,即得到鼠李糖脂粗提液。
1.2.2 生物量的测定取5.0 mL发酵液,于8 000 r/min离心15 min,去除上清液,并用去离子水清洗3次并放置在真空干燥箱,烘干至恒重,通过分析天平称重并计算其生物量。
1.2.3 鼠李糖脂含量的测定鼠李糖脂含量的测定采用蒽酮-硫酸法[21]。将粗提取的鼠李糖脂加蒸馏水复溶到合适的浓度,取1 mL复溶样品加入5 mL蒽酮硫酸试剂,沸水浴15 min后,冷却至室温,测定OD620值,得到的鼠李糖含量乘以系数3即可得到鼠李糖脂含量。
1.2.4 临界胶束浓度(CMC)的测定用铂金环法测定一系列不同浓度鼠李糖脂溶液的表面张力,以其浓度为横坐标,表面张力为纵坐标绘制曲线,曲线的拐点处即为此体系中表面活性剂的CMC值[22]。
1.2.5 乳化能力(E24)的测定在平底试管中加入2 mL的烷烃和鼠李糖脂溶液(1 g/L),混合液37℃预热后高速漩涡震荡2 min,乳化液37℃放置24 h后测定乳化相体积,并以乳化相体积与总体积比值(%)表示乳化能力[23]。
1.2.6 鼠李糖脂组成结构的测定本实验使用MALDI-TOF MS分析发酵所得鼠李糖脂组成[24]。使用氮气激光波长(337 nm),基质为2,5-二羟基苯甲酸,控制软件为flexControl,分析软件为flexAnalysis versison 3.3,试验方法为RP200-1500(反射模式:正离子)。
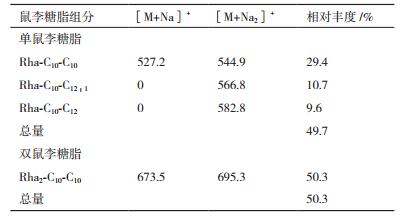
2 结果 2.1 抽油烟机废油浓度对发酵产鼠李糖脂的影响在摇瓶中测试不同浓度抽油烟机废油对P. aeruginosa WB505发酵鼠李糖脂的影响,结果如图 1所示。当抽油烟机废油为40 g/L时,鼠李糖脂的产量最大,可达到7.9±0.29 g/L。当碳源继续增加鼠李糖脂的产量下降,可能是碳源过量,形成油包水体系抑制菌体的代谢。
|
| 图 1 抽油烟机废油浓度对鼠李糖脂发酵的影响 |
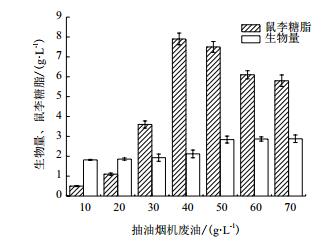
以40 g/L的抽油烟机废油为碳源,研究不同NaNO3浓度对发酵产鼠李糖脂的影响。从图 2可以看出,不同的NaNO3浓度对产鼠李糖脂有一定的影响,当NaNO3浓度为6 g/L时,鼠李糖脂的产量最高,可达到8.5±0.24 g/L。随后随着NaNO3浓度的增大鼠李糖脂的产量在逐渐的降低。
|
| 图 2 NaNO3浓度对鼠李糖脂发酵的影响 |
将培养好的种子按10%的接种量接入7 L的发酵罐中,过程曲线如图 3所示。菌体经过短暂的停滞期,培养12 h后开始进入对数生长期;随着菌体的生长,发酵液的pH值开始降低并在生物量达到最大时降至最低,随后又逐步增加并趋于稳定,这可能与生长的过程有机酸产生有关。鼠李糖脂的生成与菌体的生长并不平行,鼠李糖脂的生成滞后于菌体生长,当菌体进入对数期时鼠李糖脂的增长速度较稳定期和衰亡期缓慢,说明鼠李糖脂作为铜绿假单胞杆菌的次级代谢产物在稳定期后生成速率最大,并在80 h达到最高12.3±0.52 g/L。发酵48 h之后,发酵液的上清液的表面张力由60.5±0.81 mN/m降至26.2±0.79 mN/m,之后表面张力有稍微的上升趋势,但是基本趋于稳定,说明此时上清液的浓度已达到其临界胶束浓度。

|
| 图 3 铜绿假单胞菌WB505发酵鼠李糖脂的过程曲线 |
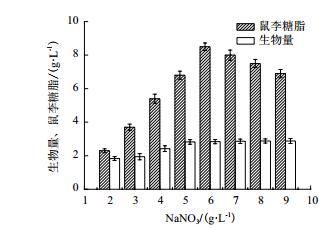
微生物发酵生产所得到的鼠李糖脂通常以混合物形式存在。本实验中利用MALDI-TOF MS确定鼠李糖脂混合物的组成并利用不同结构鼠李糖脂的相对丰度估算其含量。从图 4中可以发现,鼠李糖脂在m/z为673.3有最高峰,代表双鼠李糖脂Rha2-C10-C10的[M+Na]+加合离子。而单鼠李糖脂含量较高的峰出现在m/z 527.2处,对应产物为Rha-C10-C10,最终得到的单鼠李糖脂和双鼠李糖脂的主要成分、组成及相对丰度如图 4和表 1所示。
|
| 图 4 铜绿假单胞菌发酵生产鼠李糖脂质谱图 |
随着鼠李糖脂浓度的上升,溶液表面张力逐渐下降,当表面张力下降到一定值后继续增加鼠李糖脂浓度溶液表面张力也不再下降,说明此时已达到临界胶束浓度。从图 5可以看出,以抽油烟机废油为底物所产鼠李糖脂CMC为45.0 mg/L,能将其表面张力降低至25.3±0.68 mN/m。
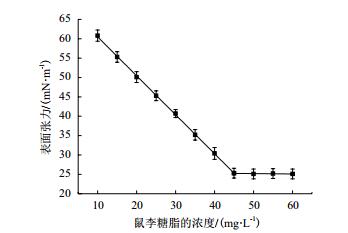
|
| 图 5 铜绿假单胞菌所产生物表面活性剂CMC测定曲线 |
鼠李糖脂与实验中的几种烃类物质充分混合后形成乳白色的乳化液,刚开始乳化相体积并不稳定,随着时间的延长,乳化体积趋于稳定,稳定时间大约是24 h。从图 6可以看出,鼠李糖脂对几种常见的烃类物质的乳化系数均超过了60%,其中对苯的乳化系数最高达到了80.3±0.85%,具有优越的工业应用价值。
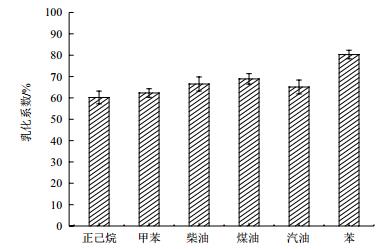
|
| 图 6 铜绿假单胞菌发酵所产得鼠李糖脂对烃类物质的乳化能力 |
本研究从环保和低成本两个角度考虑,首次以抽油烟机废油为碳源生产生物表面活性剂鼠李糖脂。抽油烟机废油是油烟冷凝而成的,成分十分复杂,含有大量的固体物质和杂质。本研究采用过滤、离心等方法进行处理,过滤后,于8 000 r/min离心15 min后取上清液即可去除固体物质。废油中主要含有一些醛类,烃类等致癌物质,有害物质对鼠李糖脂的发酵会产生很大的影响,通过研究发现可使用活性炭吸附去除部分有害物质,有利于铜绿假单胞菌生长和鼠李糖脂发酵。Lotfabad等[25]研究不同碳氮源的浓度对鼠李糖脂的影响发现,当C/N在1/10-1/30之间时,鼠李糖脂维持在较高的水平,而本实验分别以抽油烟机废油和NaNO3为碳氮源且比例为3/20时鼠李糖脂的产量最高,此实验结果也反映了铜绿假单胞菌产鼠李糖脂性能受菌株差异和培养条件的影响[26]。在7 L罐进行小试,发酵80 h时鼠李糖脂产量达到最高,且pH上升,这可能是发酵后期培养基中氮源耗尽,细胞死亡释放碱性物质致使发酵液pH升高。
临界胶束浓度(CMC)是表面活性剂分子在溶剂中缔合形成胶束的最低浓度,是评价表面活性剂性能的一个重要指标。临界胶束浓度越低,说明该表面活性剂达到界面饱和吸附所需的浓度越低,因此较低浓度的该表面活性剂即能发挥其乳化、起泡、增溶、润湿等表面活性作用。鼠李糖脂的临界胶束浓度一般5 mg/L-200 mg/L[27],发酵所产鼠李糖脂CMC为45.0 mg/L,能将其表面张力降低至25.3±0.68 mN/m,低的界面张力可以增加乳状液的稳定性[28],从而间接的表明了所产鼠李糖脂的乳化能力增加。鼠李糖脂的临界胶束浓度很大程度上取决于鼠李糖脂的组成,微生物发酵生产所得到的鼠李糖脂通常以混合物形式存在。鼠李糖脂混合物的组成对其性质有很大的影响,组成上微小的变化也可能改变其理化性质。如双鼠李糖脂抑菌效果更好,而单鼠李糖脂的临界胶束浓度更低[29]。并且鼠李糖脂的脂肪酸链越长其CMC越低,本实验获得产物中单双鼠李糖脂的比例接近1:1,使其疏水性更强[30],对于实际应用更有意义。
4 结论本研究验证了铜绿假单胞菌可以利用中式抽油烟机废油合成生物表面活性剂鼠李糖脂,在培养基中加入40 g/L抽油烟机废油和6 g/L NaNO3可以获得较高鼠李糖脂产量,结构分析表明其主要组成为含Rha-C10-C10和Rha2-C10-C10,鼠李糖脂同系物的结构与文献报道相似,且具有良好的表面活性和乳化性。
| [1] |
陈蓉, 蒋杰, 黄冉, 等. 家庭抽油烟机内的废油回收与重利用的调查分析[J]. 食品安全导刊, 2017(4Z): 62-63. |
| [2] |
Haba E, Espuny MJ, Busquets M, et al. Screening and production of rhamnolipids by Pseudomnonas aeruginosa 47T2 NCIB 40044 from waste frying oils[J]. Journal of Applied Microbiology, 2000, 88: 379-387. DOI:10.1046/j.1365-2672.2000.00961.x |
| [3] |
刘智峰. 鼠李糖脂对疏水性有机污染物降解的影响研究[D]. 长沙: 湖南大学, 2012. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2173185
|
| [4] |
Nguyen TT, Edelen A, Neighbors B, et al. Biocompatible lecithin-based microemulsions with rhamnolipid and sophorolipid biosurfactants:formulation and potential applications[J]. Journal of Colloid & Interface Science, 2010, 348(2): 498-504. |
| [5] |
Liu JF, Wu G, Yang SZ, et al. Structural characterization of rhamnolipid produced by Pseudomnonas aeruginosa strain FIN2 isolated from oil reservior water[J]. World Journal of Microbiology and Biotechnology, 2014, 30(5): 1473-1484. DOI:10.1007/s11274-013-1565-0 |
| [6] |
Hörmann B, Müller MM, Syldatk C, et al. Rhamnolipid production by Burkholderia plantarii DSM 9509T[J]. European Journal of Lipid Science and Technology, 2010, 112: 674-680. DOI:10.1002/ejlt.v112:6 |
| [7] |
Rooney AP, Price NPJ, Ray KJ, et al. Isolation and characterization of rhamnolipid-producing bacterial strains from a biodiesel facility[J]. FEMS Microbiology Letters, 2009, 295(1): 82-87. DOI:10.1111/fml.2009.295.issue-1 |
| [8] |
Christova N, Tuleva B, Lalchev Z, et al. Rhamnolipid biosurfactants produced by Renibacterium salmoninarum 27BN during growth on n-hexadecane[J]. Z Naturforsch C, 2004, 59(1-2): 70-74. |
| [9] |
Zhu L, Yang X, Xue C, et al. Enhanced rhamnolipids production by Pseudomonas aeruginosa based on a pH stage-controlled fed-batch fermentation process[J]. Bioresource Technology, 2012, 117: 208-213. DOI:10.1016/j.biortech.2012.04.091 |
| [10] |
Gong Z, Peng Y, Wang Q. Rhamnolipid production, characterization and fermentation scale-up by Pseudomonas aeruginosa with plant oils[J]. Biotechnology Letters, 2015, 37(5): 2033-2038. |
| [11] |
Linhardt R J, Bakhit R, Daniels L, et al. Microbialy produced rhamnolipid as a source of rhamnose[J]. Biotechnology and Bioengineering, 1989, 33(3): 365-368. DOI:10.1002/(ISSN)1097-0290 |
| [12] |
Muller MM, Hormann B, Syldatk C, et al. Pseudomonas aeruginosa PAO1 as a model for rhamnolipid production in bioreactor systems[J]. Applied Microbiology and Biotechnology, 2010, 87(1): 167-174. DOI:10.1007/s00253-010-2513-7 |
| [13] |
Abalos A, Maximo F, Manresa MA, et al. Utilization of response surface methodology to optimize the culture media for the production of rhamnolipids by Pseudomonas aeruginosa AT10[J]. Journal of Chemical Technology and Biotechnology, 2002, 77(7): 777-784. DOI:10.1002/(ISSN)1097-4660 |
| [14] |
Lan G, Fan Q, Liu Y, et al. Rhamnolipid production from waste cooking oil using Pseudomonas SWP-4[J]. Biochemical Engineering Journal, 2015, 101: 44-54. DOI:10.1016/j.bej.2015.05.001 |
| [15] |
张祥胜, 许德军. 产鼠李糖脂菌株种子培养条件和C、N源的优化[J]. 生物加工过程, 2013, 11(5): 38-43. |
| [16] |
Benincasa M, Contiero J, Manresa MA, et al. Rhamnolipid production by Pseudomonas aeruginosa LBI growing on soapstock as the sole carbon source[J]. Journal of Food Engineering, 2002, 54(4): 283-288. DOI:10.1016/S0260-8774(01)00214-X |
| [17] |
顾生辉, 朱莉, 詹晓北, 等. 以甘油为底物鼠李糖脂高产菌株的诱变选育[J]. 生物加工过程, 2015, 13(1): 54-59. |
| [18] |
董学畅, 申立华. 油烟机回收废油脂的开发利用[J]. 云南民族大学学报:自然科学版, 2001, 10(3): 411-413. |
| [19] |
陈硕平, 邓婧, 陈新, 等. 以餐饮废油为原料制备固体酒精的方法: 中国, 103265993 B[P]. 2013-08-28.
|
| [20] |
曹晶华, 肖文爽, 高松, 等. 采用抽油烟机废油合成增塑剂的实验研究[J]. 塑料助剂, 2014(6): 31-35. |
| [21] |
Benincasa M, Abalos A, Oliveira I, et al. Chemical structure, surface properties and biological activities of the biosurfactant produced by Pseudomonas aeruginosa LBI from soapstock[J]. Antonie Leeuwenhoek, 2004, 85: 1-8. DOI:10.1023/B:ANTO.0000020148.45523.41 |
| [22] |
Olivira FJS, Vazquez L, Campos NPD, et al. Production of rhamnolipid by a Pseudomonas alcaligenes strain[J]. Process Biochemistry, 2008, 44(4): 383-389. |
| [23] |
Rahman KSM, Rahman TJ, McClean S, et al. Rhamnolipid biosurfactant production by strains of Pseudomonas aeruginosa using low-cost raw materials[J]. Biotechnology Progress, 2002, 18(16): 1277-1281. |
| [24] |
Price N, Ray K, Vermillion K, et al. MALDI-TOF mass spectrometry of naturally occurring mixtures of monorhamnolipids and dirhamnolipids[J]. Carbohydrate Research, 2009, 344: 204-209. DOI:10.1016/j.carres.2008.10.013 |
| [25] |
Lotfabad TB, Shourian M, Roostaazad R, et al. An efficient biosurfactant-producing bacterium Pseudomonas aeruginosa MR01, isolated from oil excavation areas in south of Iran[J]. Colloids and Surfaces B:Biointerfaces, 2009, 69(1): 183-193. |
| [26] |
刘洋, 钟华, 刘智峰, 等. 生物表面活性剂鼠李糖脂的纯化与表征[J]. 色谱, 2014, 32(3): 248-255. |
| [27] |
Lang S, Wullbrandt D. Rhamnose lipids--biosynthesis, microbial production and application potential[J]. Applied Microbiology and Biotechnology, 1999, 51(1): 22-32. DOI:10.1007/s002530051358 |
| [28] |
王盼盼. 鼠李糖脂的发酵生产以及去除污染土壤中Pb、Cd的研究[D]. 无锡: 江南大学, 2016.
|
| [29] |
Samadi N, Abadian N, Ahmadkhaniha R, et al. Structural characterization and surface activities of biogenic rhamnolipid surfactants from Pseudomonas aeruginosa isolate MNI and synergistic effects against methicllin-resistant Staphylococcus aureus[J]. Folia Microbiologica, 2012, 57: 501-508. DOI:10.1007/s12223-012-0164-z |
| [30] |
Ozdemir G, Peker S, Helvaci SS. Effect of pH on the surface and interfacial behavior of rhamnolipids R1 and R2[J]. Colloids and Surfaces A Physicochemical and Engineering Aspects, 2004, 234(1-3): 135-143. |