2. 中南大学资源加工与生物工程学院,长沙 410083
2. School of Minerals Processing and Bioengineering, Central South University, Changsha 410083
单质硫(S0)的微生物氧化是硫的生物地球化学循环过程中最重要的反应之一,这些微生物一方面通过对S0的氧化为其自身生长提供能量[1];另一方面通过溶解自然界中的含硫矿物,释放一些金属离子。因此,人们利用微生物对S0的氧化作用掀起了一门新兴技术——生物湿法冶金技术(Biohydrometallurgy),即利用微生物法提取复杂低品位原生硫化矿(包括含铜、铀、金、钴和铅等硫化矿)中的有价金属及对金矿表面的硫化矿进行氧化预处理[2-3]。
硫化矿生物浸出的微生物根据其最适生长温度可划分为常温微生物(30-40℃)、中度嗜热微生物(40-60℃)和极端嗜热微生物(60-80℃)[4]。与常见的中温菌相比,极端嗜酸热古菌由于具有耐高温、提取速率快和浸出率高等特点,在生物冶金工业应用上有着很大的潜力,正逐渐成为人们研究的热点。其中硫氧化机制及其代谢途径是所有研究的核心,但是目前对于极端嗜酸热古菌的硫氧化相关酶基因的注解非常缺乏,人们对嗜酸热古菌硫氧化过程缺乏清晰的认识和了解[5-6]。万座嗜酸两面菌Acidianus manzaensis是嗜酸菌属的一个新种,是一株最适生长温度在70℃左右的极端嗜酸热古菌,属于兼性厌氧和兼性化能自养微生物,能够在S0和亚铁(Fe2+)中进行生长,在生物浸出过程中显示出了很强的应用价值[7-9]。
A.manzaensis YN-25菌全基因组测序的完成为深入了解极端嗜酸热古菌硫氧化机理和代谢途径提供了大量信息[10]。本研究基于典型的极端嗜酸热古菌A. manzaensis YN-25已公布的全基因组序列信息,通过生物信息学分析和基因表达转录技术验证了与硫氧化相关功能基因,并通过对前述结果的分析,拟构建极端嗜酸热古菌A. manzaensis菌的硫氧化模型,旨在了解嗜酸热古菌在硫氧化机制方面与硫氧化细菌的区别和联系,并为以后阐明嗜酸热古菌硫氧化机制的相关研究奠定基础。
1 材料与方法 1.1 材料MgSO4·7H2O,K2HPO4,(NH4)2SO4,KCl,Ca(NO3)2均购自上海生工;细菌基因组DNA提取试剂盒和总RNA提取试剂盒均购自于天根生化科技有限公司;引物由湖南擎科生物技术有限公司(TSINGKE Biological Technology)合成;ReverTra Ace-α-第一链cDNA合成试剂盒,HUNDERBIRDTM SYBR® qPCR Mix均购自于日本东洋纺公司(Toyobo co.,LTD.,Osaka,Japan);RT-qPCR在iCycler iQTM Real-time PCR仪(Bio-Rad Laboratories,Inc.,Hercules,USA)上完成。
1.2 方法 1.2.1 菌株及培养基本实验所用菌株Acidianus manzaensis YN-25由中南大学生物冶金重点实验室提供,培养基配方:0.5 g/L MgSO4·7H2O;0.5 g/L K2HPO4;3.0 g/L(NH4)2SO4;0.1 g/L KCl;0.01 g/L Ca(NO3)2,添加0.02%(W/V)酵母提取物作为生长因子,并分别加入10 g/L的S0、20 g/L的FeSO4·7H2O作为能源底物,培养基初始pH用浓硫酸分别调到2.0(S0能源底物)和1.5(Fe2+为能源底物)。在500 mL的三角瓶中培养A. manzaensis,接种前将装有200 mL培养基的三角瓶在灭菌锅中121℃灭菌20 min,待培养基冷却后进行接种,初始接种菌浓均为107个/mL,在65℃、170 r/min的空气浴摇床中培养。
1.2.2 S0和Fe2+能源底物中的A. manzaensis菌生长特性A. manzaensis在不同能源底物S0和Fe2+的培养过程中,每隔12 h取液体样品分别测定细胞密度、pH值、SO42-和Fe3+。其中细胞密度采用光学显微镜直接镜检计数法,pH值使用pH计测定(雷磁PHS-3C),SO42-用改良的硫酸钡比浊法测定[11](在50 mL比色管中分别加入6.0 mL BaCl2标准溶液、6.0 mL无水乙醇、2.0 mL 0.1 g/L Tween-80和5 mL Na2SO4标准溶液,最后用pH 1.0盐酸溶液定容至50 mL,定容之后静置5 min在波长为420 nm可见光范围内测量吸光值)。Fe3+采用磺基水杨酸法测定[12](在50 mL比色管中分别加入3 mL待测样品溶液、20%磺基水杨酸10 mL,定容至50 mL,静置5 min后在波长为420 nm可见光范围内测量吸光值)。
1.2.3 NCBI数据库检索硫氧化基因及引物设计A. manzaensis YN-25的全基因组序列和完整的注释通过检索NCBI(登录号为CP020447)数据库获得,根据数据库检索得到的相关基因信息采用Primer3(v.0.4.0)在线引物设计网站(http://bioinfo.ut.ee/primer3-0.4.0/primer3/)设计对应引物(表 1),相应蛋白质序列通过检索NCBI Nonredundant Database数据库获得[13],蛋白质的亚细胞结构定位通过开放阅读课框中可能的跨膜区域由TMHMM 2.0服务器(www.cbs.dtu.dk/services/TMHMM)和THUMBUP服务器(http://sparks.informatics.iupui.edu/Softwares-Services_files/thumbup.htm)在线分析[14-15]。
为了验证筛选的20个基因与S0氧化相关性,采用RT-qPCR对其进行转录水平的检测。用于RT-qPCR的细胞收集于对数中期,总RNA的提取和总基因组DNA的提取分别采用细菌总RNA提取试剂盒和细菌总基因组DNA提取试剂盒(天根生化科技有限公司)。对提取的总RNA用微量分光光度计(Thermo Scientific NanoDrop® ND-1000 spectrophotometer)测定其浓度,同时采用A260/A280和A260/A230的比值对所提RNA的纯度和质量进行评估。以提取的总RNA用作模板,采用ReverTra Ace-α-第一链cDNA合成试剂盒进行反转录反应,合成相应的cDNA。RT-qPCR实验以cDNA为模板,使用高效率SYBR荧光定量PCR mix QPK-201(Toyobo co.,LTD.,Osaka,Japan)配制反应体系后在iCycler iQTM Real-time PCR仪(Bio-Rad Laboratories,Inc.,Hercules,USA)上进行,每个反应设3个重复。
RT-qPCR分以下几个程序:(1)98℃预变性2 min;(2)98℃解链10 s,56℃复性30 s,68℃延伸30 s,共设40个循环,并在每个循环的退火阶段检测荧光信号;(3)循环结束后反应温度从55℃开始梯度升高到98℃作产物的熔解曲线,升温时每次增加0.5℃。对RT-qPCR采集的数据,用16S rDNA基因作为内部参照校正,用(1+E)-ΔΔCq法进行计算(其中E为扩增效率,Cq值为荧光信号达到域值时的循环数),分析各个基因在不同能源底物培养时的相对表达量[16]。结果用log2[S0/Fe2+]±SD表示,并采用t检验进行差异性分析,即log2[S0/Fe2+]≥0.7(P ≤ 0.05)表示为在S0能源底物下表达上调,如果log2[S0/Fe2+]≤ - 0.7(P≥0.05)则表示在S0能源底物下表达下调,即在Fe2+能源底物下表达上调。
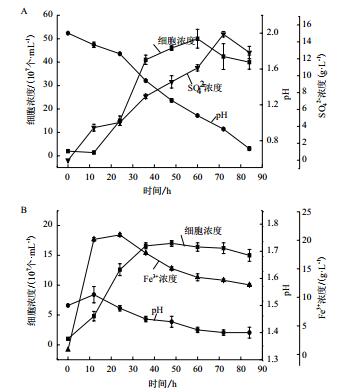
2 结果 2.1 A. manzaensis菌在S0和Fe2+中的生长特性首先比较研究了A. manzaensis菌在S0和Fe2+两种不同能源底物下的生长特性,从图 1可知,在S0为能源底物时细胞的延滞期比以Fe2+为能源底物时长,以可溶性的能源底物FeSO4·7H2O培养的细胞更容易获得能量进行生长,而作为固体形式的能源底物S0,由于细胞需要将S0转运至细胞内才能进一步被氧化利用,但是在S0中生长的细胞的对数期的细胞浓度比在Fe2+中高。
|
| 图 1 A. manzaensis菌在S0(A)和Fe2+(B)中的生长特性 |
从图 1-A可知,随着培养时间的进行,溶液中的SO42-逐渐增大,同时溶液中的pH值也逐渐下降,说明A. manzaensis菌逐渐将S0氧化成SO42-,并且生成H+,从而导致溶液pH的下降。
从图 1-B可以看出,在以Fe2+为能源底物培养过程中溶液中的Fe3+先增大后减小,而且在培养过程中发现A. manzaensis菌在Fe2+中生长时会有黄钾铁矾(MFe3(SO4)2(OH)6,M为金属离子)生成(公式1),伴随着MFe3(SO4)2(OH)6的生成还有H+的产生,从而导致溶液体系pH值的下降,而且形成黄钾铁矾过程中会消耗大量的Fe3+,导致溶液中的Fe3+逐渐降低。
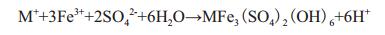 (1)
(1)
通过检索NCBI数据库中A. manzaensis YN-25的全基因组序列信息,并通过与其他已经公布基因组的嗜热古菌的基因进行BLAST比对,共找到20个可能与S0氧化基因(表 2),其中包括编码古菌对S0氧化的初始反应步骤所需的硫氧化还原酶(Sulfur oxygenase-reductase)的sor基因,以及编码其他的含硫代谢中间产物氧化酶的基因,例如编码硫代硫酸盐-醌氧还酶(Thiosulfate-quinone oxidoreductase)的tqo基因,编码连四硫酸盐水解酶(Tetrathionate hydrolase)的tetH基因等;同时还包括编码电子传递体(Cytochrome B6)和末端氧化酶(aa3-type terminal oxidase、NADH:ubiquinone oxidoreductase)的基因;值得注意的是在A. manzaensis YN-25的全基因组注释信息中包含多个编码硫还原蛋白家族(Sulfur reduction protein)的dsrE基因。对检索的S0氧化基因的分类信息见图 2。在NCBI数据库中A. manzaensis YN-25的注释信息中没有编码硫化物:醌氧化还原酶(Sulfide:quinone oxidoreductase(SQR))的基因sqr的注释信息,进一步通过BLAST比对发现在A. manzaensis全基因组中登录号为B6F84_03775(注释信息为pyridine nucleotide-disulfide oxidoreductase)的基因与已有文献报道的与A. manzaensis同一个Acidianus属的不同种的A. hospitalis W1中的sqr同源性非常高,因此推测该基因在A. manzaensis菌中起到编码SQR的功能。
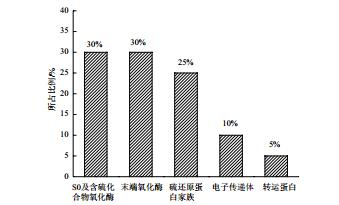
|
| 图 2 A. manzaensis菌S0氧化基因功能分类及所占比例 |
为了验证筛选的20个基因与S0氧化相关性,采用RT-qPCR对A. manzaensis菌在S0和Fe2+两种不同能源底物下的基因表达差异进行转录水平的检测。RT-qPCR结果(表 3)表明,通过数据库筛选得到的20个A. manzaensis基因中有15个基因在S0能源底物下均表达上调,这些上调的基因中包括编码对S0和含硫化合物进行氧化的各种酶、电子传递体、末端氧化酶、硫还原蛋白家族和硫酸根转运蛋白酶的基因,说明这些基因与S0的氧化密切相关。有4个基因在两种能源底物下表达差异并不明显,值得注意的是soxl基因在S0能源底物下表达下调(即在Fe2+为能源底物时表达上调),推测该基因可能与Fe2+氧化相关。
根据对A. manzaensis菌全基因组注释信息的分析和RT-qPCR对所筛选的基因验证结果,构建了极端嗜酸热古菌A. manzaensis的硫氧化模型(图 3),即胞外的S0跨膜转运(未知硫转运蛋白)进入细胞内后,经SOR氧化还原生成S2O32-,SO32-和H2S,该步反应是胞内对S0进行氧化的重要步骤,但是该反应不能与电子传递进行偶联产生能量,极端嗜酸热古菌A. manzaensis主要通过对SOR反应形成的中间产物S2O32-,SO32-和H2S的进一步氧化产能,对这些中间产物氧化得到的电子会被传递给细胞膜上的氧化性醌(Q2+),使其形成还原性的醌(QH2),QH2最终被末端氧化酶氧化形成NADH和ATP,从而为细胞生长提供能量。而S0氧化后形成的终产物SO42-则通过硫酸根转运蛋白酶(Sulfate ABC transporter permease)排到胞外。
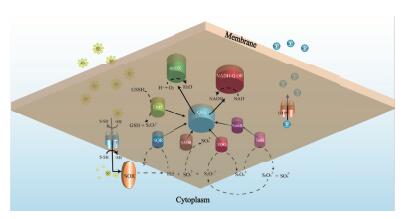
|
| 图 3 极端嗜酸热古菌A. manzaensis的硫氧化模型 Membrane:细胞膜;SOR:硫氧化蛋白;SQR:硫化物-醌还原酶;SAOR:亚硫酸盐氧化还原酶;TQO:硫代硫酸盐-醌氧还酶;TetH:连四硫酸盐水解酶;DsrE:硫还原蛋白DsrE;aa3 OX:aa3-型末端氧化酶;NADH-Q OR:NADH-醌氧化还原蛋白酶;OH2:还原性醌;?:未知硫转运膜蛋白;STP:硫酸根转运蛋白酶 |
极端嗜酸热古菌的硫氧化在硫的生物地球化学循环和硫化矿的生物浸出中起着重要的作用,但是关于极端嗜酸热古菌的硫氧化机理研究较少,主要是因为其最适生长条件大都是在极端的生理生化条件下(高温、低pH),这给研究其相关的生化反应带来了很大的困难。目前,随着越来越多的极端嗜酸热古菌的全基因组测序的完成,使得利用基因组信息分析相关代谢机理的模型成为可能。本文利用已公布的极端嗜酸热古菌A. manzaensis YN-25的全基因组信息,通过数据库比对初步筛选了20个可能与硫氧化相关的基因,并进一步通过RT-qPCR对筛选得到的基因从转录水平进行了验证,共鉴定出了15个与硫氧化相关的基因,其中包含一系列编码氧化S0及含硫中间产物的酶[19-20, 23-24],它们对应的编码基因及蛋白酶在细胞中的定位及所涉及的反应等酶的相关特性见表 4。
SOR在古菌的硫氧化过程中起着重要的作用,但是该酶只存在细胞质中,因此胞外的S0需要先经过跨膜转运进入到细胞质中才能被SOR进行氧化还原反应生成能被进一步氧化的中间产物,但是对于古菌而言,该跨膜转运蛋白至今未被找到。Rohwerder和Sand[21]根据对嗜酸氧化亚铁硫杆菌的Acidithiobacillus ferrooxidans的研究提出S0可能被外膜富含巯基(P-SH)的外膜蛋白键和形成类似的Pr-SnH(n≥2)结构化合物进而被转运至细胞周质空间被氧化(公式2),其进一步基于同步辐射的原位显微表征(synchrotron radiation based STXM、μ-XRF))发现,极端嗜酸热古菌A. manzaensis在以S0为能源底物培养下的细胞表面的巯基(-SH)是在以Fe2+为能源底物培养下的2.14倍[22],这表明对于极端嗜酸热古菌而言,胞外的S0可能同样被膜上富含-SH的蛋白键和形成Pr-SnH(n≥2)结构的复化合物进入细胞中,该复合物在胞内重新生成S0从而被SOR进行氧化还原反应生(图 3)。值得注意的是,在A. manzaensis菌中含有多个编码硫还原蛋白家族DsrE的基因,而且其在S0底物下的转录水平均高于在Fe2+为能源底物下,这说明该硫还原蛋白家族DsrE也参与了A. manzaensis的S0氧化过程。根据已有文献报道,DsrE蛋白在A. ferrooxidans菌中能够氧化硫烷硫(Sulfane sulfur,GSSH)(表 4)[23],因此推测该蛋白家族在古菌中也起到相同的功能。此外,对A. manzaensis菌的全基因组的分析发现没有编码腺苷核苷还原酶(Adenosine phosphosulphate reductase,APS)和腺苷酰硫酸磷酸腺苷转移酶(adenylylsulp-hate phosphate adenyltransferase,APAT)的基因,说明对于A. manzaensis而言,其硫氧化代谢途径与已报道的其他嗜酸热古菌Sulfolobus acidocaldarius和S. solfataricus等相比存在一定的差异[20, 24-25]。
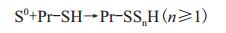 (2)
(2)
本研究比较了极端嗜酸热古菌A.manzaensis在S0和Fe2+两种不同能源底物培养下的生长特性,结果表明细胞在不同的能源底物下可能通过不同的硫代谢途径。通过实时定量PCR(RT-qPCR)比较了以单质硫(S0)和亚铁(Fe2+)两种不同能源底物培养下的基因表达差异,共鉴定出了15个与硫氧化相关的基因,包括一系列编码能氧化单质硫(S0)及含硫中间产物酶、电子传递体、末端氧化酶、硫还原蛋白家族和硫酸根转运蛋白酶的基因;同时,实时定量PCR还发现,A. manzaensis菌中含有多个dsre基因,这些dsre基因与硫的氧化密切相关。基于上述分析,本研究构建了极端嗜酸热古菌A. manzaensis的硫氧化模型,该模型与已报道的其他嗜酸热古菌如Sulfolobus acidocaldarius和S. solfataricus等相比存在一定的差异。
| [1] |
Dopson M, Johnson DB. Biodiversity, metabolism and applications of acidophilic sulfur-metabolizing microorganisms[J]. Environmental Microbiology, 2012, 14(10): 2620-2631. DOI:10.1111/emi.2012.14.issue-10 |
| [2] |
周吉奎, 钮因健. 硫化矿生物冶金研究进展[J]. 金属矿山, 2015(4): 24-30. |
| [3] |
周洪波, 毛峰, 王玉光. 嗜酸微生物与生物冶金技术[J]. 矿物岩石地球化学通报, 2015(2): 269-276. |
| [4] |
Li Y, Kawashima N, Li J. A review of the structure, and fundamental mechanisms and kinetics of the leaching of chalcopyrite[J]. Advances in Colloid & Interface Science, 2013, 197-198(9): 1-32. |
| [5] |
Friedrich CG, Bardischewsky F, Rother D, et al. Prokaryotic sulfur oxidation[J]. Curr Opin Microbiol, 2005, 8(3): 253-259. DOI:10.1016/j.mib.2005.04.005 |
| [6] |
Friedrich CG, Rother D, et al. Oxidation of reduced inorganic sulfur compounds by bacteria:emergence of a common mechanism?[J]. Appl Environ Microbiol, 2001, 67(7): 2873-2882. DOI:10.1128/AEM.67.7.2873-2882.2001 |
| [7] |
Ding J, Zhang R, et al. A novel acidophilic, thermophilic iron and sulfur-oxidizing archaeon isolated from a hot spring of tengchong, yunnan, China[J]. Braz J Microbiol, 2011, 42(2): 514-525. DOI:10.1590/S1517-83822011000200016 |
| [8] |
He H, Xia J, Yang Y, et al. Sulfur speciation on the surface of chalcopyrite leached by Acidianus manzaensis[J]. Hydrometallurgy, 2009, 99(1-2): 45-50. DOI:10.1016/j.hydromet.2009.06.004 |
| [9] |
Liang CL, Xia JI, et al. Effect of sodium chloride on sulfur speciation of chalcopyrite bioleached by the extreme thermophile Acidianus manzaensis[J]. Bioresour Technol, 2012, 110(2): 462-467. |
| [10] |
Ma YL, Xia JL, Yang Y, et al. Complete genome sequence of the extremely thermoacidophilic archaeon Acidianus manzaensis YN-25[J]. Genome Announcements, 2017, 5(25): pii:e00438-17. |
| [11] |
彭安安, 刘红昌, 聂珍媛, 等. 硫酸钡比浊法的改良及其在生物冶金浸出体系硫酸根浓度测定中的应用[J]. 中南大学学报:自然科学版, 2013, 44(6): 2186-2191. |
| [12] |
Liu HC, Xia JL, Nie ZY, et al. Iron L-edge and sulfur K-edge XANES spectroscopy analysis of pyrite leached by Acidianus manzaensis[J]. Transactions of Nonferrous Metals Society of China, 2015, 25(7): 2407-2414. DOI:10.1016/S1003-6326(15)63856-0 |
| [13] |
Peng AA, Xia JL, et al. Thiol-rich proteins play important role in adhesion and sulfur oxidation Process of Acidithiobacillus ferroxid-ans[J]. Advanced Materials Research, 2013, 825: 137-140. DOI:10.4028/www.scientific.net/AMR.825 |
| [14] |
Yu NY, Wagner JR, Laird MR, et al. PSORTb 3. 0:improved protein subcellular localization prediction with refined localization subcategories and predictive capabilities for all prokaryotes[J]. Bioinformatics, 2010, 26(13): 1608-1615. DOI:10.1093/bioinformatics/btq249 |
| [15] |
彭安安. 嗜酸硫氧化细菌元素硫活化氧化机制研究[D]. 长沙: 中南大学, 2012.
|
| [16] |
Almárcegui RJ, Navarro CA, Paradela A, et al. Response to copper of Acidithiobacillus ferrooxidans ATCC 23270 grown in elemental sulfur[J]. Research in Microbiology, 2014, 165(9): 761-772. DOI:10.1016/j.resmic.2014.07.005 |
| [17] |
Zhu W, Xia JL, Peng AA, et al. Characterization of apparent sulfur oxidation activity of thermophilic archaea in bioleaching of chalcopyrite[J]. Transactions of Nonferrous Metals Society of China, 2013, 23(8): 2383-2388. DOI:10.1016/S1003-6326(13)62745-4 |
| [18] |
You XY, Liu C, Wang SY, et al. Genomic analysis of Acidianus hospitalis W1 a host for studying crenarchaeal virus and plasmid life cycles[J]. Extremophiles, 2011, 15(4): 487-497. DOI:10.1007/s00792-011-0379-y |
| [19] |
Kletzin A, Urich T, Müller F, et al. Dissimilatory oxidation and reduction of elemental sulfur in thermophilic archaea[J]. Journal of Bioenergetics & Biomembranes, 2004, 36(1): 77-91. |
| [20] |
Rohwerder T, Sand W. Oxidation of inorganic sulfur compounds in acidophilic prokaryotes[J]. Engineering in Life Sciences, 2010, 7(4): 301-309. |
| [21] |
Rohwerder T, Sand W. The sulfane sulfur of persulfides is the actual substrate of the sulfur-oxidizing enzymes from Acidithiobacillus and Acidiphilium spp[J]. Microbiology, 2003, 149(Pt 7): 1699. |
| [22] |
Liu HC, Xia JL, et al. Differential expression of extracellular thiol groups of moderately thermophilic Sulfobacillus thermosulfidooxi-dans and extremely thermophilic Acidianus manzaensis grown on S0 and Fe2+[J]. Arch Microbiol, 2015, 197(6): 823. DOI:10.1007/s00203-015-1111-6 |
| [23] |
Quatrini R, Appia-Ayme C, et al. Extending the models for iron and sulfur oxidation in the extreme Acidophile Acidithiobacillus ferrooxidans[J]. BMC Genomics, 2009, 10(1): 394. DOI:10.1186/1471-2164-10-394 |
| [24] |
Kletzin A. Oxidation of sulfur and inorganic sulfur compounds in Acidianus ambivalens[M]// Microbial Sulfur Metabolism. Springer Berlin Heidelberg, 2008:184-201.
|
| [25] |
Komorowski L, Verheyen W, Schäfer G. The archaeal respiratory supercomplex SoxM from S. acidocaldarius combines features of quinole and cytochrome c oxidases[J]. Biological Chemistry, 2002, 383(11): 1791-1799. |