2. 中南大学生物冶金教育部重点实验室,长沙 410083
2. Key Laboratory of Biometallurgy of Ministry of Education, Central South University, Changsha 410083
四环素类抗生素包括金霉素(CTC)、土霉素(OTC)和四环素(TC)等抗生素,它们是一类由放线菌产生的广谱抗生素[1]。这些抗生素既可以治疗动物疾病,而且在畜禽和水产养殖业中还可以作为饲料的添加剂来促进动物的生长[2]。在肉质品加工过程中为抑制细菌滋生也会添加部分抗生素类药物[3]。另有文献表明,四环素类抗生素广泛存在于土壤[4]、水体[5]、动物粪便[5-6]和牛奶[7]产品中,如在我国北方排污口/河等水体中检出四环素类抗生素的残留[8]。有研究表明四环素类抗生素进入动物体内后并不能被完全吸收,仍有40%-70%以母体形式随自身废弃物排出,而且可以在土壤环境中长期存在[9]。作为人畜共用抗生素,除了会造成水资源和土壤环境的严重污染,对人类的危害也不能忽视,如对胃肠及肝脏损害、牙齿染色等疾病[10]。近年来,随着全球各国对抗生素滥用逐步达成共识,如何降低土壤、污水和肉类、奶制品等食品中四环素类抗生素残留含量的方法研究已经进入白热化。
降解四环素类抗生素的方式主要有以下两种:一是生物降解,包括微生物降解和植物降解;二是非生物降解,如水解、氧化降解及光降解等[11]。Reyes等[12]分别用长波紫外光、可见光和紫外光来照射四环素水溶液,发现加入TiO2后四环素的降解速率明显高于不加。β-内酰胺类和磺胺类抗生素在水中容易发生水解作用。臭氧的强氧化作用对四环素类抗生素的降解效率极高,Wu等[13]发现20 mg/L的四环素经过臭氧处理5 min以后能够全部降解。抗生素在微生物作用下其残留物的理化性质及结构发生改变,从大分子化合物降解为小分子化合物,最终转变为H2O和CO2,这一过程称为抗生素的微生物降解。其中耐药细菌起最重要的作用。成洁等[14]从长期受四环素类抗生素污染的土壤中分离到一株能降解土霉素、四环素和金霉素的菌株,降解率分别为58.3%、63.9%和65.5%。微生物降解四环素具有操作方便、易于控制、效率高且不会造成二次污染等优点。
本研究从长期以四环素类抗生素为饲料添加剂的养猪厂粪便沉积池底部的污泥中筛选出一株能够高效降解四环素的菌株,对其进行分类鉴定,研究其对四环素的降解能力及最佳降解条件,初步探究其四环素耐药基因。
1 材料与方法 1.1 材料 1.1.1 样品(土壤)来源本实验样品是从长沙市某养猪厂(长期用四环素类抗生素作为饲料添加剂)粪便沉积池底部污泥中取得的。土壤样品用无菌自封袋装好,置于-20℃的冰箱中待后续实验使用。
1.1.2 培养基单一碳源培养基:EDTA 15 mg/L,ZnSO4·7H2O 4.5 mg/L,CaCl2·2H2O 4.5 mg/L,FeSO4·7H2O 3 mg/L,MnCl2·4H2O 1 mg/L,Na2MoO4·2H2O 0.4 mg/L,CuSO4·5 H2O 0.3 mg/L,KI 0.1 mg/L,(NH4)2SO4 5 g/L,KH2P04 3 g/L,MgS04·7H2O 0.5 g/L,pH 7.0-7.2,121℃高压灭菌20 min。
筛选培养基:在灭菌单一碳源培养基中加入四环素母液(20 mg四环素标准品于1 mL甲醇中,充分溶解,用0.22 μm已灭菌的尼龙过滤,现配现用)。
1.1.3 药品四环素标准品(C22H24N2O8·HCl),购于上海源叶生物科技有限公司;甲醇(色谱纯);乙腈(色谱纯);磷酸二氢钠(分析纯)、草酸(分析纯)、乙二胺四乙酸二钠(Na2EDTA)(分析纯)、柠檬酸(分析纯);水为Millipore超纯水。细菌基因组提取试剂盒和Taq DNA聚合酶均购自天根生化科技(北京)有限公司。
1.2 方法 1.2.1 四环素降解菌的筛选及分离纯化用10 mL无菌水将0.1g污泥样品制成悬液,混匀后静置,向筛选培养基(四环素浓度20 mg/L)中加1 mL上清液,25℃,150 r/min摇床中暗培养,8 d后吸取0.5 mL培养液再次接种到筛选培养基(四环素浓度40 mg/L)中,其他条件不变,培养8 d。重复以上操作步骤,直至四环素终浓度为120 mg/L。富集结束后用稀释涂布法和平板划线法筛出能以四环素为唯一碳源的单菌落并分离、纯化。
1.2.2 四环素降解菌的形态观察和生理生化实验将降解菌接种到筛选培养基平板上,25℃恒温养2 d后革兰氏染色,再用普通光学显微镜和扫描电镜观察菌体形态。对筛选出的四环素降解菌株进行生理生化实验,具体步骤可参考《伯杰氏细菌鉴定手册》[15]和《常见细菌系统鉴定手册》[16]来操作。
1.2.3 四环素降解菌16S rDNA序列分析及菌株遗传学分析利用试剂盒提细菌基因组,以其DNA为模板进行目的片段的扩增。扩增细菌基因组16S rDNA通用引物由上海权阳生物科技公司合成。PCR反应体系(50 μL):10×PCR缓冲液5 μL,dNTP(25 mmol/L)1.0 μL,上下游引物(20 mmol/L)各1.0 μL,模板DNA 1.0 μL,Mg2+(25 mmol/L)3.0 μL,Taq DNA聚合酶0.5 μL,加超纯水补足至50 μL。反应参数为:94℃预变性5 min,94℃变性40 s,60℃退火40 s,72℃延伸1 min,30个循环,72℃再延伸10 min,4℃保存10 min。用0.8%的琼脂糖凝胶电泳对PCR扩增产物进行验证分析,再送样测序。将所得菌株的16S rDNA序列在NCBI中作BLAST比对,用Bioedit分析同源性和遗传距离,最后在MEGA6.0软件中绘制发育树。
1.2.4 四环素残留测定方法的建立——高效液相色谱法色谱条件为色谱柱:C18柱;流动相:乙腈和10 mmol/L磷酸二氢钠(NaH2PO4)溶液;柱温:30℃;检测波长:360 nm。
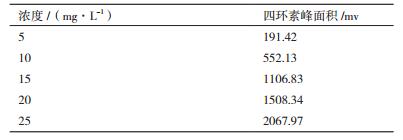
用1 mL甲醇充分容解20 mg四环素标准品,即得20 mg/mL的四环素标准液,再用甲醇分别稀释成25、20、15、10、5 mg/L等系列浓度,超声排气后用上面得到的色谱条件进行检测,作标准曲线。
取5 mL培养液以8 000 r/min离心15 min。取4 mL上清液加入到含4 mL Na2EDTA-Mcllvaine缓冲液的离心管中,再加入正己烷和三氯甲烷各1 mL,振荡2 min并超声30 s,8000 r/min离心15 min,0.22 μm微孔滤膜过滤,密封4℃冷藏待测。
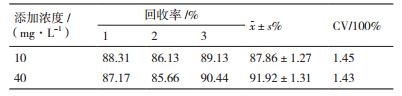
向不接菌的单一碳源培养基中加入四环素标准液制得四环素浓度为10 mg/L、40 mg/L溶液,旋涡混匀,同时用流动相将四环素标准液配成对应的标准工作液浓度,HPLC测定,回收率的计算公式为:回收率=A/As×100%(A和As分别是单一碳源培养基和相应标准液中四环素的峰面积)。
1.2.5 培养温度对四环素降解菌的生长及其降解四环素的影响菌的生长用血细胞计数器测定。将四环素降解菌的接种液以3%的接种量接入四环素浓度为50 mg/L、初始pH为7.0的单一碳源培养基中,分别在20、25、30、35和40℃五个温度下以转速150 r/min摇床上暗培养,每个样品重复3次,培养8 d后测定四环素的降解率。
1.2.6 初始pH对四环素降解菌的生长及其降解四环素的影响将四环素浓度为50 mg/L的单一碳源培养基的初始pH值分别调至5.0、6.0、7.0、8.0和9.0,向培养基中加入3%的降解菌菌液,25℃,150 r/min摇床上黑暗培养,每个样品做3组平行,培养8 d后对四环素的降解率进行测定。
1.2.7 培养时间对四环素降解菌的生长及其降解四环素的影响按3%的接种量将降解菌的接种液接入到四环素浓度为50 mg/L的筛选培养基中,调节初始pH到7.0,在温度为25℃,150 r/min摇床上黑暗培养,每个样品重3次,在培养第2、4、6、8、10、12和14 d后对菌株生长量和四环素的降解率分别进行测定。
1.2.8 降解菌的耐药基因研究选取两种常见的四环素耐药基因tet(D)和tet(E)[17]对降解菌进行耐药检测。耐药基因引物由上海权阳生物科技公司合成。利用试剂盒提取降解菌基因组,以基因组DNA为模板进行目的片段的扩增。PCR产物电泳回收后送样测序。四环素耐药基因tet(D)和tet(E)的引物序列[17]见表 1。
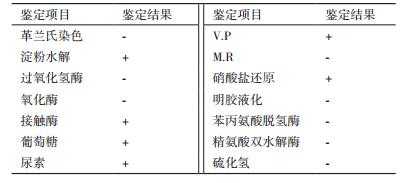
富集、分离纯化过后得到6株能够降解四环素的菌株,选取其中降解效果较好的菌株XY-1做进一步研究。菌株XY-1在单一碳源培养基平板上的菌落呈圆形、白色、不透明、边缘整齐、表面粘稠。在扫描电镜下为短杆状,无芽孢(图 1)。生理生化鉴定结果(表 2)显示,为革兰氏阴性菌,淀粉水解、接触酶、葡萄糖、尿素、V.P、硝酸盐还原为阳性,过氧化氢酶、氧化酶、M.R、明胶液化等为阴性。

|
| 图 1 扫描电子显微镜下XY-1的形态 |
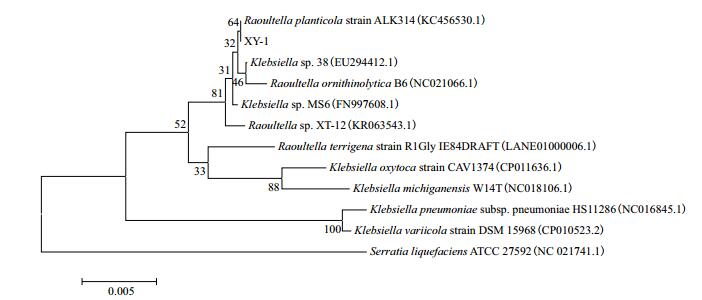
菌株16S rDNA片段经PCR扩增,琼脂糖凝胶电泳验证后,由测序公司完成测序工作。获得16S rDNA的PCR扩增产物长度为1 381 bp,将其序列输入GenBank后,用BLAST软件比对分析序列同源性,在MEGA6.0软件中对同源性较近的细菌绘制系统发育树(图 2)。综合菌株形态特征、生理生化鉴定及16S rDNA序列分析[18]得出四环素降解菌XY-1在分子系统发育分类上属于拉乌尔菌属(Raoultella sp.),与植生拉乌尔菌(Raoultella planticola)相似度为99%,将其命名为Raoultella sp.XY-1。
|
| 图 2 降解菌XY-1系统进化树 |
本实验选用了含有EDTA的弱酸性溶剂0.1 mol/L EDTA-Mcllvaine缓冲液(pH 4.0)作为提取溶剂,提取效果好。对四环素标准品进行全波长紫外扫描,发现四环素在360 nm处有一个吸收峰,经HPLC检测,基线平稳,峰形较好,所以选择360 nm为检测波长。
HPLC检测四环素系列浓度标准液结果见表 3。四环素标准品的相对保留时间为13.75 min,利用四环素的系列浓度为横坐标,对应的峰面积为纵坐标,进行相关性分析之后得出四环素回归方程y=94.186x-327.46,相关系数R2=0.995 2。结果表明四环素进样浓度与峰面积有良好的线性关系,满足四环素定量分析要求,符合检测条件。
空白培养基中四环素在10、40 mg/L两个浓度下的回收测定结果,见表 4。在两个浓度下的平均回收率分别为87.86%和91.92%,变异系数为1.45%和1.43%。
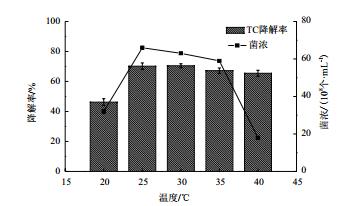
降解菌XY-1的生长受温度影响较大,在20℃和40℃时生长量很低,仅为3.2×109和1.8×109,25℃左右时生长量最高,活性最好,细菌浓度为6.63×109。降解菌XY-1的降解率在20℃-25℃之间随着温度的升高而升高,在25℃时四环素的降解率达到70.68%,在25℃-40℃之间先保持平稳最后缓慢降低(图 3)。由于四环素在高温下结构不稳定易于水解,加速了降解,所以在30-40℃之间降解率并没有随着菌体数量大幅度下降而显著降低。结合菌株的生长情况,选择25℃为适宜的培养温度。
|
| 图 3 温度对降解菌XY-1的生长及降解四环素的影响 TC:四环素;菌浓:降解菌浓度 |
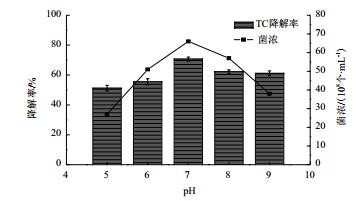
适当的pH值既能保证微生物的生长速度,也能保证其降解酶的活性。本实验中当pH为5和9时菌株的生长受到明显抑制,细菌浓度分别为2.7×109和3.8×109,pH为7时菌株生长最旺盛,细菌浓度为6.6×109,此时降解率也最高,达到70.68%,得出pH值对降解菌XY-1的生长及降解率的影响都呈现先增长后下降的趋势(图 4)。分析是由于四环素在碱性条件下不稳定,易发生C环破坏,所以出现了降解率降低的速率没有菌体数量减少快的情况。所以选择初始pH值为7时菌株生长量最大且四环素降解最快。
|
| 图 4 pH对降解菌XY-1的生长及降解四环素的影响 TC:四环素;菌浓:降解菌浓度 |
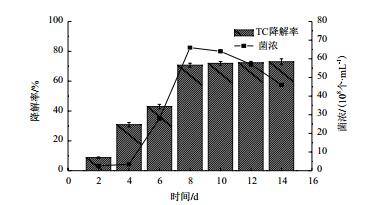
在以四环素为单一碳源的培养基中降解菌XY-1的生长在第4天进入对数期,第8天生物量达到6.7×109,随后进入稳定期。对四环素的降解率随着培养时间的延长而增长,在第8天之前降解率增长显著,第8天的降解率达到70.68%,8 d以后略有增长,趋于平稳,增长速率大大降低(图 5)。因此,综合考虑选择第8天测量数据来衡量菌株生长及降解率比较合理。
|
| 图 5 培养时间对降解菌XY-1的生长及降解四环素的影响 TC:四环素;菌浓:降解菌浓度 |
本研究通过PCR扩增、电泳验证、切胶回收及送样测序,最终在四环素降解菌Raoultella sp.XY-1中检测到了耐药基因tet(D)和tet(E)(图 6),序列长度分别为1 161 bp和778 bp,使得该菌株表现出强的耐受性。已被国内外报道并命名过的四环素耐药基因有几十种,多数为tet耐药基因,还有的是otr 耐药基因。按照耐药性机制的不同分为外排泵机制、核糖体保护机制、基因修饰或钝化四环素分子的酶降解机制和其他机制。而tet(D)和tet(E)基因就属于外排泵机制,负责编码膜相关蛋白,可以将四环素分子排出细胞外,降低了细胞内的浓度保护了胞内的核糖体,避免四环素药物的作用影响,从而产生耐药性。

|
| 图 6 tet(D)和tet(E)基因PCR鉴定结果 |
随着兽药、农药等长期大量施用四环素类抗生素,残留四环素在环境中降解、迁移,最终对环境生物造成的影响和对人类健康构成的威胁越来越多,利用降解菌降解抗生素残留物是目前最为经济有效的方法,因此发掘新的四环素高效降解菌对于去除四环素类抗生素在环境中的残留,保障人们的身体健康,提高环境质量,保护生态平衡及对畜牧业的可持续发展均具有重要的科学意义和应用价值。
本研究筛选到一株能降解四环素的拉乌尔菌Raoultella sp.XY-1。2001年,Olson等学者[19]成立了拉乌尔菌属,包括解鸟氨酸拉乌尔菌、植生拉乌尔菌和土生拉乌尔菌3个种属。据报道该属中某些菌具有产生表面活性剂的能力[20],表面活性剂可以增加污染物的传递速率[21];葛超荣等[22]也分离出2株能够产KPC酶的植生拉乌尔菌,都能耐受多种药物。根据国内外报道,已有一些能降解四环素类抗生素的微生物,例如Huang[23]从生产四环素的药渣中分离得到一株能够降解四环素的酵母菌Trichosporon mycotoxinivorans XPY-10;王志强等[24]筛选出土霉素降解菌蜡样芽孢杆菌;马志强等[25]筛选到一株无丙二酸柠檬酸杆菌,该菌对药渣中残留四环具有高效降解作用;许晓玲等[26]筛选到2株四环素降解菌株,分别为缺陷短波单胞菌和人苍白杆菌等,总体而言并不多,有关拉乌尔菌降解四环素的研究还未见报道。本研究首次发现拉乌尔菌属Raoultella sp.XY-1可以高效降解四环素,其降解率在70%以上,说明它是一种非常有潜力的微生物菌种资源。
培养温度、初始pH及培养时间对四环素降解菌XY-1的生长和降解率都有显著影响,在25℃左右时生长量最高,活性最好,降解率达到最高70.68%。赵永斌等[27]研究了四环素类抗生素降解菌木糖氧化无色杆菌和枯草芽孢杆菌对四环素的降解率受温度的影响情况,也发现随温度升高其降解率先升高然后保持平稳最后缓慢降低的趋势,且在最佳温度下菌株对四环素类抗生素的降解率在68%左右。本研究还发现pH对降解菌XY-1的生长及降解率的影响都呈现先增长后下降的趋势,pH值为7时菌株生长量最大且四环素降解最快。于浩等[28]研究畜禽粪便无害化处理中高效降解菌短波单孢菌对四环素类抗生素土霉素的降解率亦随pH值呈现先增大再降低的趋势,且pH为7是其最适pH,与本文研究得出的结果相一致。降解菌XY-1对四环素的降解率在第8d时达到70.68%,随后略有增长再趋于稳定,呈现出随培养时间的延长先增大后平稳的变化趋势与Leng等[29]研究四环素高效降解菌嗜麦芽窄食单胞菌随时间的降解率趋势类似。
抗生素的微生物降解是指在微生物作用下,将抗生素残留物从大分子化合物降解为小分子化合物,最后生成CO2和H2O,实现对环境污染的无害化处理。由于降解抗生素的细菌首先需要在抗生素存在条件下存活才能发挥其降解作用,所以能够对抗生素起降解作用的,大多是耐药细菌[30]。许多抗生素含有易水解的敏感化学键(如酯健和酰胺键),而耐药菌通常含有消除这些脆弱化学键的酶,可以直接破坏和修饰抗生素,从而摧毁这些抗生素的活性。本研究在Raoultella sp.XY-1中首次检测到了2种四环素耐药基因tet(D)和tet(E),说明该菌具有对四环素耐药的分子基础,使其具备了降解四环素的前提和可能性,有助于在分子水平上进一步探究Raoultella sp.XY-1对四环素的降解转化机制。
4 结论本实验从利用四环素类抗生素作为饲料添加剂的养猪厂底泥中筛选获得一株能够高效降解四环素的细菌XY-1,经鉴定为Raoultella sp.XY-1。当该菌株在四环素浓度为50 mg/L时,温度为25℃、初始pH为7的单一碳源培养基中,暗培养8 d时细菌生长量最大且四环素降解率最高达70.68%。首次在该菌中检测到2种四环素耐药基因tet(D)和tet(E)。
| [1] |
张浩, 罗义, 周启星. 四环素类抗生素生态毒性研究进展[J]. 农业环境科学学报, 2008, 27(2): 407-413. |
| [2] |
陈代杰. 抗菌药物与细菌耐药性[M]. 上海: 华东理工大学出版社, 2001.
|
| [3] |
石建军. 肉制品中抗生素残留的危害和控制[J]. 肉类研究, 2009(8): 69-71. |
| [4] |
Cristea D, Oprea M, Ciontea AS, et al. Antimicrobial resistance and genetic diversity of shigella sonnei isolates from romania[J]. Roum Arch Microbiol Immunol, 2014, 74(1-2): 26-32. |
| [5] |
Li X, Harwood VJ, Nayak B, et al. Ultrafiltration and microarray for detection of microbial source tracking marker and pathogen genes in riverine and marine systems[J]. Appl Environ Microbiol, 2016, 82(5): AEM. 02583-15. |
| [6] |
Berendsen BJ, Wegh RS, Memelink J, et al. The analysis of animal faeces as a tool to monitor antibiotic usage[J]. Talanta, 2015, 132(132): 258-268. |
| [7] |
Bion C, Beckhenzelin A, et al. Analysis of 27 antibiotic residues in raw cow's milk and milk-based products - validation of Delvotest® T[J]. Food Addit Contam Part A, 2016, 33(1): 54-59. |
| [8] |
那广水, 陈彤, 张月梅, 等. 中国北方地区水体中四环素族抗生素残留现状分析[J]. 中国环境监测, 2009, 25(6): 78-80. |
| [9] |
曹丽萍, 李万坤, 陈燕军, 等. 抗生素饲料添加剂在动物生产中的规范应用[J]. 家畜生态学报, 2009, 30(1): 105-110. |
| [10] |
He JX, Hu JJ, Thirumalai D, et al. Development of indirect competitive ELISA using egg yolk-derived immunoglobulin(IgY)for the detection of Gentamicin residues[J]. J Environ Sci Health B, 2016, 51(1): 8-13. DOI:10.1080/03601234.2015.1080479 |
| [11] |
Liu F, Tao R, Ying G, et al. Advance in environmental fate and ecological effects of antibiotics[J]. Acta Ecologica Sinica, 2010, 30(16): 4503-4511. |
| [12] |
Reyes C, Fernandez J, et al. Degradation and inactivation of tetrac-ycline by TiO2 photocatalysis[J]. Journal of Photochemistry and Photobiology A:Chemistry, 2006, 184: 141-146. DOI:10.1016/j.jphotochem.2006.04.007 |
| [13] |
Wu JG, Jiang YX, Zha LY, et al. Tetracycline degradation by ozonation, and evaluation of biodegradability and toxicity of ozonation byproducts[J]. Canadian Journal of Civil Engineering, 2010, 37: 1485-1491. DOI:10.1139/L10-100 |
| [14] |
成洁, 杜慧玲, 张天宝, 等. 四环素类抗生素降解菌的分离与鉴定[J]. 核农学报, 2017, 31(5): 884-888. DOI:10.11869/j.issn.100-8551.2017.05.0884 |
| [15] |
布坎南RE, 吉本斯NE. 伯杰氏细菌鉴定手册[M]. 北京: 科学出版社, 1984.
|
| [16] |
常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
|
| [17] |
任雪丽. 四环素耐药基因在禽畜粪便、堆肥和土壤中的归趋[D]. 上海: 华东师范大学, 2016.
|
| [18] |
Kim OS, Cho YJ, Lee K, et al. Introducing EzTaxon-e:a prokaryotic 16S rRNA gene sequence database with phylotypes that represent uncultured species[J]. Int J Syst Evol Microbiol, 2012, 62(Pt 3): 716-721. DOI:10.1099/ijs.0.038075-0 |
| [19] |
Olson DS, Asare K, et al. A novel case of Raoultella planticola urinary tract infection[J]. Infection, 2013, 41(1): 259-261. DOI:10.1007/s15010-012-0294-x |
| [20] |
武香玉, 陈存社, 郭静, 等. 微生物絮凝剂产生菌的筛选鉴定[J]. 中国酿造, 2009, 28(9): 79-82. |
| [21] |
王洋, 王秋玉. 生物表面活性剂在生物修复石油污染中的应用[J]. 中国农学通报, 2009, 25(24): 455-458. |
| [22] |
葛超荣. 肠道定植产KPC酶植生拉乌尔菌的抗性基因环境分析[J]. 生物技术进展, 2013(5): 363-367. |
| [23] |
Huang X. Biodegradation of tetracycline by the yeast strain Trichosporon mycotoxinivorans XPY-10[J]. Prep Biochem Biotechnol, 2016, 46(1): 15-22. DOI:10.1080/10826068.2014.970692 |
| [24] |
王志强, 张长青, 王维新. 土霉素降解菌的筛选及其降解特性研究[J]. 中国兽医科学, 2011(5): 536-540. |
| [25] |
马志强, 马玉龙, 谢丽, 等. 微生物法降解药渣中残留四环素的试验研究[J]. 环境科学与技术, 2012, 35(1): 46-49. |
| [26] |
许晓玲, 李卫芬, 雷剑, 等. 四环素降解菌的选育、鉴定及其降解特性[J]. 农业生物技术学报, 2011, 19(3): 549-556. |
| [27] |
赵永斌. 3种四环素类抗生素降解菌的筛选及降解特性的研究[D]. 太谷: 山西农业大学, 2015.
|
| [28] |
于浩. 畜禽粪便无害化处理中土霉素高效降解菌的筛选及其对微生物多样性的影响[D]. 沈阳: 沈阳大学, 2017.
|
| [29] |
Leng YF, Bao JG, Chang GF, et al. Biotransformation of tetracycline by a novel bacterial strain Stenotrophomonas maltophilia DT1[J]. Journal of Hazardous Materials, 2016, 318: 125-133. DOI:10.1016/j.jhazmat.2016.06.053 |
| [30] |
刘伟, 王慧, 孙志良, 等. 抗生素在环境中降解的研究进展[J]. 动物医学进展, 2009, 30(3): 89-94. |