鸡腿菇,别名毛头鬼伞,美味可口,富含多种营养物质,是十分有益于健康的理想食物。鸡腿菇包含了大量人体必须的营养物质[1-2]。通过液体发酵生产鸡腿菇液体菌种和菌丝体,不仅可以避免常规固体培养产量低、易污染等缺点,而且发酵后得到的发酵液和菌丝在蛋白质、脂肪、纤维等营养成分上一般优于或与子实体的营养成分相当[3]。此外,其具有多种生物学功能,如抗氧化、抗菌、降血糖、降血脂、提高免疫活性、抗肿瘤和抗病毒等作用[4-5]。近来食用真菌的抗氧化作用开始日益受到关注,其开发应用越来越受到重视。
有研究报道,采用不同的方法从鸡腿菇内提取出多糖,然后将该多糖以一定量注射到小鼠体内,探究其是否能够提高小鼠的免疫能力。经过实验证实,该多糖作用于小鼠后,明显增强了其免疫能力,说明鸡腿菇多糖的确具有提高免疫活性的作用[6-9]。鸡腿菇具有抗菌功效,还可产生某种对真菌具有抑制作用的抗菌物质,其有可能代替部分抗生素成为新型的抗菌物质。刘凤珠等[10]报道研究了鸡腿菇对大肠杆菌、金黄色葡萄球菌、枯草杆菌有一定的抑制作用,同时以鸡腿菇为主要组分制成涂被液进行樱桃保鲜实验测定了樱桃失重率、烂果率、Vc含量等指标,表明处理组的樱桃好果率比对照提高38%。吴艳兵[11]已经从鸡腿菇中分离出一种具有抗病毒功效的多糖,对植物病毒有一定的拮抗作用。Wu等[12]从鸡腿菇子实体中分离纯化出一种抗性蛋白Y3,对烟草花叶病毒的抑制率达50%。王学仁[13]通过鸡腿菇菌丝体发酵分离出抗性蛋白Y3,并在基因表达方面做进一步的研究。戴兵等[14]研究香菇菌丝C91-3发酵液蛋白(LFP91-3)对小鼠膜水型宫颈癌细胞株U14有明显的抑制作用。
目前,国内外学者对鸡腿菇多糖研究相对较多,而对于其生物活性蛋白的研究较少,本实验旨在通过液体发酵分离出抗菌蛋白,能够成功应用于食品防腐保鲜等方面。以鸡腿菇为出发菌株,对发酵时间、温度、pH、接种量、转速等条件进行单因素试验,并通过方差分析从中选出影响显著的因子进行响应面设计,从面获得抗菌蛋白的最佳发酵条件,同时对抗菌蛋白的抗氧化活性进行了研究,为后期工业化生产和应用提供理论依据。
1 材料与方法 1.1 材料 1.1.1 菌株鸡腿菇(Coprinus comatus)、枯草芽孢杆菌(Bacillus subtilis)由山西中医药大学制药与食品工程实验室供。
1.1.2 培养基PDA种子培养基;PDA加富培养基;NA牛肉膏蛋白胨培养基。
1.1.3 试剂1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS):美国Sigma公司;Tris、过硫酸钾、硫酸亚铁、过氧化氢、3,5-二硝基水杨酸、无水乙醇、苯酚、浓硫酸、葡萄糖、浓盐酸和氢氧化钠等均为分析纯:天津市科密欧化学试剂有限公司。
1.1.4 仪器设备YXQ-SG46-280S手提式高压蒸汽灭菌器:上海博讯实业有限公司;HH-4数显恒温水浴锅:金坛市科技仪器有限公司;TS-211B卧式恒温摇床:上海善志仪器设备有限公司;高速组织捣碎机:南京皓海仪器仪表公司;pHS-25型数显酸度仪:武汉博文电子有限公司;752型紫外分光光度计:上海光谱仪器有限公司;电子天平:上海精密仪器仪表有限公司;TGL-20B离心机:上海安亭科学仪器厂;磁力搅拌器:北京金紫光仪器仪表公司;RE-522AA式旋转蒸发仪上海亚荣生化仪器厂;FD-1A-50冷冻干燥机:上海欧蒙实业有限公司。移液枪(范围100-1 000 mL、20-200 mL、0.5-10 mL)德国Eppendorf公司;牛津杯:外径7.8±0.1 mm,内径6.0±0.1 mm,高10.0±0.1 mm。
1.2 方法 1.2.1 鸡腿菇发酵液的制备用接种环挑取一环鸡腿菇母种菌丝体接入装有150 mLPDA种子培养基的三角瓶中于25℃,100 r/min,摇床培养5 d,即可得到种子培养液,用无菌吸管吸取一定量的种子培养液加入到装有30 mL PDA加富培养基的三角瓶里,然后将该三角瓶放入恒温摇床内发酵培养,即可得到鸡腿菇菌丝发酵液,备用。
1.2.2 抗菌蛋白的制备用移液枪吸取制备好的鸡腿菇菌丝发酵液转移至EP管中离心,在4℃、3 000 r/min条件下离心15 min去除沉淀,经孔径0.22 μm细菌过滤器过滤,即得无菌体培养滤液。缓慢加入硫酸铵至50%饱和度,用磁力搅拌器搅拌,4℃静置2 h,8 000 r/min、离心30 min,收集沉淀蛋白。用原1/10体积0.02 mol/L pH 6.8的Tris缓冲液溶解,装入透析袋后采用浓度相同的Tris缓冲液透析过夜,即得到鸡腿菇抗菌蛋白,备用。以枯草芽孢杆菌为指示菌,采用牛津杯法测定抑菌活性。
1.2.3 指示菌菌悬液的制备用接种针挑取一环枯草芽孢杆菌接入装有5 mL灭菌生理盐水的试管中稀释102倍后制成浓度为1.0×106个/mL的孢子悬液,备用。
1.2.4 鸡腿菇抗菌蛋白的抗菌能力测定牛津杯法[16]:在无菌操作条件下,向已灭过菌的干燥的培养皿中倾倒15-20 mL指示菌固体培养基(NA),待其凝固后,用移液枪向上述培养皿中加入0.2 mL枯草芽孢杆菌指示菌菌悬液,用无菌涂布器涂匀。在培养皿中放置牛津杯,每个牛津杯中加0.2 mL的供试菌鸡腿菇抗菌蛋白。将培养皿平稳置于4℃冰箱,扩散24 h后再置于25℃恒温培养箱中培养3-5 d后取出培养皿测量抑菌圈直径(mm)并记录。每组试验重复3次取平均值,抑菌圈直径的大小来表征抑菌活性,以无菌水为对照。
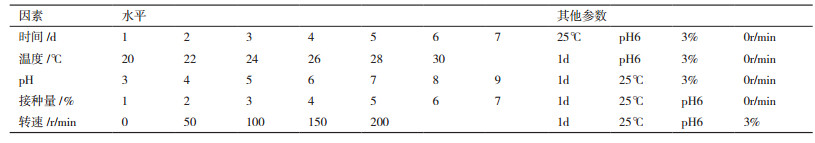
1.2.5 单因素影响试验本试验选择了不同发酵时间、温度、pH、接种量、摇床转速进行单因素试验,按照1.2.2制得的抗菌蛋白进行抗菌能力的测定,记录抑菌圈直径作为指标。不同因子梯度条件见表 1。
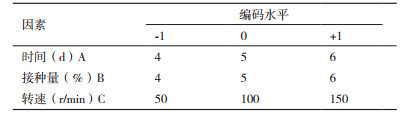
基于单因素试验结果,选用中心组合试验Box-Behnken设计方案,选取发酵时间(d)、接种量(%)以及转速(r/min)3个变量,以A、B、C来表示,并以+1、0、-1分别代表其变量的水平,按方程x =(X-X0)/△X对自变量进行编码,其中,x表示变量的编码值,X表示变量的真实值,X0表示试验中心点变量的真实值,△X表示变量的步长变化,抗菌蛋白的抑菌圈直径Y表示响应值,见表 2。
将鸡腿菇抗菌蛋白冷冻浓缩干燥,进行不同质量浓度梯度的稀释,采用DPPH法、ABTS法、fenton法清除· OH,测定抗菌蛋白的抗氧化活性[17],以VC作阳性对照。
1.2.8 数据分析本试验所有的试验数据均使用Origin和Design-Expert(version8.0.6)统计软件进行数据处理,运用最小差异显著法(LSD)进行差异显著性检验。
2 结果 2.1 单因素试验结果 2.1.1 发酵时间对鸡腿菇抗菌蛋白抗菌能力的影响由图 1所示,在培养初期发酵产物较少,随培养时间的延长,鸡腿菇抗菌蛋白的抑菌圈直径先增后降,发酵时间对其影响极显著(P < 0.01),在5 d时达到最大(20.54±1.26)mm。培养时间继续延长,该菌株由稳定期进入降速期,菌数量逐渐减少,分泌抗菌蛋白能力降低导致抑菌活性逐渐减弱。
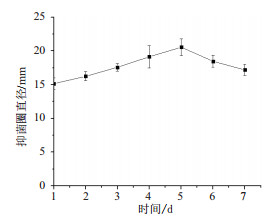
|
| 图 1 发酵时间对鸡腿菇抗菌蛋白抗菌能力的影响 |
由图 2所示,随温度升高,抗菌能力由弱到强,接着又变弱,发酵温度对其影响显著(P < 0.05),当温度达到24℃时抗菌能力最强,抑菌圈直径(18.72±0.9)mm。这是由于鸡腿菇菌丝的生长增殖与产物积累随温度的升高而减少,因此温度过高对鸡腿菇菌丝的生长不利。
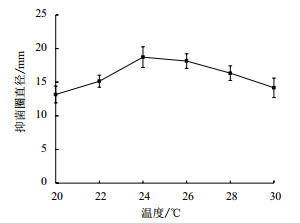
|
| 图 2 发酵温度对鸡腿菇抗菌蛋白抗菌能力的影响 |
由图 3所示,抗菌能力随pH值增加呈现先增后降的趋势,pH值对其影响显著(P < 0.05)。在pH 3-5之间,抗菌蛋白抗菌能力相对较弱;在pH6-7之间,抑菌圈直径明显增大,pH7时抗菌能力最强,抑菌圈直径(17.43±051)mm;此后,抗菌能力随着pH的继续增加开始减弱。结果表明,鸡腿菇菌丝抗菌蛋白对过酸和过碱的条件都比较敏感,抗菌能力受到抑制。
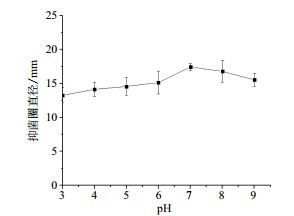
|
| 图 3 接种量对鸡腿菇抗菌蛋白抗菌能力的影响 |
由图 4所示,鸡腿菇抗菌蛋白的抗菌能力随接种量提高呈现不断增强并缓慢减弱的趋势,接种量对其影响极显著(P < 0.01),接种量为5%时抗菌能力最强,抑菌圈直径达(20.14±1.06)mm。随着接种量的继续增大,抗菌能力开始出现减弱的趋势,这是由于在培养基内,菌数量的增大导致分泌的抗菌蛋白随之增多。但当接种量达到一定值后再继续增加其接种量,会导致菌群过于密集产生空间与营养竞争,从而影响生长发育。
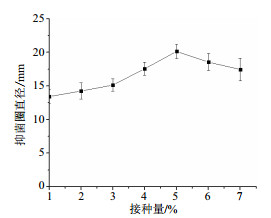
|
| 图 4 接种量对鸡腿菇抗菌蛋白抗菌能力的影响 |
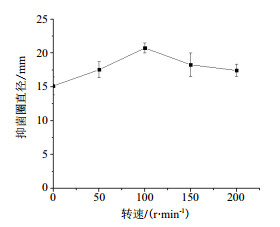
由图 5所示,鸡腿菇抗菌蛋白抗菌能力随着摇床转速的加快呈现出先升后降的趋势,摇床转速对其影响极显著(P < 0.01),在转速为100 r/min抗菌能力最强,抑菌圈直径为(20.74±0.74)mm。这是由于摇床发酵培养可增加通气量,所以随着摇床转速的增大,菌丝生长愈加旺盛。但当摇床转速达到一定值后再继续增大摇床转速则会导致一部分菌体溶解,影响菌丝数量,导致抗菌蛋白产量随之减少,影响了其抗菌能力。
|
| 图 5 摇床转速对鸡腿菇抗菌蛋白抗菌能力的影响 |
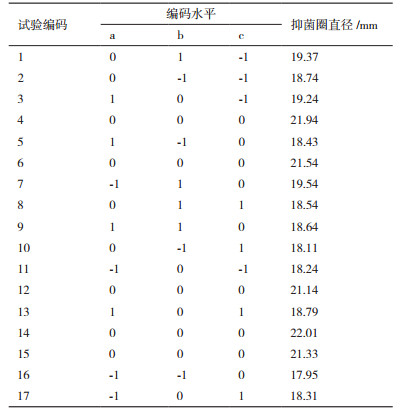
如表 3所示,17个试验点由12个析因点和5个零点组成,析因点是自变量取值在A、B、C所构成的三维顶点,零点表示区域的中心点,其中重复零点试验5次,用来估算试验中的误差。
通过Design-Expert(version8.0.6,)软件对表 3实验数据进行处理,获得抑菌圈直径(Y)对发酵时间(A)、接种量(B)和转速(C)的二次多项回归模型为:
Y =+21.59+0.13 A+0.36 B-0.23 C-0.35AB-0.13AC-0.050B C-1.50A2-1.45B2-1.45C2。
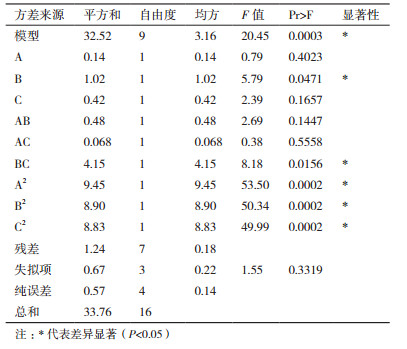
从方差分析表 4中得出模型F值为20.45,对应的P < 0.05,达到显著水平,失拟项的P=0.3319 > 0.05不显著,说明该模型拟合程度较好,试验误差较小,可以用此模型来推测鸡腿菇抗菌蛋白发酵条件对抗菌能力的影响。
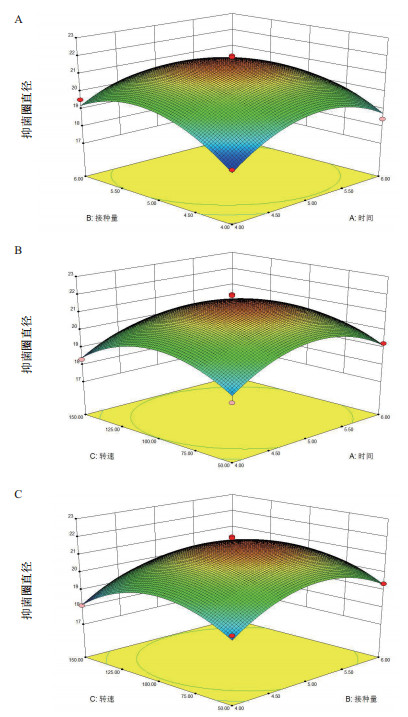
根据模型方程绘制响应面图,分别见图 6。其中每个响应面分别代表两个变量在恒定值(取零水平值)下,另外两个独立变量之间的相互作用。
|
| 图 6 两因素交互作用对抑菌圈直径的影响 |
图 6-A显示可以得知,接种量与发酵时间对抑菌圈直径的交互作用不显著。随着发酵时间逐渐延长和接种量增大情况下,抑菌圈直径先增大然后减小。当接种量5%-5.5%,发酵时间4-5 d时,抑菌圈直径达到最大值。如图 6-B所示,转速和发酵时间对抑菌圈直径的交互作用不显著,随着发酵时间逐渐延长和转速增加,抑菌圈直径逐渐增大,转速在100-125 r/min,培养5-5.55 d时达到最大,之后,与转速与时间呈负相关。通过响应面分析,响应面的坡度较陡,转速和接种量的交互作用对抑菌圈直径有显著影响(P < 0.05),如图 6-C所示,抑菌圈直径随着转速与接种量增加而增大,当转速达到125 r/min,接种量达到5.5%时增长趋势变缓,开始呈现下降的趋势。
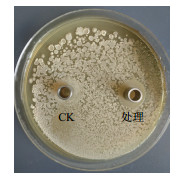
2.2.3 抗菌蛋白的抑菌试验在单因素试验基础上,采用响应面设计得到提取鸡腿菇菌丝发酵液抗菌蛋白的最佳条件为:pH7、接种量5%、温度24℃、时间5 d、转速为100 r/min。在上述条件下培养鸡腿菇菌丝发酵液,经离心过滤,盐析,透析后得到鸡腿菇抗菌蛋白,设置3个重复。采用1.5.4方法培养后,抑菌圈直径均值为21.14 mm,与预测值21.54 mm拟合度良好,与无菌水对照见图 7。
|
| 图 7 抗菌蛋白的抑菌活性 CK:无菌水;处理:抗菌蛋白 |
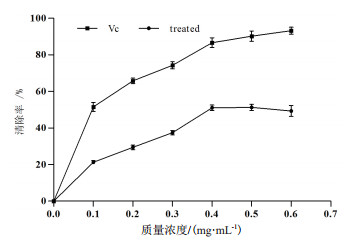
如图 8所示,随着抗菌蛋白质量浓度的增大,对DPPH自由基的清除能力逐渐增大,当抗菌蛋白质量浓度为0.1-0.4 mg/mL范围内,对DPPH自由基的清除率显著增大。当质量浓度大于0.4 mg/mL时,对DPPH自由基的清除率随质量浓度增加而减弱,但与同质量浓度的VC标准品相比,抗菌蛋白清除DPPH自由基的能力明显较弱。通过方差分析表明,各质量浓度间对DPPH自由基的清除能力的差异显著,在一定质量浓度范围内抗菌蛋白与清除能力表现出剂量(质量浓度)-效应关系。
|
| 图 8 不同浓度抗菌蛋白对DPPH自由基的清除作用 |
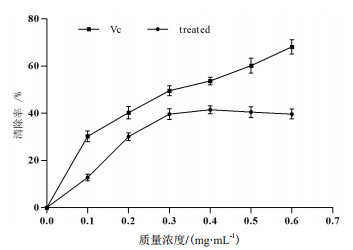
如图 9所示,抗菌蛋白对ABTS自由基的清除能力随质量浓度的增大呈现出先增后减趋势。当质量浓度为0.4 mg/mL时,清除率达到最大值42.63%,统计分析表明,此时的清除率显著高于其他质量浓度;质量浓度继续增大,ABTS自由基清除率则呈下降趋势。与同质量浓度的VC标准品相比,抗菌蛋白清除ABTS自由基能力相对较弱。
|
| 图 9 不同浓度抗菌蛋白对ABTS自由基的清除作用 |
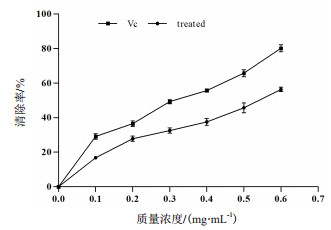
如图 10所示,在浓度0.1-0.6 mg/mL范围内服从线性分布y=3.678 6+64.929x,(R2=0.987 2),质量浓度0.1-0.6 mg/mL的抗菌蛋白对羟自由基清除率随着其质量浓度的增加而增加,说明抗菌蛋白对羟自由基清除力的大小与其质量浓度呈现正相关。与同质量浓度的VC标准品相比,抗菌蛋白清除羟自由基能力相对较弱,但是呈现出一定的线性关系。
|
| 图 10 不同浓度抗菌蛋白对羟自由基的清除作用 |
利用食用菌液体发酵可以在较短时间获得大量菌丝体及其发酵产物,其中包括多糖、肽类、蛋白、生物碱、萜类化合物、甾醇、酶等多种化合物及植物激素等多种生理活性物质,往往诸类生理活性物质含量高于子实体,在抗癌、消炎、抗衰老、抗菌和提高免疫力等方面有显著功效[18-20]。食用菌液体发酵培养往往受温度、pH、摇床振荡频率及接种量等因素影响,因此,液态发酵条件优化无疑一个关键步骤[21-22]。戴兵等[14]设置摇床温度为25℃,转速为160 r/min,培养时间为7 d,得到香菇菌丝发酵液,经过滤、硫酸铵沉淀得到香菇菌丝发酵液蛋白。香菇C91-3菌丝发酵液已被证实具有明显的体外抗肿瘤、抗细菌作用[23];张中林等[24]对真菌菌丝发酵液抗氧化活性检测,SOD酶活性为鸡腿菇 > 金针菇,GSH-Px酶活性为鸡腿菇 > 香菇 > 金针菇,结果表明菌丝发酵液均有较强的抗氧化能力。陆武祥等[25]通过5种食用菌液体发酵菌丝得到蛋白和多糖,进行含量测定及各发酵液蛋白的抗氧化活性测定,其中,鸡腿菇有较强的抗氧化能力,随着蛋白含量的增高,抗氧化活性越强。本研究发现鸡腿菇菌丝发酵液抗菌蛋白对羟自由基清除率随着其质量浓度的增加而增加,这与学者张中林研究一致。有关该菌株所产抗菌蛋白的进一步精细纯化和基因表达等相关研究还待深入。
4 结论在单因素试验的基础上,将响应面分析法应用于鸡腿菇液体发酵产抗菌蛋白的研究,实验结果表明,发酵时间、摇床转速及接种量是影响抗菌蛋白产量的主要因素。最佳条件为:时间5 d、温度30℃、pH7、接种量5%、摇床转速100 r/min,在此条件下抗菌蛋白的抑菌圈直径达21.14 mm。同时,测定了鸡腿菇菌丝发酵液抗菌蛋白的抗氧化能力,对DPPH、ABTS自由基的清除能力相对较弱,而对羟基自由基(·OH)有较强的清除作用,其抗氧化能力随着抗菌蛋白质量浓度的增加而增强。
| [1] |
赵春江. 鸡腿菇子实体蛋白提取、特性及酶解研究[D]. 杭州: 浙江大学, 2012.
|
| [2] |
陈启武, 刘健, 陈莎. 鸡腿蘑、姬松茸、大球盖菇生产全书[M]. 北京: 中国农业出版社, 2009, 7-8.
|
| [3] |
曾嵋涓. 鸡腿蘑液体深层发酵的研究[D]. 无锡: 江南大学, 2002.
|
| [4] |
赵春江, 陈士国, 彭莉娟, 等. 鸡腿菇功能性成分及其功效研究进展[J]. 食品工业科技, 2012, 33(5): 429-432. |
| [5] |
崔鹏举. 富硒毛头鬼伞菌丝深层发酵培养及其降血糖活性研究[D]. 汕头: 汕头大学, 2009.
|
| [6] |
Yamac M, Zeytinoglu M, Kanbak G, et al. Hypoglycemic effect of crude exopolysaccharides produced by Cerrena unicolor, Coprinus comatus and Lenzites Betulina isolates in streptozotocin-induced diabetic rats[J]. Pharmaceutical Biology, 2009, 47(2): 168-174. DOI:10.1080/13880200802436950 |
| [7] |
Tsai SY, Tsai HL, Mau JL. Antioxidant properties of Coprinus comatus[J]. Journal of Food Biochemistry, 2009, 33(3): 368-389. DOI:10.1111/jfbc.2009.33.issue-3 |
| [8] |
李海龙. 鸡腿菇发酵液降血糖活性研究[D]. 镇江: 江苏大学. 2008.
|
| [9] |
Vaz JA, Barros L, Martins A, et al. Chemical composition ofwild edible mushrooms and antioxidant properties of their watersoluble polysaccharidic and ethanolic fractions[J]. Food Chemistry, 2011, 126(2): 610-616. DOI:10.1016/j.foodchem.2010.11.063 |
| [10] |
刘凤珠, 卫军, 牛小明. 鸡腿菇的抑菌作用及在保鲜中的应用[J]. 食品科技, 2003(5): 89-91. |
| [11] |
吴艳兵, 谢荔岩, 谢联辉, 等. 毛头鬼伞多糖抗烟草花叶病毒活性研究初报[J]. 中国农学通报, 2007, 23(5): 338-341. |
| [12] |
Wu LP, Wu ZJ, Lin D, et al. Characterization and amino acid sequence of y3, an antiviral protein from mushroom Coprinus comatus[J]. Chinese Journal of Biochemistry and Molecular Biology, 2008, 24(7): 597-603. |
| [13] |
王学仁. 担子菌毛头鬼伞的TMV抗性蛋白y3基因的分离、鉴定和表达[D]. 西安: 西北大学, 2010.
|
| [14] |
戴兵, 黄敏, 宁安红, 高鹏. 香菇菌丝C91-3发酵液蛋白抑制小鼠宫颈癌细胞株U14生长及诱导凋亡的实验研究[J]. 浙江医学, 2004, 26(9): 656-658. |
| [15] |
许峰. 大球盖菇富硒液体培养条件优化及抗氧化能力初步研究[D]. 泰安: 山东农业大学, 2006.
|
| [16] |
杨桥, 韩文菊, 张文俊, 等. 产Maerolactin A抗生素海洋解淀粉芽孢杆菌的鉴定及发酵条件优化[J]. 药物生物技术, 2009, 16(4): 311-315. |
| [17] |
吴艳兵, 谢荔岩, 谢联辉, 等. 毛头鬼伞(Coprinus comatus)多糖的理化性质及体外抗氧化活性[J]. 激光生物学报, 2007, 16(4): 438-442. |
| [18] |
周键, 孙培龙, 赵培城, 高红林. 食用菌深层发酵的研究进展[J]. 微生物学通报, 2003, 30(6): 111-114. |
| [19] |
Zaidaman BZ, Wasser SP, Nevo E, et al. Coprinus comatus and Ganoderma lucidum interfere with androgen receptor function in LNCaP prostate cnacer cells[J]. Molecular Biology Reports, 2088, 35(2): 107-117. |
| [20] |
余杰, 崔鹏举, 崔仕超, 等. 鸡腿菇菌丝深层培养富硒的研究[J]. 食品与发酵工业, 2008, 34(7): 93-97. |
| [21] |
陈娟, 朱忠贵, 李萍萍. 食用菌液体发酵技术的研究进展与发展前景[J]. 食用菌, 2006(增刊): 4-5. |
| [22] |
Leelasuphakul W, Sivanunsakul P, Phongpaichit S. Puri-fication, characterization and synergistic activity of β-1, 3-glucanase and antibiotic extract from an antagonistic Bacillus subtilis NSRS 89 -24 against rice blast andsheath blight[J]. Enzyme and Microbial Technology, 2006, 38(7): 990-997. DOI:10.1016/j.enzmictec.2005.08.030 |
| [23] |
黄敏, 宁安红, 张卓然, 等. 香菇C91-3菌发酵液小鼠体内抗肿瘤作用的研究[J]. 中国微生态杂志, 1996, 8(3): 38-40. |
| [24] |
张中林, 郑剑玲, 张锦萍, 王美慧. 真菌菌丝发酵液抗氧化活性检测[J]. 中国微生态学杂志, 2007, 19(2): 165-167. |
| [25] |
陆武祥, 王东华, 王秀英, 徐艳. 5种食用菌液体发酵菌丝抗氧化活性分析比较[J]. 食品与发酵工业, 2013, 39(7): 124-127. |