2. 山西农业大学园艺学院, 太谷 030801;
3. 黄土高原食用菌提质增效协同创新中心, 太谷 030801
2. College of horticulture, Shanxi Agricultural University, Taigu 030801;
3. Collaborative Innovation Center of Quality and Efficiency of Loess Plateau Edible Fungi for Universities in Shanxi, Taigu 030801
秀珍菇(Pleurotus geesterani Singer)是一种可食用的大型真菌, 又被称为印度鲍鱼菇、环柄香菇、姬平菇。隶属于真菌门, 担子菌纲, 伞菌目, 侧耳科, 侧耳属, 产于印度南部查摩省, 是热带和亚热带地区蕈菌[1]。1974年, 由菌物学家Jandiaik驯化成功, 经分离并人工栽培, 秀珍菇被证实是一株高产且性状优良的食用真菌。为更好利用这一珍稀菌物资源, 众多研究者已开展了对其优良菌株的选育工作。与常规育种相比, 原生质体技术可以实现远缘杂交、扩大遗传物质的重组范围以及基因转化和定向诱变, 获得有突出优良性状的新型菌株, 产生更丰富的遗传变异[2]。原生质体因去掉了细胞壁的障碍而对外界刺激的敏感度显著提高, 是诱变的良好材料[3]。原生质体制备[4]是原生质体技术育种的基础和重要前提, 如何提高原生质体产量及同时保证其较高再生率是此项技术的关键研究点。
秀珍菇中含有的秀珍菇多糖具有抗氧化[5]、防衰老[6]、抗肿瘤等功效, 目前国内研究多集中于秀珍菇多糖提取[7]和纯化[8]方法的优化, 以及秀珍菇多糖的结构[9]和生物活性[10]。利用原生质体育种[11]进行突变、杂交、基因转导等操作, 成为获取秀珍菇多糖高产菌株的一种有效方法。有关秀珍菇原生质体制备的研究较少, 且秀珍菇单孢子菌株原生质体制备条件的优化与再生的研究未见报道。本研究从影响酶促反应的因素(菌龄、稳渗液种类及浓度、酶浓度、酶解温度、酶解时间)出发, 系统地对影响原生质体制备的因素进行了研究, 以期获得原生质体制备和再生的最优条件, 为利用原生质体融合及基因组改组等选育更为优良的菌株提供参考。
1 材料与方法 1.1 材料 1.1.1 供试菌株秀珍菇188由山西农业大学食用菌中心提供。
1.1.2 试剂溶壁酶(广东省微生物研究所), Tris-HCl(Boster), 其他试剂均为国产分析纯。
1.1.3 培养基秀珍菇188单孢菌株生长培养基PDA:马铃薯200 g, 葡萄糖20 g, 琼脂20 g, 用水定容至1 L, 高压灭菌。秀珍菇188单孢菌株培养基PDB:马铃薯200 g, 葡萄糖20 g, 用水定容至1 L, 高压灭菌。原生质体液体再生培养基:PDB添加0.6 mol/L甘露醇和10 mmol/L Tris-HCl。原生质体固体再生培养基:PDA添加0.6 mol/L甘露醇和10 mmol/L Tris-HCl。
1.1.4 稳渗液制备甘露醇稳渗液:称取10.9 g甘露醇溶解于100 mL蒸馏水中, 制备成0.6 mol/L的甘露醇稳渗液, 灭菌备用。称取7.2 g MgSO4溶解于100 mL蒸馏水中, 制备成0.6 mol/L的MgSO4稳渗液灭菌备用。称取20.54 g蔗糖溶解于100 mL蒸馏水中, 制备成0.6 mol/L的蔗糖稳渗液灭菌备用。称取3.51 g NaCl溶解100 mL蒸馏水中, 制备成0.6 mol/L的NaCl稳渗液灭菌备用。称取4.5 g KCl溶解于100 mL蒸馏水中, 制备成0.6 mol/L的KCl稳渗液灭菌备用。1.1.5酶解液制备按试验设计的浓度要求精确称取溶壁酶溶解于灭菌的稳渗液中, 制备成酶解液, 过滤除菌备用。
1.2 方法 1.2.1 秀珍菇188单孢菌株获取秀珍菇188栽培种培养基配方:棉籽壳81%、麸皮15%、过磷酸钙1%、石膏粉1%、石灰1%、葡萄糖1%。秀珍菇188栽培种在22℃培养箱中发菌, 待菌丝满瓶后置于25℃, 65%湿度条件的人工气候培养箱中出菇。采收菇体健壮的秀珍菇子实体, 剪去菌柄, 将子实体菌褶朝下放置于铺有无菌硫酸纸的无菌平板内。12 h以后在硫酸纸上可见白色单孢子印, 用无菌刀片刮取单孢子于无菌试管中, 稀释涂布于PDA平板上, 25℃培养3-4 d后, 于显微镜下显微操作挑出单个孢子菌丝体, 接种于PDA试管中培养。单孢菌丝约一周左右长满满管(15 mm×150 mm), 菌丝呈放射状生长, 菌丝体整齐均匀洁白。挑选出优良单孢菌丝菌株供原生质体制备与再生使用。
1.2.2 原生质体的制备与再生将秀珍菇188单孢菌株接种于加有玻璃纸的PDA培养基上, 25℃培养。收集菌丝于已知重量的离心管中, 称重, 用无菌渗透压稳定剂冲洗2-3次, 4 000 r/min离心15 min, 除去上液, 得到纯净的菌丝, 备用。将收集的菌丝置于5 mL离心管中, 按菌丝:酶解液=1 g:5 mL的比例加入酶解液, 置于水浴锅中试验设计温度下水浴酶解, 隔10 min振荡一次, 按照试验设计时间酶解结束后, 取0.1 mL原生质体稀释适当倍数后, 血球计数板计数, 重复3次。将酶解液用5层擦镜纸过滤, 按试验设计的酶解时间加入8倍体积的稳渗液终止酶解后制备成原生质悬浮液, 原生质体悬浮液4 000 r/min离心10 min后去除上清液, 沉淀用渗透压稳渗液稀释再离心, 重复3次后用渗透压稳定剂重悬得到较纯的原生质体悬液。将上述得到的原生质体悬液取等体积2份, 一份用渗透压稳定剂稀释至1×105 CFU/mL, 取1 mL加入到9 mL含有渗透压稳定剂的液体PDA培养基中, 25℃, 100 r/min摇床中恢复再生培养24 h, 每个PDA平板取0.1 mL液体菌液均匀涂布, 10 mL共涂布100个平行(每个平板上获得的菌落数的均值记为A), 另一份加入与上述稀释原生质体所用的渗透压稳定剂体积相同的无菌水作为对照, 同样条件下液体恢复再生培养24 h后, 每个PDA平板取0.1 mL液体菌液均匀涂布, 10 mL共涂布100个平行(每个平板上获得的菌落数的均值记为B)。原生质体再生率=[(A-B)/C]×100%, 选取未染菌的10个最优平板计数。C:每个平板上涂布的原生质体数量(0.1×0.1 mL×105 CFU/mL=103 CFU)。平板置于25℃恒温培养箱中培养。
1.2.3 显微观察制片, 于显微镜100×油镜下观察秀珍菇188菌株与其单孢菌株的显微形态。取少量原生质体悬液于凹玻片中, 显微镜100×油镜和40×物镜下观察原生质体释放过程并拍照。
1.2.4 秀珍菇单孢子菌丝体最佳原生质体制备和再生单因素试验 1.2.4.1 菌丝体菌龄对原生质体制备及再生影响菌丝体菌龄设定为:4 d、5 d、6 d、7 d、8 d、9 d、10 d, 在酶解液浓度为1.6%, 酶解温度29℃, 酶解时间为160 min的条件下, 以0.6 mol/L甘露醇和10 mmol/L Tris-HCl为稳渗液酶解制备原生质体悬浮液并镜检计数, 以原生质体释放量大和原生质体再生率高为优选指标, 筛选优化的菌丝体菌龄。
1.2.4.2 酶解液浓度对原生质体制备及再生影响酶解液浓度设定为:0.4%、0.8%、1.2%、1.6%、2.0%、2.4%和3.0%, 以菌龄为8 d的秀珍菇188单孢子菌丝体为酶解对象, 在29℃下, 酶解时间为160 min的条件下, 以0.6 mol/L甘露醇和10 mmol/L Tris-HCl为稳渗液酶解制备原生质体悬浮液并镜检计数, 以原生质体释放量大和原生质体再生率高为优选指标, 筛选优化的酶解液浓度。
1.2.4.3 酶解温度对原生质体制备及再生影响酶解温度设定为:23、25、27、29、31、33和35℃, 以菌龄为8 d的秀珍菇188单孢子菌丝体为酶解对象, 在酶解液浓度为1.6%, 酶解时间为160 min的条件下, 以0.6 mol/L甘露醇和10 mmol/L Tris-HCl为稳渗液酶解制备原生质体悬浮液并镜检计数, 以原生质体释放量大和原生质体再生率高为优选指标, 筛选优化的酶解温度。
1.2.4.4 酶解时间对原生质体制备及再生影响酶解时间设定为:40、80、120、160、200、240和280 min, 以菌龄为8 d的秀珍菇188单孢子菌丝体为酶解对象, 在酶解液浓度为1.6%, 酶解温度29℃的条件下, 以0.6 mol/L甘露醇和10 mmol/L Tris-HCl为稳渗液酶解制备原生质体悬浮液并镜检计数, 以原生质体释放量大和原生质体再生率高为优选指标, 筛选优化的酶解时间。
1.2.4.5 稳渗液种类对原生质体制备及再生影响稳渗液种类为:0.6 mol/L的甘露醇、MgSO4、蔗糖、NaCl、KCl稳渗液, 以菌龄为8 d的秀珍菇188单孢子菌丝体为酶解对象, 在酶解液浓度1.6%, 酶解温度29℃, 酶解时间为160 min的条件下制备原生质体悬浮液并镜检计数, 以原生质体释放量大和原生质体再生率高为优选指标, 筛选优化的稳渗液。
1.2.4.6 优选稳渗液浓度以及Tris-HCl的添加对原生质体制备及再生影响稳渗液浓度为:0.2 mol/L、0.4 mol/L、0.6 mol/L、0.8 mol/L、1.0 mol/L、0.6 mol/L+T、0.8 mol/L+T, 以菌龄为8 d的秀珍菇188单孢子菌丝体为酶解对象, 在酶解液浓度1.6%, 酶解温度29℃, 酶解时间为160 min的条件下制备原生质体悬浮液并镜检计数, 以原生质体释放量大和原生质体再生率高为优选指标, 进行稳渗液浓度以及Tris-HCl添加的优化筛选。
1.2.5 秀珍菇单孢子菌丝体最佳原生质体制备和再生正交试验设计根据单因素试验结果, 表 1设定不同因素和水平, 进行L9(33)正交设计。在优化的菌龄和稳渗液条件下, 制备原生质体悬浮液, 进行L9(33)正交设计, 以原生质体释放量和原生质体再生率为指标, 筛选优化的酶浓度、酶解温度、酶解时间。
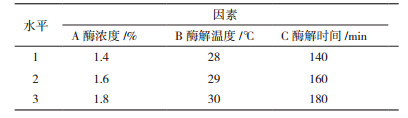
由图 1可见, 秀珍菇188单孢菌株菌丝体较秀珍菇188菌株菌丝体纤细, 秀珍菇188菌株菌丝体有明显的锁状联合, 秀珍菇188单孢菌株菌丝无锁状联合。

|
| 图 1 秀珍菇188菌株与其单孢菌株显微观察 A:100×油镜下秀珍菇188菌株的显微观察图; B:100×油镜下秀珍菇188菌株单孢菌株的显微观察图 |
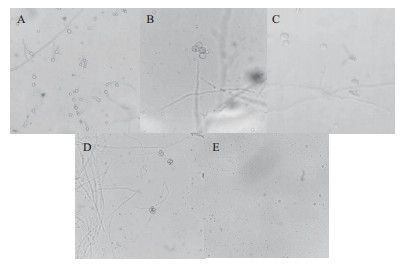
秀珍菇188菌株单孢菌株细胞壁被酶分解后, 原生质体的释放有多种形式, 且释放时间不同步。在40×物镜和100×油镜下可以清楚的看到原生质体逐渐从菌丝尖端(图 2-A和2-B)释放出来, 在100×油镜下观察到原生质体从菌丝体侧面(图 2-C)释放出来, 原生质体呈球体状, 大小差异较大。在40×物镜下观察到, 部分原生质体内含大液泡(图 2-D)。原生质体经4-6层无菌擦镜纸过滤纯化后, 菌丝残渣被完全过滤掉, 40×镜下可观察到大量大小不一的原生质体(图 2-E)。
|
| 图 2 秀珍菇188菌株单孢菌株原生质体释放过程与方式的观察 |
菌龄为4-5 d的单孢子菌丝体过于幼嫩很难获得原生质体, 而且获得的原生质体容易降解; 而生长8-10 d的单孢子菌丝体由于生长时间过长, 过厚的菌壁使得溶壁酶难以裂解得到大量原生质体; 取生长6-8 d的秀珍菇188单孢子菌丝体作为酶解对象可以成功裂解获得量大质优的原生质体, 菌龄为8 d时获得的原生质体数量和再生率都最好(图 3)。

|
| 图 3 菌丝体菌龄对原生质体制备及再生影响 |
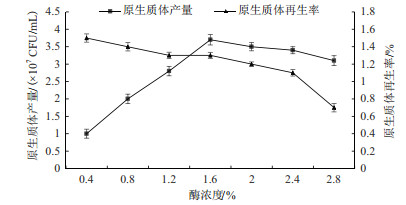
酶浓度从0.4%增大到1.2%时, 原生质体产量迅速增加。酶浓度由1.2%增加到1.6%时, 原生质体产量增加速度趋于缓慢(图 4), 原因是酶浓度逐渐达到饱和。随着溶壁酶浓度继续提升, 原生质体产量开始降低, 原生质体的完整性逐渐被破坏, 伴随着原生质体的活力下降, 原生质体再生率也下降。所以, 最佳酶浓度应控制在1.6%。
|
| 图 4 酶解液浓度对原生质体制备及再生影响 |
随着酶解温度的提升, 溶壁酶活力提高, 原生质体产量也逐步增加, 在酶解温度为29℃时, 秀珍菇188单孢子菌丝体原生质体产量达到最大且原生质体再生率也较高(图 5)。
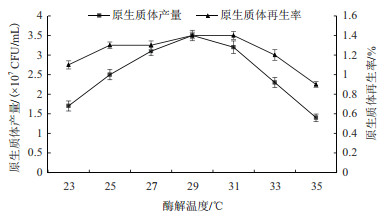
|
| 图 5 酶解温度对原生质体制备及再生影响 |
酶解80-120 min后, 由于未被酶解的菌丝体较多, 释放出的原生质体较少。酶解240-280 min后得到的原生质体有酶解过度破裂现象, 原生质体再生率降低; 酶解300 min后, 原生质体开始被严重破坏, 接着酶解, 原生质体全部被酶解为碎片残渣; 酶解时间为120-200 min时, 可获得量大质优的秀珍菇188单孢菌株原生质体(图 6)。
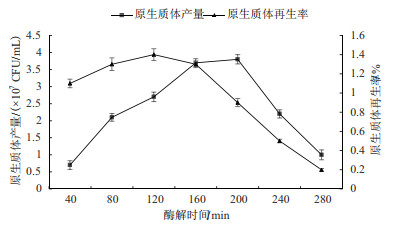
|
| 图 6 酶解时间对原生质体制备及再生影响 |
在原生质体制备过程中, 菌丝在酶解作用下, 细胞壁不断被分解形成单个的原生质体。在一定范围内无论酶解时间长短, 原生质体的获得量均在原生质体制备量最大值左右波动变化, 继续酶解最终会导致细胞壁被完全酶解破坏, 过长的酶解时间使得原生质体的再生率下降, 原生质体由于无法合成新的细胞壁而不能再生。考虑到节约实验操作时间以减少杂菌污染, 优化选择的酶解时间为160 min。
2.6 稳渗液种类对原生质体制备及再生影响研究(图 7)发现, 在不加其他成分的PDB中, 秀珍菇188单孢子菌丝体原生质体无法再生成功, PDB中添加甘露醇、硫酸镁、氯化钠作为渗透压稳定剂时可以再生成功。稳渗液的添加以甘露醇效果最好, 可以很好地保护秀珍菇188、单孢子菌丝体原生质体的完好性。
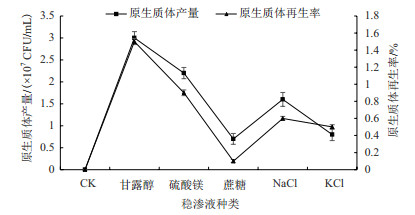
|
| 图 7 稳渗液种类对原生质体制备及再生影响 |
优选稳渗液甘露醇的浓度和Tris-HCl的添加对秀珍菇188单孢子菌丝体原生质体形成及再生有很大影响, 特别是0.6 mol/L的甘露醇和10 mmol/L的Tris-HCl混合稳渗液对于秀珍菇188单孢子菌丝体原生质的获得及再生效果明显(图 8)。
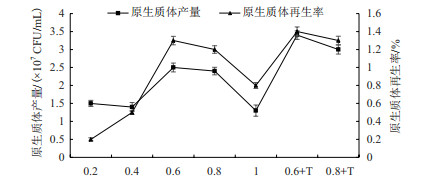
|
| 图 8 优选稳渗液浓度以及Tris-HCl的添加对原生质体制备及再生影响 |
原生质制备的酶浓度、酶解温度、酶解时间正交试验结果见表 2。以原生质体产量为评价指标, 对结果进行极差分析可知各因素对原生质体制备的影响从大到小的顺序为:酶浓度(A)>酶解温度(B)>酶解时间(C), 最佳方案应为A2B1C3, 此条件下原生质体产量达到最大值3.5×107 CFU/mL。以原生质体再生率为评价指标, 对结果进行极差分析可知各因素对原生质体制备的影响从大到小的顺序为:酶浓度(A)=酶解时间(C)>酶解温度(B), 最佳方案应为A2B2C2, 此条件下原生质体再生率达到最大值1.5%。
本试验研究中要同时考虑到原生质体的制备量和原生质体的再生率, 所以以原生质体产量和原生质体再生率的乘积数值为最终评价指标, 对结果进行极差分析可知各因素对原生质体制备和再生的影响从大到小的顺序为:酶浓度(A)>酶解时间(C)>酶解温度(B), 最终最佳方案为A2B2C2, 此条件下原生质体产量和原生质体再生率的乘积数值达到最大值51。综合以上评价指标分析, 酶浓度对原生质体制备和再生影响最大。最终得到最佳秀珍菇单孢菌丝体原生质体制备和再生指标:酶浓度1.6%, 酶解时间160 min, 酶解温度29℃。
2.9 验证试验按照正交试验优化结果选取最佳原生质体制备和再生条件:在菌龄为8 d、稳渗液为0.6 mol/L甘露醇和10 mmol/LTris-HCl的混合稳渗液, 酶浓度1.6%, 酶解时间160 min, 酶解温度29℃条件下进行验证试验。在此条件下秀珍菇188单孢子菌丝体原生质体释放量为3.5×107 CFU/mL, 原生质体再生率为1.4%, 原生质体释放量与原生质体再生率乘积数值为4.9, 与正交结果相近, 证明本试验结论可靠。
3 讨论在育种试验中, 当需要获取亲本菌株的单核原生质体菌株时, 通用方法为制备亲本原生质体, 然后由于在原生质体制备过程中, 会有部分原生质体失去一个细胞核变成单核原生质体。但是在后期的试验操作流程中, 需用常规方法检测是否有锁状联合来区分单双核原生质体菌株, 试验流程较为缓慢。针对那些可以产孢子的菌株, 就可以先获取其孢子, 然后制备单核原生质体菌株, 可以保证获取到的原生质体菌株均为单核。而对于那些不产孢子的菌株, 或者是野生条件下难以采集孢子的野生菌株[12], 可以选用原生质体单核化技术获取其单核菌株。
对于不同种属的食用菌, 细胞壁化学组成不尽相同, 因此在制备原生质体时所需酶也会有差异[13]。许多研究者经过大量的试验发现, 溶壁酶对侧耳属的菌种酶解效果相对较好。因此本研究采用单一酶溶壁酶[14]来制备原生质体。相比较其他文献中单一考虑原生质体的产量, 本研究在单因素试验和正交试验中同时考虑到原生质体的产量和再生率[15], 为与秀珍菇188单孢子原生质体相关试验中原生质体的实际操作使用提供了数据支持, 使得研究结果更符合试验实际操作的要求。
在原生质体纯化上, 采用5层擦镜纸进行纯化过滤。相比无菌脱脂棉过滤法[16], 原生质体数量下降幅度较无菌脱脂棉过滤法小, 操作更为简单, 也降低了染菌率。原生质体的得率是原生质体再生的前提条件, 本研究选取加有玻璃纸[17]的PDA作为菌丝生长培养基, 菌丝的收集更加方便快捷, 缩短了菌丝收集流程, 大幅度降低染菌几率。综合多个文献资料, 选择菌丝体清洗的离心转速为4 000 r/min, 在此转速条件下[18]收集到的原生质体量大且活性高。在原生质体制备和再生过程中, 没有对pH进行调节, 保持pH自然, 避免影响到原生质体外膜, 进而影响原生质体再生率。
4 结论本研究以原生质体产量, 原生质体再生率以及两者乘积数值为评价指标, 采用单因素试验和正交试验对其原生质体制备条件进行优化, 最终确定了原生质体制备的最佳条件:在菌龄为8天、稳渗液为0.6 mol/L甘露醇和10 mmol/LTris-HCl的混合稳渗液, 酶浓度1.6%, 酶解时间160 min, 酶解温度29℃。在此条件下, 原生质体产量达到3.5×107 CFU/mL, 原生质体再生率达到1.4%, 两者乘积数值为4.9。
| [1] |
袁菁艺. 利用甘草渣栽培秀珍菇和姬菇的研究[D]. 广州: 华南农业大学, 2016.
|
| [2] |
常明昌. 食用菌栽培学[M]. 北京: 中国农业出版社, 2003.
|
| [3] |
朱蕴兰, 陈安徽, 王陶, 等. 冬虫夏草原生质体诱变育种研究[J]. 食品科学, 2010, 31(5): 256-260. |
| [4] |
Li M, Yi P, Liu Q, et al. Biodegradation of benzoate by protoplast fusant via intergeneric protoplast fusion between Pseudomonas putida and Bacillus subtili[J]. International Biodeterioration & Biodegradation, 2013, 85(7): 577-582. |
| [5] |
孙玉军, 江昌俊, 祝嫦巍, 等. 秀珍菇多糖PMP-2a的理化性质及其体外抗氧化活性研究[J]. 现代食品科技, 2014, 30(12): 79-84. |
| [6] |
孙玉军, 江昌俊, 任四海. 秀珍菇多糖对D-半乳糖致衰老小鼠的保护作用[J]. 食品科学, 2017, 38(5): 251-256. DOI:10.7506/spkx1002-6630-201705041 |
| [7] |
耿中华, 李超. 秀珍菇多糖的超声波协同微波提取工艺及其抗氧化活性研究[J]. 食品工业, 2014, 35(9): 110-114. |
| [8] |
许媚. 秀珍菇子实体多糖的分离纯化、结构鉴定和生物活性研究[D]. 杭州: 浙江工业大学, 2013.
|
| [9] |
张安强, 许媚, 周赛静, 等. 秀珍菇子实体多糖中3-O-甲基-半乳糖组分的谱学鉴定[J]. 药物分析杂志, 2013, 33(01): 90-93, 115. |
| [10] |
Silveira MLL, Smiderle FR, et al. Exopolysaccharide produced by Pleurotus sajor-caju:Its chemical structure and anti-inflammatory activity[J]. Int J Biol Macromol, 2015, 75(1): 90-96. |
| [11] |
杨建远, 李静, 范亚苇, 等. 粗壮脉纹孢菌原生质体的制备、再生及转化的条件[J]. 食品科学, 2015, 36(17): 169-172. DOI:10.7506/spkx1002-6630-201517032 |
| [12] |
孙勇, 曹小迎, 陈永强, 等. 桦褐孔菌原生质体制备与再生[J]. 食品科学, 2011, 32(16): 161-164. |
| [13] |
高跃, 袁萍, 茅仁刚, 等. 云芝菌丝体原生质体制备与再生条件的研究[J]. 食用菌学报, 2008(1): 65-68. |
| [14] |
李艳丽, 金周雨, 李玉. 刺芹侧耳原生质体酶解条件的优化[J]. 食品科学, 2010, 31(10): 155-158. |
| [15] |
彭轶楠, 王沛雅, 巩晓芳, 等. 生防真菌寡雄腐霉原生质体的制备及再生[J]. 菌物学报, 2017, 36(6): 679-690. |
| [16] |
张鹏, 龚玲凤, 朱坚, 等. 刺芹侧耳与秀珍菇细胞融合及融合子的鉴定[J]. 食用菌学报, 2013, 20(3): 1-5. |
| [17] |
李江, 袁月祥, 闫志英, 等. 毛栓菌原生质体制备和再生及单核菌株产漆酶特性[J]. 菌物学报, 2012, 31(1): 102-109. |
| [18] |
周明明, 李晓雁, 任梦楠, 等. 韦兰胶合成菌的原生质体制备与再生研究[J]. 生物技术通报, 2016(7): 126-130. |