2. 山东大学生命科学学院微生物技术国家重点实验室, 济南 250010
2. State Key Laboratory of Microbial Technology, School of Life Science, Shandong University, Jinan 250010
萜类化合物是由异戊二烯五碳单元(C5)为基本碳骨架的一大类碳氢化合物, 根据C5单元的数量和连接方式可将其分为单萜(C10)、倍半萜(C15)、双萜(C20)、三萜(C30)、四萜(C40)、多萜等[1]。这些化合物种类繁多, 功能多样, 广泛分布于古细菌、细菌、植物、昆虫中。研究较多的是倍半萜以及多萜类化合物在医药和食品领域的应用。例如, 倍半萜青蒿素及衍生物较早就被用于治疗疟疾[2]; 二萜紫杉醇更是具有抗多种肿瘤的神奇功效[3]; 四萜番茄红素具有抗氧化、预防心血管疾病的作用[4]。单萜类化合物是植物精油的主要成分, 除了常用于香料及食用香精、化妆品的合成, 其在医药、化工领域也有重要的应用。例如, 香叶醇常被用于香料及化妆品的生产, 也可以作为临床抗癌药物、单萜吲哚生物碱类化合物(Monoterpene indole alkaloids)喜树碱、长春新碱等的合成前体[5]。大部分单萜类化合物对细胞具有一定的毒性, 故常用于抗菌剂和杀虫剂的生产。近年来, 单萜作为极具潜力的生物燃料, 也越来越受到人们的重视。例如, 香叶醇、柠檬烯和蒎烯二聚物具有较高的燃烧热值, 是航空燃料未来潜在的理想选择[6-8]。
目前, 单萜类化合物主要从植物中提取分离, 但由于其产量低, 成本高, 生产周期长, 且提取和纯化比较困难, 不利于大规模生产和应用。而化学合成面临工序繁多且分离困难等问题, 而且化学合成法很难实现化学结构复杂及有特定亲和性和专一性的萜类化合物的合成。因此, 随着生物合成学的迅速发展, 许多研究者通过基因工程、代谢工程和合成生物学手段, 利用微生物合成萜类化合物, 为萜类化合物的合成提供了清洁生产的新途径[1]。酿酒酵母是一种最简单的模式真核生物, 具有生长速度快, 对环境耐受性高, 环境友好, 遗传操作技术成熟, 且易于表达植物来源的P450单加氧酶等优势, 是萜类化合物合成的理想的底盘细胞。目前, 研究人员通过萜类合成途径的引入和优化、酿酒酵母前体代谢物合成的强化、全局代谢网络工程化改造等策略, 多种萜类化合物已经在酿酒酵母中获得了异源合成, 有些化合物也获得了接近产业化的产量。
1 酿酒酵母合成单萜的途径基础所有萜类化合物都是由相应的萜类合成酶经过一系列的反应催化共同前体异戊烯基焦磷酸(Isopentenyl diphosphate, IPP)和丙烯基焦磷酸(Dimethylallyl diphosphate, DMAPP)合成的。自然界中存在合成萜类前体IPP和DMAPP的两条途径:一条是甲基赤藓糖途径(Methylerythritol-4-phosphate pathway), 即MEP途径, 存在于植物、大多数细菌和原生动物体内; 另一条是甲羟戊酸途径(Mevalonate pathway), 即MVA途径[1]。除了存在于植物和少数细菌中外, 还存在于古细菌和大多数的真核生物体内[9]。目前研究较多的是MVA途径, 我们以酿酒酵母中的MVA途径为例阐述单萜合成的途径基础。
如图 1所示, 在酿酒酵母中, MVA途径是细胞必需成分麦角固醇合成途径的一部分, 其起始反应物为乙酰辅酶A。首先, 乙酰辅酶A在乙酰乙酰辅酶A硫解酶(Acetoacetyl-CoA thiolase, Erg10)和羟甲基戊二酰辅酶A合成酶(3-hydroxy-3-methylglutaryl coenzyme A synthase, Erg13)催化作用下形成甲基戊二酰辅酶A(3-hydroxy-3-methylglutaryl-CoA, HMG-CoA), 接着HMG-CoA在3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl-CoA reductase, Hmgr)催化作用下形成甲羟戊酸(Mevalonate, MVA)[8]。研究表明, Hmg1是决定MVA途径通量的关键限速酶。在酵母细胞中存在两个Hmg同工酶, 分别由HMG1和HMG2基因编码。其中, 有氧条件下Hmg1的酶活性占总还原活性的83%, 而Hmg2仅占17%左右, 且性质不稳定易降解[10]。甲羟戊酸接着在甲羟戊酸激酶(Mevalonate kinase, Erg12)催化作用下生成甲羟戊酸-5-磷酸, 进一步在甲羟戊酸-5-磷酸激酶(Phosphomevalonate kinase, Erg8)催化下生成甲羟戊酸-5-焦磷酸, 这两步反应是耗能过程, 可消耗两分子ATP。最后, 甲羟戊酸-5-焦磷酸在脱羧酶(Mevalonate diphosphate decarboxylase, Erg19)催化作用下形成IPP, IPP经异戊二烯基焦磷酸异构酶(Isopentenyl diphosphate isomerase, Idi1)作用异构化形成DMAPP[8]。在酿酒酵母中, 法呢基焦磷酸合成酶(Farnesyl pyrophosphate synthetase, Erg20)催化一分子的IPP和一分子的DMAPP合成一分子的香叶基二磷酸(Geranyl diphosphate, GPP), 即单萜类化合物的合成前体。通过相应催化酶在GPP分子基础上添加不同数量的IPP单元, 形成其他萜类化合物的合成前体[11]。例如, 倍半萜的前体法呢基焦磷酸(Farnesyl diphosphate, FPP)、二萜的前体香叶基香叶醇焦磷酸(Geranylgeranyl diphosphate, GGPP)等。而FPP是甾醇和多萜醇等物质合成的前体物质, 甾醇是真核细胞膜重要的结构和调控成分, 其中麦角甾醇决定了生物膜流动性和渗透性[5]。
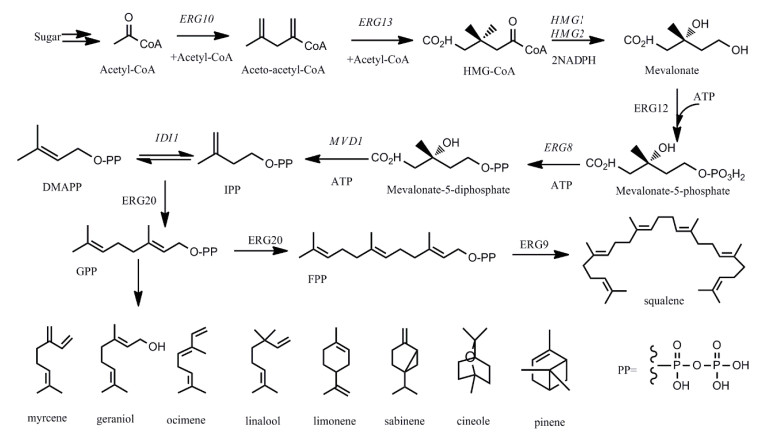
|
| 图 1 酿酒酵母单萜的生物合成途径 |
利用代谢工程及合成生物学等方法在微生物中重构萜类合成途径, 通过优化合成途径使微生物成为高效合成萜类化合物的细胞工厂, 已有不少文献报道。在酿酒酵母中, 很多萜类的合成已取得了较大的进展, 产量达到了克级的水平, 其中青蒿素前体紫穗槐二烯、β-胡萝卜素的产量分别已经达到40.0 g/L与2.1 g/L[12-13]。然而单萜的微生物合成发展仍然相对滞后, 主要原因之一是前体GPP供给不足。不同于植物, 酿酒酵母缺乏特异性的GPP合成酶, 这是造成前体供给不足的主要原因。在酿酒酵母中, GPP和FPP的合成是由同一个酶法呢基焦磷酸合成酶Erg20连续催化生成的。在这一反应过程中, GPP作为过渡中间产物, 很少从Erg20催化位点上脱离, 而是作为底物直接进行FPP的合成[14]。由于Erg20兼具GPP和FPP合成酶的双重活性以及顺序催化的特性, 这就导致胞内游离的前体GPP含量极低, 这无疑成为构建酿酒酵母单萜合成细胞工厂的障碍。
在植物中, 单萜是由单萜合成酶催化前体GPP合成的。由于野生型的酿酒酵母中缺乏单萜合成酶, 因此酿酒酵母细胞本身不具备合成单萜的能力, 仅在少数葡萄酒酵母细胞内非特异性磷酸酶的作用下产生极少量的萜类衍生物[15]。因此, 构建酿酒酵母单萜生物合成平台的基本思路是:首先引入异源的单萜合成途径; 然后通过调控前体供给途径增加前体供应以进一步提高单萜的合成; 最后综合途径改造达到产量优化。
2.1 酿酒酵母中异源表达单萜合成途径在植物中, 单萜由单萜合成酶催化前体GPP合成, 外源单萜合成酶在酿酒酵母中功能性的表达是酿酒酵母单萜合成的重要前提。Oswald等[16]在酿酒酵母中表达了来源于Ocimum basilicum的香叶醇合成酶, 得到了0.5 mg/L的香叶醇。Jongedijk等[17]在实验室改造后的酿酒酵母中表达了来源于Perilla frutescens的(-)-柠檬烯合成酶和来源于Citrus limon的(+)-柠檬烯合成酶, 其最佳产量达到0.49 mg/L和0.12 mg/L。Ignea等[18]筛选出两株高产甾醇的野生型和实验室酿酒酵母, 并且表达了来源于Salvia fruticosa的桉树脑合成酶基因(SfCinS1), 构建得到的重组酿酒酵母菌株, 研究结果发现桉树脑在两个菌株中的产量分别达到了20 mg/L与7.5 mg/L, 并且发现在高产甾醇的菌株中桉树脑产量高。Herrero等[15]在酿酒酵母中表达来源于Clarkia breweri的芳樟醇合酶(Linalool synthases, LIS)基因, 从而引入了芳樟醇合成代谢通路, 构建出了产芳樟醇的重组菌株, 产量达到18 μg/L。异源表达酶活性的高低是产物合成效率高低的决定性因素。在利用微生物合成单萜的研究中, 目前主要通过表达和分析不同来源的单萜合成酶, 通过对目的产物产量的检测, 达到筛选出高活性合成酶的目的, 然后通过去除导肽及蛋白质工程等策略提高酶的催化效率。
本课题组前期比较了3种不同来源的香叶醇合成酶LdGES、ObGES和VoGES, 发现表达来源于Valeriana officinalis的香叶醇合成酶VoGES获得了更高的香叶醇产量[5]。随后, Jiang等[19]比较了包括LdGES和VoGES在内的9种不同来源的香叶醇合成酶, 结果发现表达来源于Catharanthus roseus的香叶醇合成酶CrGES, 香叶醇产量最高。由于单萜合成酶合成的时候都含有一个导肽, 这些导肽的作用是把新合成的单萜合成酶定位到质体中, 之后这些导肽就被水解掉, 然后这些蛋白就进一步加工成为有活性的酶。酵母不含有质体, 也不能水解去除这些导肽, 所以合成的单萜合成酶的活性比较低。因此表达去除导肽的香叶醇合成酶会使其在酵母里有更高的活性[20-21]。Jongedijk等[17]研究表明, 表达来源于P.frutescens和C.limon的柠檬烯合成酶PftLS和CltLS时, 删除导肽后柠檬烯的产量分别增加了约1.5倍和8.6倍。研究发现表达删除导肽的tLdGES和tVoGES的重组菌株可产更高的香叶醇, 香叶醇的产量分别增加了约7倍和3倍[5]。Jiang等[19]尝试通过计算机模拟确定来源于C.roseus的香叶醇合成酶CrGES的最佳截短位置, 并比较4个不同的截短位置(S14、L28、S43和S52)发现, 4个截短的tCrGES均都能使香叶醇的产量得到不同程度的提高。其中, 表达tS43CrGES的菌株中香叶醇的产量最高, 达到191.61 mg/L, 比对照菌株产量提高了43倍。为进一步阐明导肽位置效应如何影响酶活性的机制, 该团队通过对蛋白质结构进行同源模建分析发现, tS43CrGES蛋白的二级结构更加稳定, 这也说明稳定的蛋白质结构是影响酶活的重要因素。
虽然提高单萜合成酶的活性在一定程度上可提高单萜化合物的产量, 但单纯单萜合成酶的表达, 仅能使微生物获得单萜合成的能力。为了进一步提高目标产物的产量, 还需要对微生物内源代谢途径进行合理的调控优化, 提高前体的合成效率。
2.2 酿酒酵母中增加单萜前体的合成通量提高单萜产量在植物中, 单萜主要在质体中合成, 由单萜合成酶催化前体GPP合成单萜。而GPP由专一性GPP合成酶催化IPP和DMAPP合成。但是酿酒酵母通过MVA途径仅能释放很少的单萜的合成前体物质GPP, 酵母缺乏特异性的GPP合成酶, 导致酿酒酵母中GPP的含量远低于FPP, 大大限制了单萜的产量[14]。为了增加GPP的合成, 研究人员尝试了多种策略, 包括增强MVA途径的通量、动态截流GPP下游代谢途径以及GPP合成酶的蛋白质工程等。
增强MVA途径的通量一般通过MVA途径中关键限速酶的表达实现。3-羟基-3-甲基戊二酰辅酶A还原酶(Hmgr)是甲羟戊酸途径的关键限速酶, 催化HMG-CoA生成甲羟戊酸。酵母本身的Hmgr是由锚定结构域和催化结构域两部分组成, 其表达受到严格的调控。Donald等[22]研究发现删除Hmgr的锚定结构域后, Hmgr的mRNA水平显著提高, 且酶活性和下游代谢产物鲨烯的含量也得到了明显的增加, 这说明锚定跨膜结构域的删除一定程度上解除了Hmgr的调控, 更利于提高MVA途径的通量。Keasling等[23]在酿酒酵母细胞中构建表达青蒿素前体青蒿二烯合成酶(ADS)基因后, 通过过表达Hmgr的催化结构域(Truncated HMG-CoA reductase, tHmgr), 解除甲羟戊酸途径中的内源限速步骤, 使倍半萜青蒿二烯产量提高了5倍。Liu等[24]利用同样的方法过表达tHmgr, 使得单萜香叶醇的产量提高到1.57 mg/L。Rico等[25]通过提高tHMG1基因表达水平, 使芳樟醇产量从21.92 μg/L提高至30.19 μg/L。除了Hmgr, 异戊二烯焦磷酸异构酶(Idi1)催化IPP和DMAPP之间的异构化, 也是实现GPP合成的重要步骤。该反应虽为可逆反应, 但Idi1表达较低, IPP的含量远高于DMAPP, 通过提高Idi1的表达量改变胞内IPP和DMAPP的比例也是实现重新分配GPP和FPP合成的重要步骤[5]。Ignea等[26]在酿酒酵母中过表达Idi1使单萜桧烯产量提高了3倍。此外, Upc2是调控酿酒酵母细胞内甾醇生物合成的全局转录因子, 研究表明其突变体Upc2-1(G888D)能够增强甾醇途径的合成[27]。基于此研究结果, 我们在酿酒酵母中过表达Upc2-1后, 香叶醇的产量提高了32%[5]。
MVA合成途径的强化是提高包括单萜在内的萜类化合物合成的通用策略, 然而这些策略虽然可以提高单萜的合成, 但增加的代谢流大部分流向了FPP下游产物, 而非用于单萜的合成, 因此特异性GPP合成酶的引入及蛋白质工程改造就显得尤为重要。Ignea等[26]表达了Picea abies来源的GPP合成酶, 使桧萜产量提高30%-40%。课题组前期研究发现, 在酵母中引入来源于Abies grandis、P.abies、C.roseus的去除质体导肽的GPP合成酶tAgPPS2、tPaPPS2和tCrGPPS, 香叶醇合成不但没有提高, 反而有所下降[5]。推测异源GPP合成酶可能难以在酿酒酵母中实现活性表达。因此, 内源FPP合成酶Erg20的蛋白质工程改造, 成为提高GPP合成的主要策略。Fischer等[14]对酿酒酵母内源FPP合成酶Erg20进行同源模建, 发现第197位的赖氨酸(Lys)是关键活性位点, 并对该位点进行了一系列的定点突变, 通过香叶醇的合成作为GPP合成的检测指标发现, 当Lys突变为甘氨酸(Gly)、丙氨酸(Ala)、亮氨酸(Leu)、半胱氨酸(Cys)、丝氨酸(Ser)、苏氨酸(Thr)、天冬氨酸(Asp)、谷氨酸(Glu)后, 产量提高约10-20倍。此外, 突变菌株产香叶醇、芳樟醇、香茅醇都有了不同程度的提高。基于Fisher等的研究, Ignea等[26]对Erg20通过蛋白结构模建分析, 得到了阻碍FPP合成酶的活性的关键位点F96、A99、N127, 然后对其做了一系列的突变, 结果发现分别表达突变的Erg20(F96W)、Erg20(N127W)后, 桧萜的产量分别提高了3.21和5.57倍。而F96W和N127W双点突变使桧萜产量增加到10.32倍。Kühner等和Menon等[28-29]的研究发现, 在代谢途径中, 参与连续催化的酶的活性中心相互靠近可减少中间产物的释放, 有利于对底物到产物的转化。因此, 作者前期在Erg20(F96W-N127W)和来源于V.officinalis的去除导肽序列的香叶醇合成酶tVoGES之间引入不同的连接肽, 对Erg20WW和tVoGES做了一系列的融合发现, 相对于没有融合的Erg20WW和tVoGES, 表达融合后的tVoGES-GGGS-Erg20WW使得香叶醇的产量提高了1.7倍[5]。Jiang等[19]也采用相似的策略, 融合Erg20(F96W-N127W)和t3CrGES后, 提高了香叶醇的产量。Deng等[30]在酿酒酵母中表达了来源于Actinidia arguta的芳樟醇合成酶(AaLS1), 然后用3个不同长度的连接肽将芳樟醇合成酶(AaLS1)与法呢基焦磷酸合成酶(Farnesyl diphosphate synthetase, FPPS)进行融合, 结果表明(GGGGS)3更有助于两个酶酶活中心的靠近, 从而促进了芳樟醇的产生, 相比于共表达AaLS1和FPPS的重组菌株, 产量提高了69.7%。
2.3 减少单萜内源性转化提高单萜产量在萜类化合物合成过程中, 前体及萜类化合物本身在细胞内的非特异性转化或者进一步代谢往往是造成产量降低的重要原因。尤其在发酵后期, 细胞内环境发生变化、营养成分缺乏、次级代谢反应活跃, 增大了萜类物质发生内源性转化的机率。研究表明, 生物体内的GPP和FPP可以在非特异性的磷酸酶和脱氢酶作用下发生内源性转化, 生成某些萜类化合物[31]。另外, 一些萜类化合物也可在非特异性反应的作用下异构化, 形成不同类型的同分异构体。以单萜香叶醇为例, 在芳香类植物中, 香叶醇可以转化成其他萜类化合物, 赋予植物不同的怡人香气。虽然野生型酿酒酵母合成萜类化合物的能力非常弱, 但是某些葡萄酒酵母可以通过细胞内的水解酶或者脱氢酶非特异性的转化萜类化合物[32-33]。在酿酒酵母中, 老黄酶(Old yellow enzyme, OYE)家族是细胞响应外源毒性物质解毒过程中的重要酶类, 可将香叶醇转化为其同分异构体香茅醇。Steyer等[34]在酿酒酵母的培养基中添加一定量的香叶醇, 经检测除了香叶醇之外, 还产生了香叶乙酸酯、香茅醇、橙花醇乙酸酯, 并发现Oye2是催化将香叶醇转化成香茅醇的主要还原酶。本课题组研究发现, 在酿酒酵母中敲除OYE2, 分批发酵中香叶醇产量提高1.7倍[31]。ATF1和ATF2编码的乙酰基转移酶参与了萜烯醇的乙酰化, 能够将香叶醇转化成萜烯乙酸酯。添加一定量的香叶醇的条件下, 进行发酵实验, 结果发现, 敲除ATF1以及ATF2, 萜烯乙酸酯分别降低了31%、66%-88%[34]。基于Steyer等的研究基础上, 我们在酿酒酵母中敲除ATF1, 分批发酵中香叶醇产量提高了1.6倍[31]。在大肠杆菌中也发现了类似的单萜内源性转化现象, Zhou等[35]在大肠杆菌中构建了香叶醇合成的重组菌株, 在发酵实验中发现, 香叶醇产量达到最高后会发生下降, 经测试发现香叶醇被内源脱氢及异构化为橙花醇、橙花醛、香叶醛。同时他们发现YjgB是参与香叶醇内源性转化为香叶的主要酶, 与出发菌株相比, 敲除YJGB的菌株, 香叶醇的产量提高了24%。
2.4 减少单萜对细胞的毒害作用有助于增强微生物单萜合成效率单萜对微生物细胞具有较强的毒性, 因此常常作为抑菌剂。有研究表明, 单萜对细胞造成毒性的原因可能有以下几个方面:(1)破坏细胞膜功能, 导致菌体死亡。Liu等[36]用致死剂量的柠檬烯胁迫酿酒酵母细胞后, 发现细胞膜功能受到严重的损伤, 其流动性降低、通透性增高以及脂肪酸的比例增加。(2)破坏细胞壁的完整性, 抑制菌体生长。Brennan等[37]的研究表明, 柠檬烯可以改变细胞壁的结构和功能, 对细胞分裂有明显的抑制作用。他们通过转录组测序发现, 麦角固醇和脂肪酸生物合成途径相关的基因并没有上调, 而与细胞壁完整性相关的基因上调, 同时还发现柠檬烯处理后的细胞对细胞壁降解酶的敏感性增加4倍。目前对于单萜破坏细胞壁与细胞膜的具体机理研究仍然不清楚。(3)诱发细胞内活性氧(ROS)的积累, 进而破坏包括细胞膜在内的多个细胞器膜的功能。Bakkali等[38]研究发现不同单萜处理酿酒酵母能够诱发不同种类的ROS的积累。(4)影响胞内能量代谢。Uribe等[39]发现β-蒎烯能够抑制细胞呼吸, 影响了H+和K+在酵母细胞内的转运, 干扰线粒体膜的完整性和ATP的生成。
由以上单萜对细胞毒性的机制可以看出, 当单萜的浓度达到一定数值时, 其对细胞可能会造成不可逆转的损伤, 抑制菌体的生长, 甚至导致菌体的死亡。因此, 减少单萜对酿酒酵母的毒害作用是提高利用酿酒酵母高效生产单萜的重要因素。目前主要通过两种途径减轻单萜对细胞的毒害作用:一是提高细胞自身的单萜耐受性; 二是减少单萜与细胞的接触。2012年, Brennan等[7]的研究表明, 当柠檬烯达到60 mg/L时, 酿酒酵母会停止生长。2015年, 该团队通过逐步提高柠檬烯的胁迫浓度对酿酒酵母进行适应性进化经过200次传代培养, 筛选获得六株柠檬烯耐受性明显提高的菌株, 并进行基因组全测序, 分析鉴定了关键突变蛋白tTcb3p1-989。他们随后对该蛋白进行了功能性和普适性验证, 发现过表达tTcb3p1-989能够使进化前的菌株对柠檬烯的耐受性提高了9倍, 同时发现tTcb3p1-989对β-蒎烯、月桂烯和生物喷墨燃料混合物AMJ-700t(10%甲基异丙基苯, 50%柠檬烯, 40%法呢烯)的耐受性也有明显的提高, 这说明tTcb3p1-989对提高酿酒酵母单萜耐受性具有一定的普适性[40]。
减少单萜和细胞的接触也是缓解毒性的一种有效策略, 主要包括单萜的外排和隔离两种方式, 该策略对于不同的菌具有一定的普适性。单萜主要是通过自由扩散或者相关的转运蛋白通过主动运输实现从胞内到胞外的外排。Dunlop等[41]从细菌基因组中筛选出了不同的外排泵, 并将其中的43个在大肠杆菌中进行了异源表达, 发现表达来源于大肠杆菌外排泵AcrAB和来源于Alcanivorax borkumensis的未鉴定的外排泵均可使大肠杆菌对柠檬烯的耐受性增加。相似的, Wang等[42]将来源于子囊菌Grosmannia clavigera的ABC转运蛋白GcABC-G1, 在酿酒酵母中进行异源表达, 然后用不同单萜对细胞进行胁迫处理, 发现GcABC-G1明显提高了重组酵母菌株的存活率。在大规模的微生物工业化生产过程中, 生物反应器中的菌体密度和产物浓度较高, 这就大大增加了产物和细胞的接触机会。对于具有挥发性和毒性的产品来说, 往往采取两相发酵的方式, 即在生产过程中添加对细胞无毒的有机溶剂, 及时萃取产物, 这种方式不但防止了产物挥发, 而且有效的降低了目的产物对细胞的毒性。在萜类生产过程中, 目前普遍采用的两种比较理想的有机相, 分别是十二烷和肉豆蔻酸异丙酯[17, 19]。
虽然目前研究不同程度的提高了酿酒酵母对单萜的耐受性, 但总体而言, 单萜的毒性仍然是限制其高产的一个重要因素。因此, 解析单萜造成毒性的关键机理并进一步提高酿酒酵母的单萜耐受性, 可以为通过代谢工程和合成生物学技术构建高效的酿酒酵母合成单萜平台奠定基础。
2.5 单萜合成的产量总结目前, 通过代谢工程改造酿酒酵母可以实现多种单萜的生物合成, 主要包括柠檬烯、香叶醇、芳樟醇、桧萜和桉树脑等。另外, 单萜吲哚生物碱类化合物是一类重要的临床抗肿瘤药物, 其结构复杂, 合成途径涉及十步以上的催化反应, 尤其是特异性的P450酶参与的氧化反应, 更是该类化合物合成的关键。作为P450酶表达的优良宿主细胞, 在酿酒酵母中以香叶醇为前体, 成功合成了单萜吲哚生物碱类化合物strictosidine[43]。表 1总结了酿酒酵母中单萜合成的产量水平以及采取的途径改造策略。
从表 1中数据可以看出, 大部分单萜产量处于毫克级水平, 说明利用微生物生产单萜有着较大的提升空间, 但是如何实现单萜的高效生物合成依然面临诸多的挑战。
3 展望作为极具潜力的微生物细胞工厂, 酿酒酵母在合成萜类化合物研究中呈现出巨大的优势。酿酒酵母除了具有较强的鲁棒性外, 其细胞内环境更接近于植物细胞内环境, 更有利于表达植物来源的酶类的表达, 尤其P450氧化酶等。目前, 相比于倍半萜, 单萜的微生物合成研究起步较晚, 发展相对滞后。虽然通过各种各样的代谢工程和合成生物学的方法, 包括高活性异源酶类的直接筛选、蛋白质的理性设计、增强前体合成途径的通量以及模块化工程等, 使单萜的产量得到了较大的提高, 但是离工业化的生产差距还较远, 仍有许多工作需要进一步完善。
为进一步提高酿酒酵母中单萜的合成能力, 并结合当前研究中遇到的困难, 我们认为未来工作可重点从以下几个方面开展研究:(1)采用动态调控等策略进一步合理弱化下游途径。通过动态调控, 可减少代谢中间产物的积累, 减少额外的蛋白质生产, 从而更有利于目的产物的合成。例如, 应用能够响应代谢产物或者培养环境中的营养成分的启动子, 如碳源响应的启动子调控代谢途径中关键基因的表达, 使菌体生长阶段和产物产生阶段有效的分离, 这样不仅避免了产物过早合成抑制菌体生长的问题, 而且可以实现产物的集中合成, 更利于碳源的有效分配。(2)加强前体乙酰辅酶A的合成, 并增加乙酰辅酶A到MVA途径的通量。为了提高倍半萜的产量, 研究者深入了解乙酰辅酶A在酿酒酵母中的代谢过程, 并改造其合成途径, 敲除消耗乙酰辅酶A的反应, 使乙酰辅酶A更多的流向细胞质。例如, 改造后的菌株使倍半萜紫穗槐二烯和α-檀香萜烯产量明显提高[46-47]。而在单萜合成中, 对其合成前体乙酰辅酶A的途径改造研究设计较少。(3)通过理性的膜工程设计增强细胞膜的修复和再生能力, 提高酿酒酵母对单萜的耐受性, 构建具备更高耐受性的酿酒酵母菌株。酿酒酵母体内编码磷脂和细胞膜合成相关基因的转录水平在单萜胁迫条件下显著提高, 表明细胞膜修复能力对提高酿酒酵母单萜耐受性具有重要意义[48]。因此可通过改变细胞膜中磷脂比例及其分子排列方式等提高酿酒酵母的单萜耐受性。(4)通过结合计算机模拟的策略对代谢网络进行分析、采用多变量的模块优化技术等对参与萜类合成的途径进行改造, 从而达到优化代谢流向、提高单萜合成的目的。
全球资源越来越匮乏、环境恶化等问题的日益严重, 满足人类对能源和健康的需求, 构建高效的微生物细胞工厂将生物质资源转化成各种终端产品已成为必然的趋势。随着合成生物学的高速发展, 利用合成生物学的相关技术加速了细胞工厂的构建和优化, 也必将缩短从设计到产业化的距离。随着一些限制性因素的突破, 利用微生物合成单萜的产业化生产必将为人类的可持续发展作出贡献。
| [1] |
Chandran SS, Kealey JT, Reeves CD. Microbial production of isoprenoids[J]. Process Biochemistry, 2011, 46: 1703-1710. DOI:10.1016/j.procbio.2011.05.012 |
| [2] |
Wright CW. Traditional antimalarials and the development of novel antimalarial drugs[J]. Ethnopharmacol, 2005, 100: 67-71. DOI:10.1016/j.jep.2005.05.012 |
| [3] |
Jennewein S, Croteau R. Taxol:biosynthesis, molecular genetics, and biotechnological applications[J]. Appl Microbiol Biotechnol, 2001, 57: 13-19. DOI:10.1007/s002530100757 |
| [4] |
Rao LG, Mackinnon ES, Josse RG, et al. Lycopene consumption decreases oxidative stress and bone resorption markers in postmenopausal women[J]. Osteoporos Int, 2007, 18: 109-115. |
| [5] |
Zhao J, Bao X, Li C, et al. Improving monoterpene geraniol production through geranyl diphosphate synthesis regulation in Saccharomyces cerevisiae[J]. Appl Microbiol Biotechnol, 2016, 100: 4561-4571. DOI:10.1007/s00253-016-7375-1 |
| [6] |
de Sousa DP, Goncalves JC, Quintans-Junior L, et al. Study of anticonvulsant effect of citronellol, a monoterpene alcohol, in rodents[J]. Neurosci Lett, 2006, 401: 231-235. DOI:10.1016/j.neulet.2006.03.030 |
| [7] |
Brennan TC, Turner CD, Kromer JO, et al. Alleviating monoterpene toxicity using a two-phase extractive fermentation for the bioproduction of jet fuel mixtures in Saccharomyces cerevisiae[J]. Biotechnol Bioeng, 2012, 109: 2513-2522. DOI:10.1002/bit.v109.10 |
| [8] |
Sarria S, Wong B, Garcia Martin H, et al. Microbial synthesis of pinene[J]. ACS Synth Biol, 2014, 3: 466-475. DOI:10.1021/sb4001382 |
| [9] |
Chaykin S, Law J, Phillips AH, et al. Phosphorylated intermediates in the synthesis of squalene[J]. Proc Natl Acad Sci USA, 1958, 44: 998-1004. DOI:10.1073/pnas.44.10.998 |
| [10] |
Basson ME, Thorsness M, Rine J. Saccharomyces cerevisiae contains two functional genes encoding 3-hydroxy-3-methylglutaryl-coenzyme A reductase[J]. Proc Natl Acad Sci USA, 1986, 83: 5563-5567. DOI:10.1073/pnas.83.15.5563 |
| [11] |
Liang PH, Ko TP, Wang AH. Structure, mechanism and function of prenyltransferases[J]. Eur J Biochem, 2002, 269: 3339-3354. DOI:10.1046/j.1432-1033.2002.03014.x |
| [12] |
Westfall PJ, Pitera DJ, Lenihan JR, et al. Production of amorphadiene in yeast, and its conversion to dihydroartemisinic acid, precursor to the antimalarial agent artemisinin[J]. Proc Natl Acad Sci USA, 2012, 109: E111-118. DOI:10.1073/pnas.1110740109 |
| [13] |
Zhao J, Li Q, Sun T, et al. Engineering central metabolic modules of Escherichia coli for improving beta-carotene production[J]. Metab Eng, 2013, 17: 42-50. DOI:10.1016/j.ymben.2013.02.002 |
| [14] |
Fischer MJ, Meyer S, Claudel P, et al. Metabolic engineering of monoterpene synthesis in yeast[J]. Biotechnol Bioeng, 2011, 108: 1883-1892. DOI:10.1002/bit.23129 |
| [15] |
Herrero O, Ramon D, Orejas M. Engineering the Saccharomyces cerevisiae isoprenoid pathway for de novo production of aromatic monoterpenes in wine[J]. Metab Eng, 2008, 10: 78-86. DOI:10.1016/j.ymben.2007.11.001 |
| [16] |
Oswald M, Fischer M, Dirninger N, et al. Monoterpenoid biosynthesis in Saccharomyces cerevisiae[J]. FEMS Yeast Res, 2007, 7: 413-421. DOI:10.1111/fyr.2007.7.issue-3 |
| [17] |
Jongedijk E, Cankar K, Ranzijn J, et al. Capturing of the monoterpene olefin limonene produced in Saccharomyces cerevisiae[J]. Yeast, 2015, 32: 159-171. |
| [18] |
Ignea C, Cvetkovic I, Loupassaki S, et al. Improving yeast strains using recyclable integration cassettes, for the production of plant terpenoids[J]. Microb Cell Fact, 2011, 10: 4. DOI:10.1186/1475-2859-10-4 |
| [19] |
Jiang GZ, Yao MD, Wang Y, et al. Manipulation of GES and ERG20 for geraniol overproduction in Saccharomyces cerevisiae[J]. Metab Eng, 2017, 41: 57-66. DOI:10.1016/j.ymben.2017.03.005 |
| [20] |
Turner G, Gershenzon J, Nielson EE, et al. Limonene synthase, the enzyme responsible for monoterpene biosynthesis in peppermint, is localized to leucoplasts of oil gland secretory cells[J]. Plant Physiol, 1999, 120: 879-886. DOI:10.1104/pp.120.3.879 |
| [21] |
Bohlmann J, Meyer-Gauen G, Croteau R. Plant terpenoid synthases:molecular biology and phylogenetic analysis[J]. Proc Natl Acad Sci USA, 1998, 95: 4126-4133. DOI:10.1073/pnas.95.8.4126 |
| [22] |
Donald KA, Hampton RY, Fritz IB. Effects of overproduction of the catalytic domain of 3-hydroxy-3-methylglutaryl coenzyme A reductase on squalene synthesis in Saccharomyces cerevisiae[J]. Appl Environ Microbiol, 1997, 63: 3341-3344. |
| [23] |
Keasling JD. Synthetic biology and the development of tools for metabolic engineering[J]. Metab Eng, 2012, 14: 189-195. DOI:10.1016/j.ymben.2012.01.004 |
| [24] |
Liu J, Zhang W, Du G, et al. Overproduction of geraniol by enhanced precursor supply in Saccharomyces cerevisiae[J]. Biotechnol, 2013, 168: 446-451. |
| [25] |
Rico J, Pardo E, Orejas M. Enhanced production of a plant monoterpene by overexpression of the 3-hydroxy-3-methylglutaryl coenzyme A reductase catalytic domain in Saccharomyces cerevisiae[J]. Appl Environ Microbiol, 2010, 76: 6449-6454. DOI:10.1128/AEM.02987-09 |
| [26] |
Ignea C, Pontini M, Maffei ME, et al. Engineering monoterpene production in yeast using a synthetic dominant negative geranyl diphosphate synthase[J]. ACS Synth Biol, 2014, 3: 298-306. DOI:10.1021/sb400115e |
| [27] |
Davies BS, Wang HS, Rine J. Dual activators of the sterol biosynthetic pathway of Saccharomyces cerevisiae:similar activation/regulatory domains but different response mechanisms[J]. Mol Cell Biol, 2005, 25: 7375-7385. DOI:10.1128/MCB.25.16.7375-7385.2005 |
| [28] |
Kühner S, van Noort V, Betts MJ, et al. Proteome organization in a genome-reduced bacterium[J]. Science, 2009, 326: 1235-1240. DOI:10.1126/science.1176343 |
| [29] |
Menon AL, Poole FL, 2nd, et al. Novel multiprotein complexes identified in the hyperthermophilic archaeon Pyrococcus furiosus by non-denaturing fractionation of the native proteome[J]. Mol Cell Proteomics, 2009, 8: 735-751. DOI:10.1074/mcp.M800246-MCP200 |
| [30] |
Deng Y, Sun M, Xu S, et al. Enhanced(S)-linalool production by fusion expression of farnesyl diphosphate synthase and linalool synthase in Saccharomyces cerevisiae[J]. Appl Microbiol, 2016, 121: 187-195. DOI:10.1111/jam.2016.121.issue-1 |
| [31] |
Zhao J, Li C, Zhang Y, et al. Dynamic control of ERG20 expression combined with minimized endogenous downstream metabolism contributes to the improvement of geraniol production in Saccharomyces cerevisiae[J]. Microb Cell Fact, 2017, 16: 17. DOI:10.1186/s12934-017-0641-9 |
| [32] |
Marmulla R, Harder J. Microbial monoterpene transformations-a review[J]. Front Microbiol, 2014, 5: 346. |
| [33] |
Gamero A, Manzanares P, Querol A, et al. Monoterpene alcohols release and bioconversion by Saccharomyces species and hybrids[J]. Int J Food Microbiol, 2011, 145: 92-97. DOI:10.1016/j.ijfoodmicro.2010.11.034 |
| [34] |
Steyer D, Erny C, Claudel P, et al. Genetic analysis of geraniol metabolism during fermentation[J]. Food Microbiol, 2013, 33: 228-234. DOI:10.1016/j.fm.2012.09.021 |
| [35] |
Zhou J, Wang C, Yoon SH, et al. Engineering Escherichia coli for selective geraniol production with minimized endogenous dehydrogenation[J]. Biotechnol, 2014, 169: 42-50. |
| [36] |
Liu J, Zhu Y, Du G, et al. Exogenous ergosterol protects Saccharomyces cerevisiae from D-limonene stress[J]. Appl Microbiol, 2013, 114: 482-491. DOI:10.1111/jam.2013.114.issue-2 |
| [37] |
Brennan TC, Kromer JO, Nielsen LK. Physiological and transcriptional responses of Saccharomyces cerevisiae to d-limonene show changes to the cell wall but not to the plasma membrane[J]. Appl Environ Microbiol, 2013, 79: 3590-3600. DOI:10.1128/AEM.00463-13 |
| [38] |
Bakkali F, Averbeck S, Averbeck D, et al. Cytotoxicity and gene induction by some essential oils in the yeast Saccharomyces cerevisiae[J]. Mutat Res, 2005, 585: 1-13. DOI:10.1016/j.mrgentox.2005.03.013 |
| [39] |
Uribe S, Ramirez J, Pena A. Effects of beta-pinene on yeast membrane functions[J]. Bacteriol, 1985, 161: 1195-1200. |
| [40] |
Brennan TC, Williams TC, Schulz BL, et al. Evolutionary engineering improves tolerance for replacement jet fuels in Saccharomyces cerevisiae[J]. Appl Environ Microbiol, 2015, 81: 3316-3325. DOI:10.1128/AEM.04144-14 |
| [41] |
Dunlop MJ, Dossani ZY, Szmidt HL, et al. Engineering microbial biofuel tolerance and export using efflux pumps[J]. Mol Syst Biol, 2011, 7: 487. |
| [42] |
Wang Y, Lim L, DiGuistini S, et al. A specialized ABC efflux transporter GcABC-G1 confers monoterpene resistance to Grosmannia clavigera, a bark beetle-associated fungal pathogen of pine trees[J]. New Phytol, 2013, 197: 886-898. DOI:10.1111/nph.12063 |
| [43] |
Brown S, Clastre M, Courdavault V, et al. De novo production of the plant-derived alkaloid strictosidine in yeast[J]. Proc Natl Acad Sci USA, 2015, 112: 3205-3210. DOI:10.1073/pnas.1423555112 |
| [44] |
Amiri P, Shahpiri A, Asadollahi MA, et al. Metabolic engineering of Saccharomyces cerevisiae for linalool production[J]. Biotechnol Lett, 2016, 38: 503-508. DOI:10.1007/s10529-015-2000-4 |
| [45] |
Behrendorff JB, Vickers CE, Chrysanthopoulos P, et al. 2, 2-Diphenyl-1-picrylhydrazyl as a screening tool for recombinant monoterpene biosynthesis[J]. Microb Cell Fact, 2013, 12: 76. DOI:10.1186/1475-2859-12-76 |
| [46] |
Chen Y, Daviet L, Schalk M, et al. Establishing a platform cell factory through engineering of yeast acetyl-CoA metabolism[J]. Metab Eng, 2013, 15: 48-54. DOI:10.1016/j.ymben.2012.11.002 |
| [47] |
Shiba Y, Paradise EM, Kirby J, et al. Engineering of the pyruvate dehydrogenase bypass in Saccharomyces cerevisiae for high-level production of isoprenoids[J]. Metab Eng, 2007, 9: 160-168. DOI:10.1016/j.ymben.2006.10.005 |
| [48] |
Parveen M, Hasan MK, Takahashi J, et al. Response of Saccharomyces cerevisiae to a monoterpene:evaluation of antifungal potential by DNA microarray analysis[J]. Antimicrob Chemother, 2004, 54: 46-55. DOI:10.1093/jac/dkh245 |





