2. 塔里木大学生命科学学院, 阿拉尔 843300
2. College of Life Science, Tarim University, Alar 843300
在全球有接近20%的耕地和50%的灌溉地受盐分影响, 这给农业生产带来了很大的威胁[1-2]。盐碱土的改良主要有工程措施、化学措施、物理措施和生物措施, 其中以生物措施更为绿色环保, 尤其以利用耐盐碱植物对土壤改良是最生态科学的[3]。研究和培育耐盐碱植物就成为了许多科学家们工作目标[2]。大量研究证实禾草内生真菌可提高宿主植物的抗性, 是由于内生真菌与禾草共生后真菌产生物碱来提高宿主抗逆性[4], 或是刺激宿主合成生物碱或其他次生代谢物[5]。
目前, 植物生理学的研究已明确, 渗透胁迫、离子毒害和次生胁迫是盐胁迫对植物造成危害的主要机制[6-9]。植物抗盐研究进展的综述报道较多, 但系统的总结内生真菌与宿主禾草抗盐碱性的较少, 因此本综述主要是针对近年来关于内生真菌提高禾草抗盐碱性的研究结果进行归纳和总结, 拟为后期关于此抗性机理的深入研究提供参考。
1 内生真菌及其抗逆内生真菌是一类在植物体内渡过大部分或全部生命周期, 而寄主植物不显示外部症状的一类真菌[10]。至今, 已在多种植物中发现内生真菌, 以禾本科尤为常见。内生真菌长期生活在植物体内, 与宿主协同进化, 在进化途中二者形成互惠共利关系[11-12]。近年来禾草内生真菌提高宿主抗性的研究, 主要集中在提高宿主的抗虫[13-18]、抗病[19-20]、抗旱、抗高/低温[21-27]、耐涝[28]、抗金属离子[22, 29]、抗杂草[30]、化感作用[31]、抗盐碱[33-35]作用影响草地植物群落演替, 提高种群中物种丰富度[36-37]等。
据魏茂英报道[38], 离体培养的高羊茅N.coeno-phia-lum(现已经更名为Epichloë)内生真菌(N.coenop-hialum)在氯化钠浓度高达3 000 mmol/L时仍然可以生长。对野大麦内生真菌共生体的盐胁迫处理最大浓度到600 mmol/L氯化钠[39], 且植株培养在蛭石中, 蛭石对盐胁迫有一定的缓冲效应。对比离体菌与共生体的盐胁迫浓度, 得出内生真菌适应盐胁迫浓度远远大于植物, 它与植物共生后, 这种适应高盐胁迫的优良特性能否影响其宿主植物的耐盐性, 有必要对其进行研究。
王志伟等[40]对我国山东东营市盐碱地区进行了禾本科植物带菌检测发现, 盐碱浓度高的地方禾本科植物内生真菌带菌率减少, 但在高盐碱地也检出了带菌植株。随盐浓度增加, 根部内生真菌带菌率增加[41], 结果正好说明了内生真菌共生体对盐碱环境适应能力的多样性, 为后期深入理解盐碱环境中的内生真菌-植物间相互关系奠定了基础。
2 盐碱胁迫下内生真菌对宿主禾草生长发育影响 2.1 促进种子萌发和幼苗生长植株种子在萌发阶段对盐敏感, 早在1952年, Ayers等[42]就发现盐分可以抑制大麦和小麦种子的萌发。内生真菌感染能促进盐环境下种子萌发, 已报道德兰臭草、醉马草、中华羊茅和野大麦种子在盐胁迫处理时带菌种子萌发率显著提高, 尤其是在400 mmol/L氯化钠处理野大麦种子时, 带菌种子发芽率比不带菌高出95%。在高盐浓度下, 内生真菌侵染明显促进幼苗胚芽和胚根生长[34, 43-45], 且内生真菌能提高苗长与根长、苗鲜重之间的相关系数[46]。
2.2 对植株生长的影响内生真菌的侵染对禾草生长产生明显的影响, 具体见表 1。多数情况下内生真菌感染表现出促生作用并增加宿主植物产量。如Epichloë内生真菌侵染可提高醉马草植株的分蘖、株高, 并促进植株胁迫后的恢复生长[43]。低盐浓度下(5 g/L)Epichloë内生真菌显著提高了高羊茅的分蘖数与叶片数[32], 并提高了高羊茅(Festuca arundinacea Schreb.)和草甸羊茅(Festuca pratensis Huds.)在盐胁迫下的叶片存活率和根冠比[47]。披碱草(Elymus dahuricus Trucz)内生真菌也有促进宿主分蘖数、干重以及根冠比的作用[35]。高盐浓度下(300 mmol/L氯化钠)内生真菌显著提高了野大麦分蘖能力、生物量、成熟花序长度、种子数和种子产量[33, 39, 44], 且带菌野大麦在600 mmol/L盐浓度下仍可维持生长, 而不带菌植株已经枯黄甚至死亡[33, 39]。滨麦(Leymus mollis)在处于500 mmol/L氯化钠胁迫时, 不带菌植株在胁迫7 d就严重脱水枯萎, 到14 d死亡; 带内生真菌植株则可正常生长, 且生物量显著高于不带菌[48]。用EF0801真菌(一株来源于盐地碱蓬的内生真菌)发酵液处理水稻幼苗, 能促进地上生物量和株高[49]。印度梨形孢(Piriformospora indica)根部内生真菌对大麦(Hordeum vulgare)浸染后提高了大麦在100 mmol/L和300 mmol/L氯化钠胁迫的绿色且增加了生长和产量[50-51]。
内生真菌的促生作用可能与菌株类型及宿主植物有关。已发现某些内生真菌感染并未促进宿主生长, 如带菌紫羊茅(Festuca rubra)在人工模拟海盐胁迫下的生长并未显著高于不带菌的[52]。黑麦草盐胁迫后发现内生真菌对宿主黑麦草的营养生长没有促进作用, 反而在高盐浓度下, 感染内生真菌使黑麦草分蘖显著下降[53]。
综上研究得出内生真菌对其宿主植物在盐碱环境中的生长表现, 多数报道为内生真菌具有提高宿主株高、分蘖、生物量, 进而增加种子产量, 使宿主植物更耐盐碱。内生真菌促进宿主禾草生长可能有以下两方面原因:第一, 内生真菌可合成并分泌一些生长调节物质, 如生长素吲哚乙酸(Indole-3-acetic acid, IAA)[54-55]; 第二, 内生真菌可促进宿主禾草对氮、磷等营养元素的吸收[56-57]。但也有没有效果或者负面影响的报道, 分析其原因可能为内生真菌与宿主抗盐机制与植物基因型、内生真菌种类、共生体适应性及环境等有密切的关系[48]。
3 内生真菌减少盐碱胁迫对宿主禾草的原初盐害 3.1 减少盐碱对细胞膜的伤害植物生长在盐渍环境中, 质膜是有机体与外界环境的界面, 盐胁迫会首先直接影响质膜而导致质膜过氧化作用, 丙二醛(Malondialdehyde, MDA)是其产物之一, 通常利用它反映出质膜过氧化的程度, 丙二醛含量越高, 细胞膜的通透性增强, 渗透物质流出, 电导率增加。盐胁迫下植物细胞膜透性小, 则细胞膜的稳定性强, 植株抗盐性越强[58]。对醉马草和德兰臭草幼苗进行盐处理得出内生真菌能通过降低宿主禾草的相对电导率和丙二醛含量来减轻生物膜损伤(P < 0.05)[34, 43]。野大麦内生真菌在300 mmol/L高盐浓度下也显著降低了丙二醛含量, 降低幅度27.2%[39, 44]。在碳酸钠胁迫下, 感染EF0801真菌水稻叶片的丙二醛含量也显著低于无菌组[49]。因此可以得出, 内生真菌通过降低丙二醛含量和减小电导率来保护宿主禾草免受盐碱对细胞膜的伤害。
3.2 提高宿主的光合作用内生真菌侵染可以改变宿主禾草在盐碱胁迫下的光合作用, 提高禾草的光能利用效率。已发现内生真菌侵染可提高宿主植物叶绿素a、b含量、类胡萝卜素含量、净光合速率、蒸腾速率、水分利用率、气孔导度、叶绿素荧光(Fv/Fm, Fv/Fo)[49]。而内生真菌-野大麦共生体在盐胁迫再一次证实了内生真菌感染后能提高宿主禾草光合色素含量、光合速率、蒸腾速率、胞间CO2浓度和气孔导度[39]。进一步说明内生真菌有缓解盐胁迫对植株光合的抑制和伤害作用。
3.3 增加水分利用效率和降低宿主禾草的离子毒害植物在遇到盐分胁迫时, 有两个反应阶段, 第一阶段短期盐胁迫的快速失水阶段, 由于盐分导致的渗透胁迫会使植物快速失去可利用的水分, 从而不利于植物生长; 第二阶段长期盐胁迫的离子累积阶段, 植物缓慢吸收Na+/Cl-而累积在植株组织中导致离子毒害或离子平衡失调[8]。许多共生植物有较好的渗透调节能力, 它们可通过水通道蛋白的表达和活性的改变调节水的分配, 比不带菌植物的蒸腾速率下降, 水分利用效率提高[48]。如盐处理下带菌提高了野大麦、醉马草植株绝对含水量[39, 43]。
内生真菌能促使宿主禾草改变离子含量, 进而促进其在盐渍环境下更好的生长。盐胁迫时, 内生真菌具有显著降低宿主禾草Na+含量, 提高K+含量, 以此来降低Na+对宿主的离子毒害[43, 47]。高盐胁迫时内生真菌感染显著促进了高羊茅植株中Ca2+、Mg2+离子的吸收[32]。钙不仅是植物生长中所必须的大量元素之一, 而且还是参与调节多种细胞功能的第二信使[59-60], 钙离子可作为无机离子的渗透调节剂而参与植物抗盐[61], 在盐胁迫下钙离子有促进钾离子吸收而降低钠离子积累的作用[61]。内生真菌促进宿主植物体内Ca2+吸收, 通过钙离子的调节和信号转导作用来降低高盐胁迫下Na+的积累, 可能是内生真菌缓解宿主植物盐胁迫离子毒害的另一原因。
3.4 改变营养元素代谢在盐分胁迫下植物的另一个典型症状就是营养代谢的紊乱[62], 内生真菌浸染后会改变宿主禾草的营养元素代谢[56-57]。氯化钠处理野大麦植株, 内生真菌提高了宿主植物全氮和全磷含量, 对有机碳无影响[39]。
3.5 内生真菌侵染对禾草激素含量和分布影响植物激素参与植物对盐分胁迫的回应, 在盐分胁迫时, 赤霉素(Gibberellin, GA)、吲哚乙酸、乙烯、细胞分裂素(Cytokinin, CTK)和脱落酸(Abscisic acid, ABA)会发生变化, 其中脱落酸变化最显著[8]。脱落酸在逆境环境下可以调控气孔关闭以及植株的生长发育[63-64]。施加外源ABA10 μmol/L处理野大麦, 带菌植株的生物量、抗氧化酶活性均显著高于未加ABA的[39]。加盐并加激素处理野大麦共生体得到不同激素对其宿主的地上和地下产量影响不同, 如对地上产量ABA具有促进作用, GA3无显著影响, 而IAA是降低作用[39]。
4 内生真菌减少盐碱胁迫对宿主禾草的次生盐害 4.1 促进抗氧化剂和抗氧化酶生成盐胁迫诱导产生的活性氧(Reactive oxy gen species, ROS)也是高盐造成细胞伤害的一个重要原因, 活性氧积累会伤害到植物的膜脂、蛋白和核酸。因此, ROS解毒是植物抵抗非生物胁迫的的一个重要方式。植物非酶促抗氧化剂一般有抗坏血酸、谷胱甘肽、α-生育酚和类胡萝卜素; 酶促抗氧化剂有超氧化歧化酶(Superoxide dismutase, SOD), 过氧化氢酶(Catalase, CAT), 过氧化物酶(Peroxidase, POD), 抗坏血酸过氧化物酶(Aseorbate peroxidase, APX), 谷胱甘肽过氧化物酶(Glutathione peroxidase, GPX)、谷胱甘肽还原酶(Glutathione reductase, GR)和丝裂原活化蛋白激酶(Mitogen-activated protein kinase, MAPK)等[5, 65]。抗盐植物通过提高抗氧化剂和抗氧化酶活性来抵抗活性氧的伤害[66-67]。植物活性氧产生和抗氧化剂解毒作用关系, 如图 1所示。
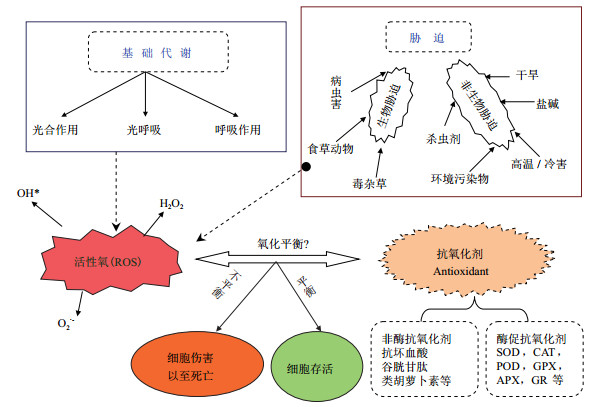
|
| 图 1 胁迫及基础代谢过程产生ROS及其促发机体的抗氧化机制清除ROS |
在许多共生体中微生物和植物可产生ROS作为信号分子或在盐胁迫下作为一种次生胁迫而出现[68]。在大麦根部接种内生真菌P.indica能促进大麦产生更高的抗坏血酸[50-52], 并进一步证实在盐处理下带菌提高了宿主大麦根部的抗氧化酶活性, 尤其是CAT和APX活性[51]。带菌醉马草幼苗盐处理后POD酶活性高于不带菌的[43]。高盐浓度下野大麦内生真菌显著提高了宿主禾草的POD、SOD和CAT含量[39, 44]。可得出内生真菌通过增加宿主抗氧化剂和抗氧化酶活性来清除ROS而使宿主植物解毒。
4.2 分泌有机渗透调节剂促进禾草进行渗透调节有机渗透剂如脯氨酸、甜菜碱、糖醇、多胺和晚期胚胎发生富集蛋白(Late embryogenesis abundant protein, LEA)家族成员蛋白, 在维持植物细胞渗透势, 抵抗盐害中起重要作用[69-70]。盐胁迫时植物体内葡萄糖、果糖、蔗糖和果聚糖等碳水化合物含量增加[71], 这些糖类物质主要的功能为渗透调节、碳储备和清除自由基[72]。在野大麦和披碱草共生体抗盐试验中得到内生真菌显著提高了宿主可溶性糖含量[35, 44]。脯氨酸在渗透调节中起着重要作用[73]。盐胁迫均可使黑麦草叶片的脯氨酸含量增加, 而相同盐处理下带内生真菌黑麦草叶内的脯氨酸高于不带菌的[51], 类似结果在野大麦和披碱草内生真菌抗盐试验中也得以重现[35, 39, 44]。可见, 内生真菌可促使宿主分泌更多的脯氨酸、糖等渗透调剂物质来提高其抗盐性。
5 结语盐碱土成分比较复杂, 包括氯化钠、氯化钙、硫酸钙、硫酸钠、高硼和高pH值。植物在不同的类型的盐碱土中的表现并不一样, 前期研究禾草内生真菌盐碱胁迫多用的是氯化钠作为盐胁迫, 高pH的碳酸钠和碳酸氢钠作为碱胁迫, 因此可以考虑每种类型盐碱条件下内生真菌对宿主禾草的影响。
内生真菌要生存, 它必须让宿主植物获得最大净收益, 但内生菌入侵后带来的这种益处并非都能被观察到, 这取决于植物和内生真菌的基因型及环境条件[74-75]。目前只有关于内生真菌生物碱保护宿主防御食草动物的机理有较系统认识[76]。前期关于内生真菌与抗盐性的研究主要集中在生长表现和生理生化机制, 可归纳为内生真菌感染能提高宿主植物的株高、分蘖、种子数量、生物产量、抗氧化酶活性, 减低盐胁迫对宿主植物的膜系统伤害, 降低了钠离子含量, 提高钾、钙、镁等离子含量, 进而改善了宿主体内的盐离子毒害作用。前期研究成果展示了禾草内生真菌具有提高宿主植物抵抗盐碱的能力, 但具体的抗盐机理还需要更进一步的解析。随着分子生物学技术和生物信息学技术的发展, 禾草内生真菌的研究也逐渐深入, 但力度和深度还不够, 尤其是研究内生真菌提高宿主抗盐碱的分子机理是今后重要的努力方向之一。相信通过对禾草内生真菌耐盐机理更系统深入研究, 进一步完善其理论, 充分利用禾草内生真菌对特异宿主的优良特性[77], 对禾草进行抗逆性状的定向改良, 一定能够把禾草内生真菌抗盐碱的研究推向新的高度。
| [1] |
Yamaguchi T, Blumwald E. Developing salt-tolerant crop plants, challenges and opportunities[J]. Trends in Plant Science, 2005, 10: 615-620. DOI:10.1016/j.tplants.2005.10.002 |
| [2] |
Cabot C, Sibole JV, Poschenrieder C. Lessons from crop plants struggling with salinity[J]. Plant Science, 2014, 226(3): 2-13. |
| [3] |
肖克飚, 吴普特, 雷金银, 班乃荣. 不同类型耐盐植物对盐碱土生物改良研究[J]. 农业环境科学学报, 2013, 31(12): 2433-2440. |
| [4] |
Porter JK. Chemical constituents of grass endophytes.Biotechnology of Endophytic Fungi of Grasses[J]. CRC Press Boca Raton, 1994, 103-123. |
| [5] |
Bush LP, Wilkinson HH, Schardl CL. Bioprotective alkaloids of grass-fungal endophyte symbioses[J]. Plant Physiology, 1997, 114: 1-7. DOI:10.1104/pp.114.1.1 |
| [6] |
Zhu JK. Plant salt tolerance[J]. Trends in Plant Science, 2001(2): 66-71. |
| [7] |
Zhu JK. Salt and drought stress signal transduction in plants[J]. Annual Review of Plant Biology, 2002, 53: 247-273. DOI:10.1146/annurev.arplant.53.091401.143329 |
| [8] |
Munns R, Tester M. Mechanisms of salinity tolerance[J]. Annual Review of Plant Biology, 2008, 59: 651-681. DOI:10.1146/annurev.arplant.59.032607.092911 |
| [9] |
王宝山. 逆境植物生物学[M]. 北京: 高等教育出版社, 2010, 18-102.
|
| [10] |
Siegel MR, Johnson MC, Varney DR, et al. A fungal endophyte in tall fescue:incidence and dissemination[J]. Phytopathology, 1984, 74(8): 932-937. DOI:10.1094/Phyto-74-932 |
| [11] |
Clay K. Fungal endophytes of grasses:a defensive mutualism between plants and fungi[J]. Ecology, 1988, 69(1): 10-16. DOI:10.2307/1943155 |
| [12] |
Schardl CL, Leuchtmann A, Chung KR, et al. Coevolution by common descent of fungal symbionts(Epichloë spp.)and grass hosts[J]. Molecular, Biology and Evolution, 1997, 14: 133-143. DOI:10.1093/oxfordjournals.molbev.a025746 |
| [13] |
Latch GCM. Physiological interactions of endophytic fungi and hosts biotic stress tolerance imparted to grasses by endophytes[J]. Agric Ecosyst Environm, 1993, 44(1-4): 143-156. DOI:10.1016/0167-8809(93)90043-O |
| [14] |
Clement SL, Wilson AD, Lester DG, Davitt CM. Fungal endophyte of wild barley and their effects on Diuraphis noxia Population development[J]. Entomologia Experimentalis Et Applicata, 1997, 82(3): 275-281. DOI:10.1046/j.1570-7458.1997.00141.x |
| [15] |
Clement SL, Lester DG. Field evaluation of wild barley against Russian wheat aphid[J]. Arthropod Management Tests, 1999, 24: 409. |
| [16] |
Clement SL, Elberson LR, Bosque-perez NA, Schotzko DJ. Detrimental and neutral effects of wild barley-Neotyphodium fungal endophyte associations on insect survival[J]. Entomologia Experimentalis Et Applicata, 2005, 114(2): 119-125. DOI:10.1111/eea.2005.114.issue-2 |
| [17] |
Clement SL, Hu JG, Stewart AV, et al. Detrimental and neutral effects of wild grass-fungal endophyte symbiotum on insect preference and performance[J]. Journal of Insect Science, 2011, 11: 1-13. |
| [18] |
Crawford KM, Land JM, Rudgers JA. Fungal endophytes of native grasses decrease insect herbivore preference and performance[J]. Oecologia, 2010, 164: 431-444. DOI:10.1007/s00442-010-1685-2 |
| [19] |
Clarke BB, White JF, Hurley RH, et al. Endophyte-mediated suppression of dollar spot disease in fine fescues[J]. Plant Disease, 2006, 90(8): 994-998. DOI:10.1094/PD-90-0994 |
| [20] |
Christensen MJ. Antifungal activity in grasses infected with Acremonium and Epichloë endophytes[J]. Australasian Plant Pathology, 1996, 25(3): 186-191. DOI:10.1071/AP96032 |
| [21] |
Bacon CW. Abiotic stress tolerances(moisture, nutrients)and photosynthesis in endophyte-infected tall fescue[J]. Agriculture Ecosyst Environm, 1993, 44(1-4): 123-141. DOI:10.1016/0167-8809(93)90042-N |
| [22] |
Malinowski DP, Belesky DP. Adaptation of endophyte-infected cool-season grasses to environment stresses:Mechanisms of drought and mineral stress tolerance[J]. Crop Science, 2000, 40(4): 923-940. DOI:10.2135/cropsci2000.404923x |
| [23] |
Swarthout D, Harper E, Judd S, et al. Measures of leaf-level water-use efficiency in drought stressed endophyte infected and non-infected tall fescue grasses[J]. Environ Exp Bot, 2009, 66: 88-93. DOI:10.1016/j.envexpbot.2008.12.002 |
| [24] |
宋梅玲, 李春杰, 彭清青, 等. 温度和水分胁迫下内生真菌对野大麦种子发芽的影响[J]. 草地学报, 2010, 6: 833-837. DOI:10.11733/j.issn.1007-0435.2010.06.015 |
| [25] |
Kane KH. Effects of endophyte infection on drought stress tolerance of Lolium perenne accessions from the Mediterranean region[J]. Enviromental and Experimental Botany, 2011, 71: 337-344. |
| [26] |
Marks S, Clay K. Physiological responses of Festuca arundinacea, to fungal endophyte infection[J]. New Phytologist, 1996, 133(4): 727-733. DOI:10.1111/nph.1996.133.issue-4 |
| [27] |
Zhou LY, Li CJ, Zhang XX, et al. Efects of cold shocked Epichloë infected Festuca sinensis on ergot alkaloid accumulation[J]. Fungal Ecology, 2015, 14: 99-104. DOI:10.1016/j.funeco.2014.12.006 |
| [28] |
Song M, Li X, Saikkonen K, et al. An asexual Epichloë endophyte enhances waterlogging tolerance of Hordeum brevisubulatum[J]. Fungal Ecology, 2015, 13: 44-52. DOI:10.1016/j.funeco.2014.07.004 |
| [29] |
Monnet F, Vaillant N, Hitmi A, et al. Endophytic Neotyphodium lolii induced tolerance to Zn stress in Lolium perenne[J]. Physiologia Plantarum, 2001, 113(4): 557-563. DOI:10.1034/j.1399-3054.2001.1130415.x |
| [30] |
Saikkonen K, Ruokolainen K, Huitu O, et al. Hamilton and M.Helander.Fungal endophytes help prevent weed invasions[J]. Agriculture Ecosystems & Environment, 2013, 165(3): 1-5. |
| [31] |
Bao GS, Saikkonen K, Wang HS, et al. Does endophyte symbiosis resist allelopathic effects of an invasive plant in degraded grassland?[J]. Fungal Ecology, 2015, 17: 114-125. DOI:10.1016/j.funeco.2015.05.006 |
| [32] |
尹立佳. 内生真菌感染对宿主禾草盐碱耐受性的生理生态影响[D]. 天津: 南开大学, 2012.
|
| [33] |
Song ML, Chai Q, Li X, et al. An asexual Epichloë endophyte modifies the nutrient stoichiometry of wild barley(Hordeum brevisubulatum)under salt stress[J]. Plant and Soil, 2015, 387(1-2): 153-165. DOI:10.1007/s11104-014-2289-0 |
| [34] |
张晶晶, 安沙舟, 施宠, 等. 内生真菌侵染对盐胁迫下德兰臭草种子萌发及幼苗生理特性的影响[J]. 中国草地学报, 2017, 39(2): 59-64. |
| [35] |
施宠, 黄炜, 王纯利. 内生真菌对披碱草耐盐性的影响[J]. 新疆农业大学学报, 2016, 39(4): 277-280. |
| [36] |
Clay K, Holah J. Fungal endophyte symbiosis and plant diversity in successional fields[J]. Science, 1999(5434): 1742-1745. |
| [37] |
Yao X, Christensen MJ, Bao GS, et al. A toxic endophyte-infected grass helps reverse degradation and loss of biodiversity of over-grazed grasslands in northwest China[J]. Scientific Reports, 2015, 5: 18527. |
| [38] |
魏茂英, 尹立佳, 贾彤, 等. 天然禾草中三种内生真菌对非生物胁迫耐性的比较研究[J]. 植物学研究, 2012, 1: 1-7. |
| [39] |
宋梅玲. 野大麦内生真菌共生体耐盐性的生理机制研究[D]. 兰州: 兰州大学, 2015.
|
| [40] |
王志伟, 王世梅, 纪燕玲, 等. 中国禾本科植物内生真菌研究-东营市盐碱地区的禾本科植物内生真菌的检测与分布特征[J]. 草业科学, 2005, 22(2): 60-64. |
| [41] |
Hammami H, Baptista P, Martins F, et al. Impact of a natural soil salinity gradient on fungal endophytes in wild barley(Hordeum maritimum, with.)[J]. World J Microbiol Biotechnol, 2016, 32(11): 184-194. DOI:10.1007/s11274-016-2142-0 |
| [42] |
Ayers AD, Brown JW, Wadleigh CH. Salt tolerance of barley and wheat in soil plots receiving several salination regimes[J]. Agronomy Journal, 1952, 44(6): 307-310. DOI:10.2134/agronj1952.00021962004400060006x |
| [43] |
缑小媛. 内生真菌对醉马草耐盐性的影响研究[D]. 兰州: 兰州大学, 2007.
|
| [44] |
王正凤, 李春杰, 金文进, 南志标. 内生真菌对野大麦耐盐性的影响[J]. 草地学报, 2009, 17(1): 88-92. DOI:10.11733/j.issn.1007-0435.2009.01.018 |
| [45] |
旷宇, 南志标, 田沛. 内生真菌和水引发对NaCl胁迫条件下中华羊茅种子萌发的影响[J]. 草业学报, 2016, 25(2): 160-168. DOI:10.11686/cyxb2015143 |
| [46] |
周连玉, 张帅, 更周才让, 罗巧玉. 盐胁迫下内生真菌感染对中华羊茅幼苗生长的影响[J]. 北方园艺, 2016(9): 65-68. |
| [47] |
Sabzalian MR, Mirlohi A. Neotyphodium endophytes trigger salt resistance in tall and meadow fescues[J]. Journal of Plant Nutrition and Soil Science, 2010, 173(6): 952-957. DOI:10.1002/jpln.v173.6 |
| [48] |
Rodriguez RJ, Henson J, Volkenburgh EV, et al. Stress tolerance in plants via habitat-adapted symbiosis[J]. International Society for Microbial Ecology, 2008, 2(4): 404-416. |
| [49] |
Bu N, Li X., Li Y, et al. Effects of Na2CO3 stress on photosynthesis and antioxidative enzymes in endophyte infected and non-infected rice[J]. Ecotoxicol Environ Saf, 2012, 78(78): 35-40. |
| [50] |
Waller F, Achatz B, Baltruschat H, et al. The endophytic fungus Piriformospora indica reprograms barley to salt-stress tolerance, disease resistance, and higher yield[J]. Proc Natl Acad Sci USA, 2005(38): 13386-13391. |
| [51] |
Baltruschat HJ, Fodor BD, Harrach E, et al. Salt tolerance of barley induced by the root endophyte Piriformospora indica is associated with a strong increase in antioxidants[J]. New Phytologist, 2008, 180(2): 501-510. DOI:10.1111/nph.2008.180.issue-2 |
| [52] |
Zabalgogeazcoa I, Romo M, Keck E, et al. The infection of Festuca rubra subsp.pruinosa by Epichloë festucae[J]. Grass and Forage Science, 2006, 61(1): 71-76. DOI:10.1111/gfs.2006.61.issue-1 |
| [53] |
任安芝, 高玉葆, 章瑾, 张晶. 内生真菌感染对黑麦草抗盐性的影响[J]. 生态学报, 2006, 26(6): 1750-1757. |
| [54] |
Battista JPD, Bacon CW, Severson R, et al. Indole acetic acid production by the fungal endophyte of tall fescue[J]. Agronomy Journal, 1990, 82(5): 878-880. DOI:10.2134/agronj1990.00021962008200050006x |
| [55] |
Porter JK, Cutler HG, Bacon CW, et al. In vitro auxin production by Balansia epichloë[J]. Phytochemistry, 1985, 7: 1429-1431. |
| [56] |
Malinowski DP, Alloush GA, Belesky DP. Leaf endophyte Neotyphodium coenophialum modifies mineral uptake in tall fescue[J]. Plant and Soil, 2000, 227(1): 115-126. |
| [57] |
Malinowski DP, Belesky DP. Neotyphodium coenophialum-endoph-yte infection affects the ability of tall fescue to use sparingly availa-ble phosphorus[J]. J Plant Nutr, 1999, 22(4-5): 835-853. DOI:10.1080/01904169909365675 |
| [58] |
王宝生, 李明亮. 盐胁迫下外源脯氨酸和丙二醛对冰叶松叶菊愈伤组织中离子和脯氨酸含量的影响[J]. 植物生理学报, 1993(3): 182-184. |
| [59] |
Mcainsh MR, Brownlee C, Hetherington AM. Calcium ions as second messengers in guard cell signal transduction[J]. Physiologia Plantarum, 1997, 100(1): 16-29. DOI:10.1111/ppl.1997.100.issue-1 |
| [60] |
Goswami S, Kumar RR, Sharma SK, et al. Calcium triggers protein kinases-induced signal transduction for augmenting the thermotolerance of developing wheat(Triticum aestivum)grain under the heat stress[J]. J Plant Biochem Biotechnol, 2015, 24(4): 441-452. DOI:10.1007/s13562-014-0295-1 |
| [61] |
王志强, 王丰峰, 林同保. 钙离子对盐胁迫小麦幼苗脯氨酸含量及其相关酶活性的影响[J]. 河南农业大学学报, 2009, 43(5): 475-479. |
| [62] |
Rong QQ, Liu JB, Cai YP, et al. Leaf carbon, nitrogen and phosphorus stoichiometry of Tamarix chinensis Lour.in the Laizhou Bay coastal wetland, China[J]. Ecological Engineering, 2015, 76: 57-65. DOI:10.1016/j.ecoleng.2014.03.002 |
| [63] |
Shinozaki K, Yamaguchi-Shinozaki K. Gene networks involved in drought stress response and tolerance[J]. Journal of Experimental Botany, 2007, 58(2): 221-227. |
| [64] |
Wasilewska A, Vlad F, Sirichandra C, et al. An update on abscisic acid signaling in plants and more[J]. Molecular Plant, 2008, 1(2): 198-217. DOI:10.1093/mp/ssm022 |
| [65] |
Chinnusamy V, Zhu JK. Plant salt tolerance:Plant Responses to Abiotic Stress[M]. Springer Berlin Heidelberg, 2004, 241-270.
|
| [66] |
Gapińska M, Skńodowska M, Gabara B. Effect of short-and long-term salinity on the activities of antioxidative enzymes and lipid peroxidation in tomato roots[J]. Acta Physiologiae Plantarum, 2008, 30(1): 11-18. |
| [67] |
Hamilton CE, Gundel PE, Helander M, Saikkonen K. Endophytic mediation of reactive oxygen species and antioxidant activity in plants:a review[J]. Fungal Diversity, 2012, 54(1): 1-10. DOI:10.1007/s13225-012-0158-9 |
| [68] |
Rouhier N, Jacquot JP. Getting sick may help plants overcome abiotic stress[J]. New Phytologist, 2008, 180(4): 738-741. DOI:10.1111/nph.2008.180.issue-4 |
| [69] |
潘多锋, 申忠宝, 王建丽, 等. 碱性盐胁迫对偃麦草苗期生长的影响[J]. 草业科学, 2016, 33(11): 2276-2282. DOI:10.11829/j.issn.1001-0629.2016-0204 |
| [70] |
Deinlein U, Stephan AB, Horie T, et al. Plant salt-tolerance mechanisms[J]. Trends Plant Sci, 2014, 19(6): 371-379. DOI:10.1016/j.tplants.2014.02.001 |
| [71] |
Parida A, Das AB, Das P. NaCl stress causes changes in photosynthetic pigments, proteins and other metabolic components in the leaves of a true mangrove, Bruguiera parviflora, in hydroponic cultures[J]. J Plant Biol, 2002, 45(1): 28-36. DOI:10.1007/BF03030429 |
| [72] |
Kerepesi I, Galiba G. Osmotic and salt stress-induced alteration in soluble carbohydrate content in wheat seedlings[J]. Crop Science, 2000, 40(2): 482-487. DOI:10.2135/cropsci2000.402482x |
| [73] |
Khatkar D, Kuhad MS. Short-term salinity induced changes in two wheat cultivars at different growth stages[J]. Biologia Plantarum, 2000, 43(4): 629-632. DOI:10.1023/A:1002868519779 |
| [74] |
Saikkonen K, Lehtonen P, Helander M, et al. Model systems in ecology:Dissecting the endophyte-grass literature[J]. Trends in Plant Science, 2006, 11(9): 428-433. DOI:10.1016/j.tplants.2006.07.001 |
| [75] |
Saikkonen K, YoungC A, Helander M, et al. Endophytic Epichloë species and their grass hosts:From evolution to applications[J]. Plant Molecular Biology, 2016, 90(6): 665-675. DOI:10.1007/s11103-015-0399-6 |
| [76] |
Johnson LJ, de Bonth ACM, et al. The exploitation of epichloae endophytes for agricultural benefit[J]. Fungal Diversity, 2013, 60(1): 171-188. DOI:10.1007/s13225-013-0239-4 |
| [77] |
田沛, 旷宇, 南志标. 中华羊茅的优良特性以及利用内生真菌进行育种潜力浅析[J]. 草业科学, 2015, 32(7): 1079-1087. DOI:10.11829/j.issn.1001-0629.2014-0438 |





