漆酶是一种含铜的多酚氧化酶, 它能够以氧分子作为最终的电子接受体催化氧化酚类和非酚类底物的氧化、降解或聚合反应[1-2]。目前, 自然界中关于漆酶的研究主要集中于真菌分泌的胞外漆酶, 分泌漆酶的真菌主要包括担子菌门(Basidiomycota)、子囊菌门(Ascomycota)和半知菌类(Deuteromycota), 其中最重要的是担子菌门中的白腐真菌[3-5]。漆酶的催化活性中心包含3个Cu2+结合位点, 共结合4个Cu2+协同介导酚类和非酚类底物的催化氧化反应[6-8]。Park等[9]主要采用紫外分光光度法测定漆酶的催化氧化活性, 其常用的显色底物包括2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(AB-TS)、2, 6-甲氧基苯酚(DMP)和愈创木酚等。漆酶对不同底物的亲和力和催化效能具体表现在米氏常数(Km)和最大反应速率常数(Vmax)值上[10-12]。
漆酶的底物广谱性和多功能特征决定了其能够作为一种环境友好型“绿色催化剂”, 并在各个领域得到广泛地应用[13-14]。例如, 漆酶已经用于有机污染物转化、合成染料脱色、造纸废水、食品加工、生物传感器和环境质量指示器等诸多绿色环境化学工程中[15-20]。此外, 固定化技术的快速发展也为增强真菌漆酶在环境中的催化活性、稳定性和循环再利用能力提供了可靠保障[7, 21]。本文综述了真菌漆酶的分子组成、结构特征及其催化氧化酚类和非酚类底物的作用机制, 系统地比较了固定化漆酶的制备技术及其优缺点, 重点剖析了真菌漆酶在绿色环境化学中的最新研究进展及其潜在的应用价值, 旨在为拓展和开发固定化漆酶技术解决环境领域面临的诸多问题提供有力的参考依据。
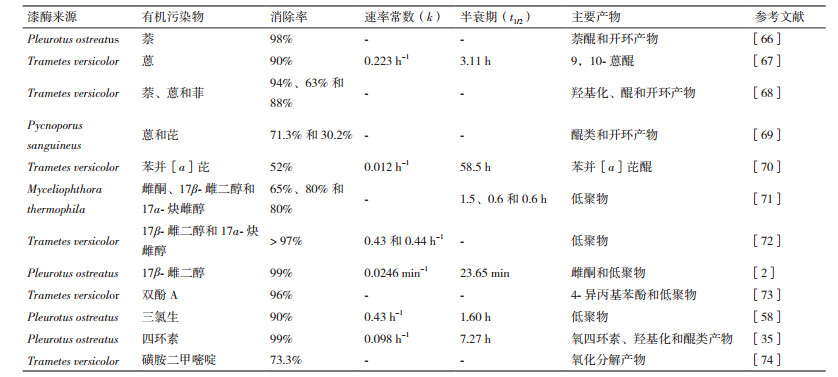
1 真菌漆酶的分子组成、结构特征及其催化机制 1.1 分子组成和结构特征漆酶分子一般由单一多肽组成, 共含有18种氨基酸(约500-550个)。真菌漆酶是一种酸性等电点单体糖蛋白, 其分子量为40-110 kD, 糖基化程度占10%-25%[22-23]。一方面, 糖基化对真菌漆酶的分泌、异源性生产、催化活性和稳定性等均可能产生不同程度的影响且难以克服; 另一方面, 糖基化也可以防控漆酶的蛋白质降解[24-25]。漆酶的蛋白质晶体结构研究结果表明[11, 26], 漆酶含有3个Cu2+结合位点, 根据氧化还原电势、光学和磁学特征可分为3种类型:T1(Ⅰ Cu2+)、T2(Ⅱ Cu2+)和T3(Ⅲa Cu2+和Ⅲb Cu2+)(图 1-A、B)。第一类(T1)和第二类(T2)各1个, 是单电子受体, 呈顺磁性。漆酶的T1位点在610 nm处有强烈的光吸收作用, 导致漆酶呈现出蓝绿色, 其吸收光谱带来源于Cu2+与半胱氨酸的共价结合; 漆酶介导的底物催化氧化过程发生在T1位点, 它可以从底物中获取电子并传递给水中的溶解氧分子[11, 27-28]。漆酶的T2位点不稳定, 由两分子咪唑和单分子水配位形成松散的扭曲四面体几何构型, 在可见光区的吸收峰较弱; 当有螯合剂存在时, T2位点能够被选择性的还原去除, 从而导致漆酶的活性显著性下降[29]。漆酶的第三类(T3)位点呈反磁体, 由两个Ⅲ Cu2+构成一个双核铜簇中心, 该铜簇中心在330 nm的紫外可见光谱处具有明显地吸收峰[24, 27, 30-31]。漆酶的T1、T2和T3位点共同构成铜簇位点的四面体几何构型(图 1-A)。
|
| 图 1 真菌漆酶的二级空间结构、活性中心位点和催化氧化功能示意图 A:真菌漆酶的二级空间结构; B:Trametes versicolor 漆酶的催化中心模型图; C:真菌漆酶介导的有机污染物催化氧化机制 |
真菌漆酶能够催化氧化酚类和非酚类底物的单电子氧化产生自由基中间体, 随后这些自由基中间体涉及到氧化耦合或目标底物的键断裂, 最终导致底物发生氧化、降解或聚合反应(图 1-C)。酶促反应过程主要包括漆酶分子对底物的作用、电子在漆酶分子中的传递、氧分子对漆酶分子的还原和产物的反作用[25], 即T1活性位点的Cu2+从还原态的底物吸收电子, 底物被氧化形成自由基, 从而导致不同非铜簇的次级反应, 如羟化、歧化和聚合反应等。真菌漆酶的整个催化循环过程中, 单个分子的氧被还原成两个分子的水, 4个底物分子被氧化形成4个自由基中间体[6, 32]。芳烃类、抗生素、药物和木质素等大分子或具有较高氧化还原电势的底物分子需要氧化还原介质的参与才能被漆酶催化氧化[27, 33-35]。这些介质分子与漆酶进行反应, 生成的自由基状态分子再氧化大体积或高氧化还原电势的底物分子[36]。以芳烃类化合物为例, 漆酶分子催化氧化芳烃类化合物, 首先从底物传递一个电子到专门的含铜位点以形成自由基, 这些自由基能够重新排列并通过歧化或互变异构化等反应生成等量的醌和氧化底物, 并进一步促使烷基-苯基裂开, 苯基醇氧化及支链和芳香环裂解[37-39]。
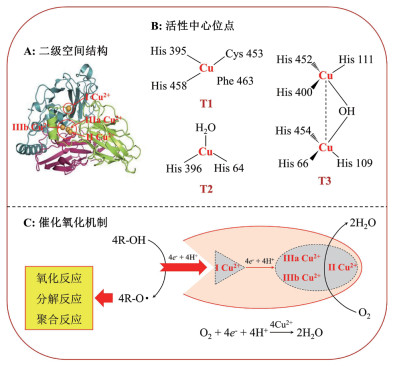
2 固定化真菌漆酶的制备及其优缺点虽然, 漆酶作为一种“绿色催化剂”具有低成本、高效率、环境友好和可持续等优点, 但是, 其在绿色环境化学中的应用受到诸多限制, 如缺乏长期的稳定性、难以回收和循环再利用等[26]。此外, 漆酶的活性也会受到温度、pH、金属离子和抑制剂等诸多环境因子的影响, 其作用机理可能是氨基酸的修饰作用、酶空间结构的改变或者是与底物结合位点的相互作用[40]。如何增强漆酶的催化活性、稳定性和循环再利用功效是推广其在环境中应用的首要任务。研究指出[7, 41], 采用吸附、包埋、共价绑定和交联结合等方法(图 2)将游离态漆酶固定在载体上制备固定化漆酶, 可以提高漆酶的催化活性、稳定性和重复利用率, 增强漆酶在实际环境中的应用。常用的固定化载体具有以下特点[7, 41]:(1)载体材料易获得且价格低廉; (2)固定化操作简便且能用于大规模生产; (3)载体机械强度高且具有较长的使用周期和重复利用率。
|
| 图 2 漆酶的固定化技术 A:采用离子吸附法将真菌漆酶固定在载体上; B:采用包埋法将真菌漆酶固定在聚合物网格中; C:真菌漆酶的亲核组和功能化载体的共价绑定; D:真菌漆酶的交链结合模型 |
吸附法包括物理吸附法和离子吸附法。(1)物理吸附法是指将漆酶液与活泼吸附载体接触, 利用分子间相互作用力使酶吸附在载体表面[21]。采用物理吸附法固定漆酶的研究中, 常用的载体包括石墨、纤维素和活性炭等可导电物质, 它们能够与漆酶形成高性能的生物传感器, 可以用来监测水溶液中的酚类物质。物理吸附的优点是固定化技术简单、可供选择的载体较多、不会改变酶的空间构象和催化性能等, 其主要的缺点是酶和载体之间的结合力较弱、固定化酶的可重复利用率低[42]。(2)离子吸附法是指将漆酶与含有离子交换基团的疏水性载体以静电作用力相结合的一种固定化方法, 其常用的载体有阴离子交换剂和阳离子交换剂[43]。该方法反应条件温和且不会改变漆酶的空间结构和活性中心的氨基酸序列, 可以获得较高活性的固定化漆酶。
2.2 包埋法包埋法分为网格型和微囊型两种, 即将漆酶包裹于凝胶形成的网络结构中或半透膜聚合物的超滤膜内, 从而实现漆酶的固定化[44]。包埋法主要采用惰性材料作为载体, 维持酶促反应过程中漆酶的活性, 其优点是反应条件温和、不会引起漆酶的空间构象和分子结构变化、漆酶活性和回收利用率较高[45]。(1)凝胶包埋法。凝胶包埋法常用的载体包括海藻酸钠凝胶、琼脂凝胶、明胶和角叉莱胶等。例如, 采用明胶和海藻酸钠的聚合作用与海藻酸钙凝胶球的包埋作用制备固定化漆酶, 不仅可以延长固定化漆酶的使用周期, 也能够提高其机械强度和稳定性。(2)微囊包埋法。微囊包埋法可以使漆酶存在于类似细胞内的环境中, 增强漆酶的稳定性, 其常用的载体有硝酸纤维素、乙基纤维素和聚苯乙烯等[45]。代云容等[46]研究指出, 采用乳液静电纺丝技术将漆酶包埋在纤维内部, 能够显著增强漆酶对pH和温度等环境因素变化的耐受性, 其稳定性得到显著性提高。
2.3 共价绑定法漆酶的共价绑定法一般分为两类:一是将固定化载体上的有关基团用二酰亚胺等活化, 随后与漆酶发生偶联反应; 二是在载体上加入一个双功能试剂, 然后将漆酶偶联上去。该方法在酶蛋白分子上的功能基团和载体表面上的反应基团之间形成牢固的化学共价键结合, 致使漆酶不易从载体上脱落并保持较高的稳定性。例如, 采用特定的化学试剂活化廉价易得的硅胶、陶瓷、土壤和蒙脱石等载体用于固定Trametes versicolor漆酶已经取得了较好的固定化效果, 且该类固定化漆酶具有良好的稳定性和重复利用性[42]。Xu等[47]研究指出, 将酶固定在氨基修饰的介孔分子筛(SBA-15)上能够保证其具有更好的化学稳定性和热稳定效能, 且该酶重复使用五次后, 其活性仍可达到初始值的49.2%。然而需指出, 共价绑定法的缺点是载体的活化和固定化操作比较复杂、反应比较剧烈, 需要严格控制条件才能获得活力较高的固定化漆酶[21]。
2.4 交联结合法交联结合法的基本原理是利用双功能或多功能试剂在酶分子间、酶分子与惰性蛋白或酶分子与载体间进行交联反应, 把酶蛋白分子彼此交叉连接起来形成交联网络结构。常用的交联剂是戊二醛, 该固定化方法常与吸附法和包埋法结合使用, 不仅可以提高固定化漆酶的活性, 也起到加固作用[48]。王颖等[49]研究表明, 与游离态漆酶相比, 以壳聚糖为载体通过交联法固定漆酶, 在pH 2.5-4.0范围内其活性较为稳定, 25℃保存10 d后酶活仍为初始酶活性的88.70%。杜东霞等[50]以海藻酸钠为载体, 戊二醇为交联剂制备的固定化漆酶在pH 4.5、底物浓度40 mg/L和反应温度65℃的水浴锅中脱色降解3 h后, 对染料刚果红的脱色率高达92.6%, 并且该酶可以重复使用。基于以上结果可知, 与游离态漆酶相比, 采用交联结合法固定漆酶可以显著地提高酶的适应能力、耐热性和贮存稳定性等。
2.5 固定化漆酶的利弊与游离态漆酶对比, 固定化漆酶有很多优势, 如提高酶的活性、稳定性、温度和pH适应性及循环再利用率等[7, 51]。同时, 固定化漆酶也可实现酶促反应的连续生产及严控酶反应过程、增加产物回收率、提高产物质量, 适用于产业化、连续化和自动化生产[52]。与此同时, 由于漆酶的分离和固定化处理等原因, 其也具备一些弊端, 如固定化过程中造成酶活性损失、可能改变漆酶的空间构象和分子结构、引起酶活性位点的变化等。表 1总结了4种常见的漆酶固定化方法的优缺点。
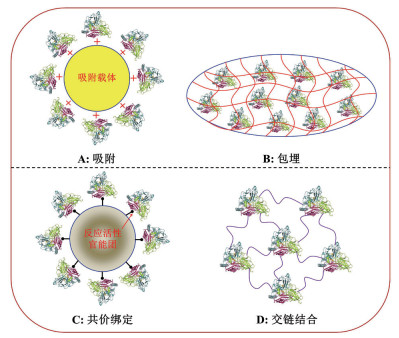
固定化酶是酶工程的核心, 它有利于实现酶的重复再利用及产物与酶的再分离, 使酶工程达到一个崭新的应用水平。真菌漆酶因具备多功能特性和广谱功效而备受关注。目前, 漆酶已经在化学、生物学和生物工程等多个学科领域得到广泛地应用, 并取得了较好的经济效益和实际价值(图 3)。例如, 漆酶在环境有机污染物去除、合成染料脱色、造纸废水、食品工业、生物监测和环境质量指示剂等绿色化学中皆有应用[15-20]。
|
| 图 3 漆酶在绿色环境化学中的多功能应用 |
环境中酚类污染物、多环芳烃(PAHs)、抗生素和药物等污染备受国际关注。其在环境中长期稳定存在, 对野生物种具有毒害作用, 且难以通过化学和生物过程降解代谢[53-54]。漆酶能催化氧化多种难降解有机污染物(表 2), 其催化氧化能力与漆酶的氧化还原能力和底物的电势能密切相关, 电势能较高的底物会阻碍漆酶的氧化还原能力[17, 36, 55]。漆酶介导酚类污染物的转化主要通过氧化耦合反应形成多种复杂性聚合物[2]; 而针对非酚类惰性有机污染物, 漆酶需要反应活性分子的参与共同完成底物的氧化降解过程。添加氧化还原介质可以极大的促进漆酶的活性及其对惰性有机污染物的催化氧化反应。研究表明[56], 漆酶能够通过聚合和氧化降解反应有效地摧毁雌激素类化合物的雌激素活性。另有研究指出[57], 从菌株白腐真菌(Marasmius quercophilus)中分离出的不同亚类漆酶能够有效地转化PAHs中的蒽和苯并[a]芘, 但对萘和菲无效果。PAHs的电离电位影响它们的酶促反应效能, 该亚类漆酶仅能够转化电离电位小于7.55 eV的PAHs。
研究指出[2, 58], Pleurotus ostreatus漆酶能够催化氧化雌二醇和三氯生, 并通过自由基介导的C-C或C-O-C耦合反应形成二聚体、三聚体和四聚体等聚合产物。夏青等[59]研究表明, 漆酶能够有效地催化双酚A、雌二醇、炔雌醇、雌铜和辛基酚等雌激素的转化; 当呈现天然有机质时, 在反应初期可抑制该5种雌激素的去除效率, 而反应后期无显著性影响。陈辉等[60]研究证实, 固定化漆酶能够提高酶的稳定性和重复利用率, 可用于连续降解2, 4-二氯苯酚(2, 4-DCP), 在连续反应6 h后其对2, 4-DCP的降解率仍然保持在60%以上。王颖等[49]研究指出, 采用壳聚糖固定漆酶对2, 4-DCP具有良好的吸附-催化氧化效能, 且随着反应时间的递增, 溶液中氯离子浓度逐渐增加。气相色谱-质谱串联技术分析结果表明, 2, 4-DCP的可溶性降解产物主要包括2-羟基丙二酸和3-羟基-顺, 顺-黏糖酸。
3.1.2 催化氧化土壤中有机污染物固定化漆酶在土壤中的应用主要表现在修复土壤污染。Singh等[61]研究表明, 漆酶对土壤中17β-雌二醇的转化具有较好的调控作用, 反应5 h后土壤中17β-雌二醇的去除率高达98%以上, 而漆酶的活性无显著性变化。赵月春等[62]采用游离态漆酶处理土壤二氯二苯三氯乙烷(DDT)污染, DDT总降解率为50.53%, 而在固定化反胶团漆酶处理中DDT总降解率高达69.17%, 且固定化反胶团漆酶对DDT各组分的降解均高于游离态漆酶。另有研究[63-64]将Trametes orientalis漆酶加入老化的PAHs污染土壤, 培养10 d后, 该酶对蒽和苯并[a]芘的转化率分别为52.7%和40.8%, 添加ABTS可以提高其对PAHs的转化效率。此外, 采用可生物降解的高分子外消旋聚乳酸作为原料, 结合乳液电纺技术将漆酶包埋固定在纳米纤维中, 也可以有效地去除土壤中菲、荧蒽、苯并[a]蒽和苯并[a]芘等PAHs[65]。
3.2 合成染料的脱色反应合成类染料已经广泛地应用于染色工艺和印刷产业, 其种类繁多、结构复杂且难降解, 并具有生物毒性和致畸效应。每年大约有10%的合成染料经过不同的水通道进入环境中, 它们可以改变水体的理化性质, 对水生物种造成潜在的危害。研究指出[22], 采用高效脱色生物酶进行合成染料的脱色处理, 具有成本低、无二次污染和经济有效等特点。真菌漆酶能够有效地去除生色团化合物, 如偶氮、三芳基甲烷、酸性紫、蒽醌和靛蓝类染料等, 实现对合成染料的脱色, 且多数在10 min内即可达到80%的脱色率[6-7, 75-76]。例如, Trametes hirsute产生的漆酶不仅可以用于纺织染料的脱色和解毒, 对靛蓝类染料、偶氮和蒽醌染料也具有相同的效果[19]。赵林果等[77]研究发现, 采用自制复合型载体丙烯酸酯类聚合物固定的漆酶在酶用量为12.5 U/mL、染料浓度为150 mg/L、反应温度为45-55℃和pH 4.5-5.0的条件下脱色降解酸性紫43, 反应4 h后染料酸性紫43的脱色率高达98.5%。另有研究指出[78], 绿椰纤维对染料RB5的吸附脱色率为23%, 固定化空白小球对染料RB5的吸附脱色率为11.95%, 而采用固定化漆酶-介体系统对染料RB5的脱色率高达92.5%。由此可见, 利用漆酶的固定化技术可以对合成染料进行有效脱色。
3.3 造纸工业中的应用漆酶在造纸工业中的应用主要包括纸浆的生物漂白、木质素降解和造纸废水处理等。与传统的化学方法相比, 通过漆酶参与的生物制浆工艺在降低能耗和节约设备的基础上, 进一步避免了传统化学方法降解木质素时不够彻底的问题。与此同时, 用漆酶进行的生物制浆也避免了传统的氯化物漂白产生废水污染和漂白后纸张极易反弹等一系列的弊端现象, 显著地提高了纸张的质量和强度。
生物漂白技术是一种绿色环保型漂白方法, 可提高纸浆的可漂性, 减少化学药品的使用量及其对环境的污染。付时雨等[79]研究了漆酶/介体系统漂白尾叶桉硫酸盐浆, 结果表明, Panus conchatus漆酶在介体N-羟基乙酰苯胺的存在下进行尾叶桉硫酸盐浆的生物漂白, 可使纸浆的卡伯值降低30%。在漆酶处理时添加表面活性剂可以增加木质素的溶出、提高纸浆的白度, 并且保持漆酶的稳定性。漆酶在木质素的生物降解中起着重要的作用, 对纤维素原料的解构也有很大的潜力[80]。Wang等[81]指出, 不同漆酶电荷和处理时间下对木质素的去除体现在两个阶段:快速初始阶段和缓慢的第二阶段, 并发现大多数木质素的降解发生在漆酶处理的前2 h内, 其后木质素的降解率保持在一个较高的水平, 直至5 h后木质素被彻底降解。在造纸废水方面, 刘娜娜[82]指出在序批式反应器(SBR)中投加200 mL以海藻酸钠固定的Trametes versicolor漆酶, 能够有效地改善造纸废水的水质质量, 并增强SBR抵抗进水负荷的冲击能力。刘帅等[83]研究也表明, 采用最佳工艺条件(反应时间6 h、温度50-55℃、pH 4.0)处理造纸废水时, 固定化漆酶对废水中COD去除率为74%, 色度去除率为77%。该固定化漆酶具备反应温度耐受性强、pH适应性广、处理效果好和反应周期短等特点。因此, 固定化漆酶技术可以广泛地应用于造纸工业。
3.4 在食品工业中的应用漆酶在食品行业具有多方面的应用, 可以用于调整食物或饮料的外观颜色、提高葡萄酒的稳定性。在烘焙食品中, 漆酶可增加面团的机械强度、稳定性并降低它的黏性, 从而改善面团的机械加工性; 漆酶在食品气味控制和品质提高方面也有诸多应用[84]。此外, 漆酶可以提高食品的生产效率和质量, 且投资成本较低[85]。漆酶能降解白酒、啤酒和果汁中的酚类物质, 保持食品的风味、减缓食品变色和变质的速度。很多漆酶底物, 如碳水化合物、不饱和脂肪酸、酚类化合物及含疏基的蛋白质是各种食品和饮料的重要组成部分, 应用漆酶可以改善食品品质、降低成本。Alberts等[86]指出, Pleurotus ostreatus漆酶能够降解一种黄曲霉毒素AFB1, 并且其漆酶活性比Trametes versicolor和Penicillium等真菌强。例如, 利用来源于Frametes versicolor的漆酶处理低芥酸菜籽产品(通常作为饲料饲养畜禽), 3 h内低芥酸菜籽中酚含量降低90%, 其可能代替大豆蛋白用于食品和饲料的产生[88]。此外, 漆酶添加在漱口水、牙膏、口香糖和薄荷糖等各种口腔用品中可以起到抑制口臭的作用[87]。
3.5 生物检测漆酶在催化氧化反应中消耗氧分子, 该过程容易被转化为电信号而得到高灵敏度检测。目前, 已经有多种漆酶在生物检测中得到广泛地应用[89]。例如, 利用漆酶生物传感器可以方便快速地检测到废水中的酚类、芳香胺类、有机磷化合物和二噁英等有毒物质[90-91]。
3.5.1 生物传感器生物传感器是以固定化的生物成分(酶、蛋白质、DNA抗体、抗原和生物膜等)或生物本身(细胞、微生物和组织等)为敏感材料, 与适当的化学转换器相结合产生的一种快速检测各种物理、化学和生物量的器件, 其通过各种物理、化学换能器捕捉目标物与敏感物之间的反应, 然后将反应的程度转换成电信号, 根据电信号推算出被测量的大小[92]。固定化漆酶使漆酶的活性、稳定性和环境适应能力较游离态漆酶均有所提高, 其为生物传感器的制备提供了良好的条件。漆酶传感器是以固定化漆酶作为感受器, 以基础电极作为换能器的装置。Liu等[93]将Trametes versicolor漆酶包埋在高分子聚合胶的原位电纺和纳米金颗粒中, 该生物传感器在灵敏度线性范围内能够检测氯酚, 检测顺序依次为2, 4-DCP > 2, 4, 6-三氯酚 > 4-氯苯酚, 检测范围0.04-12.10 μmol/L; 30 d储存期后, 漆酶依旧保留较高的重复性和酶活力(> 60%)。运用纤维质的DEAE-纤维素固定漆酶, 制成两种类型的高活力和稳定性传感器, 用于检测茶叶加工过程中儿茶酚的变化情况, 每个酶单元可以作500次以上检测, 并在室温下保存2个月。这种类型的传感器也可以用来检测来自煤炭、石油、天然气和造纸等工业污水中的木质素和酚类物质等。
3.5.2 免疫检测在免疫检测中, 漆酶有望替代辣根过氧化物酶而成为新的标记酶, 因为漆酶具有以下几个优点:氧气作为第二底物, 不形成非产物型的酶-底物复合物; 相比于过氧化物酶, 漆酶对介质中不同价态的金属离子浓度的敏感性较低; 无需特殊的仪器和试剂。漆酶在生物检测中的应用具有重要意义, 使免疫检测更灵敏、结果更准确, 使生物传感器测定的范围更宽、操作更简便, 不仅可以用更低廉的费用分析更多的样品, 而且减少了有机溶剂的使用量, 优于物理化学方法[94]。
3.6 环境质量指示器如果采用未知污染物对环境进行定性和定量, 必须测定多种属性, 共同评估环境质量和状态, 主要包括修复过程的实施和总结。通常选择指示器的最小数据集, 它们具有响应性、可承受性、可解释性、国际接受性和生态意义等。研究指出[95-96], 土壤酶能够用于评估人类活动对土壤质量的影响和生态系统的扰动, 而在丝状真菌中表达的重组漆酶可应用于环境中酚类化合物的检测。将漆酶吸附在碳上制成固定化酶电极能有效地催化负极氧化还原, 间接地进行环境监测。这种方法的特点就是专一性强、速度快、可连续操作、手续简便、测定结果直观显示并有数据记录储存, 环境及人为因素对其影响较小, 可精确测量浓度在2.0×10-5-7.0×10-4 mol/L范围内的多酚和多氨基苯等底物, 适用于一些有特殊要求的区域环境监测, 如海洋环境监测网络、三峡库区环境监测、环境应急响应监测和突发性环境事故的应急监测。
4 展望综上所述, 真菌漆酶可以介导多种底物形成自由基中间体, 并通过这些中间体的氧化、分解或耦合反应转化底物。吸附、包埋、共价绑定和交链结合等固定化技术能够增强漆酶在环境中的活性、稳定性和循环再利用能力。结合漆酶的多功能特征和固定化技术的优势, 固定化漆酶已经在诸多绿色环境化学中得到了广泛地应用。例如, 将漆酶嵌入生物传感器中可提高其探测和多功能分析能力, 并有效地评估污染环境中的分子类型、检测污染物的浓度和去除效率。此外, 纳米技术、微电子和微流体技术的应用也使得漆酶生物传感器对环境中化学物质的检测更加快速、准确和可靠。
然而需指出, 我国关于固定化漆酶在绿色环境化学中的应用仍处于初级阶段。能否建立一整套漆酶与环境之间的理想模型体系, 通过分析环境中漆酶的活性和污染物之间的关系, 评估污染物对环境质量和健康指标的影响?该理论模型值得深入发掘。另一方面, 如何拓展和探究漆酶在绿色环境化学中新的应用途径和技术手段也是研究者今后亟待解决的难点问题。鉴于此, 我国学者今后研究的重点仍需从以下几个方面着手:(1)分离筛选高产漆酶真菌, 推动漆酶的大规模生产和工业化应用; (2)优选高效、稳定的固定化漆酶载体, 通过修饰和改性载体提高其固定化效能; (3)将固定化漆酶与环境处理工艺相结合, 拓展漆酶在环境污染治理中的应用; (4)采用基因工程对产漆酶真菌进行异源表达, 改善漆酶的理化性质, 挖掘其在绿色环境化学工艺领域中新的应用前景和价值。
| [1] |
丁惠君, 吴亦潇, 钟家有, 等. 两种介体物质在漆酶降解磺胺类抗生素中的作用[J]. 中国环境科学, 2016, 36(5): 1469-1475. |
| [2] |
Sun K, Luo Q, Gao Y, et al. Laccase-catalyzed reactions of 17β-estradiol in the presence of humic acid:Resolved by high-resolution mass spectrometry in combination with 13C labeling[J]. Chemos-phere, 2016, 145: 394-401. DOI:10.1016/j.chemosphere.2015.11.117 |
| [3] |
张延威, 邱树毅, 韩燕峰, 等. 产漆酶菌株筛选及一株产酶菌株的优化与鉴定[J]. 微生物学通报, 2014, 41(2): 251-257. |
| [4] |
Dhakar K, Anita P. Phialophora melinii(NFCCI 3617):A newly isolated psychrotolerant fungus that produces enhanced laccase under the influence of organic solvents[J]. Advances in Natural Science, 2015, 8(1): 14-20. |
| [5] |
Rekadwad B, Khobragade C. Fungi imperfecti laccase: Biotechnological potential and perspectives[M/OL]//Microbial Applications Vol. 2. Springer International Publishing, 2017: 203-212.
|
| [6] |
刘家扬, 焦国宝, 有小娟, 等. 真菌漆酶的性质, 生产及应用研究进展[J]. 生物技术通报, 2016, 32(4): 24-33. |
| [7] |
Fernández-Fernández M, Sanromán MÁ, Moldes D. Recent developments and applications of immobilized laccase[J]. Biotechnol Adv, 2013, 31(8): 1808-1825. DOI:10.1016/j.biotechadv.2012.02.013 |
| [8] |
Piontek K, Antorini M, Choinowski T. Crystal structure of a laccase from the fungus Trametes versicolor at 1.90-Å resolution containing a full complement of coppers[J]. Journal of Biological Chemistry, 2002, 277(40): 37663-37669. DOI:10.1074/jbc.M204571200 |
| [9] |
Park JW, Dec J, Kim JE, et al. Effect of humic constituents on the transformation of chlorinated phenols and anilines in the presence of oxidoreductive enzymes or birnessite[J]. Environmental Science & Technology, 1999, 33(12): 2028-2034. |
| [10] |
刘欢, 袁兴中, 彭馨, 等. 反胶束体系中漆酶催化愈创木酚的研究[J]. 中国环境科学, 2015, 35(2): 493-498. |
| [11] |
罗爽, 谢天, 刘忠川, 等. 漆酶/介体系统研究进展[J]. 应用与环境生物学报, 2015, 21(6): 987-995. |
| [12] |
Miyazawa N, Tanaka M, Hakamada M, et al. Molecular dynamics study of laccase immobilized on self-assembled monolayer-modified Au[J]. Journal of Materials Science, 2017, 52(21): 12848-12853. DOI:10.1007/s10853-017-1392-z |
| [13] |
马双新, 刘宁, 贾慧, 等. 玉米大斑病菌漆酶基因Stlac2结构分析及原核表达[J]. 中国农业科学, 2016, 49(21): 4130-4139. DOI:10.3864/j.issn.0578-1752.2016.21.007 |
| [14] |
Mate DM, Alcalde M. Laccase engineering:From rational design to directed evolution[J]. Biotechnol Adv, 2015, 33(1): 25-40. DOI:10.1016/j.biotechadv.2014.12.007 |
| [15] |
Couto SR, Herrera JLT. Industrial and biotechnological applications of laccases:A review[J]. Biotechnol Adv, 2006, 24(5): 500-513. DOI:10.1016/j.biotechadv.2006.04.003 |
| [16] |
Zheng F, An Q, Meng G, et al. A novel laccase from white rot fungus Trametes orientalis:Purification, characterization, and application[J]. Int J Biol Macromol, 2017, 102: 758-770. DOI:10.1016/j.ijbiomac.2017.04.089 |
| [17] |
李阳, 蒋国翔, 牛军峰, 等. 漆酶催化氧化水中有机污染物[J]. 化学进展, 2009, 21(10): 2028-2036. |
| [18] |
Polak J, Jarosz-Wilkolazka A. Fungal laccases as green catalysts for dye synthesis[J]. Process Biochemistry, 2012, 47(9): 1295-1307. DOI:10.1016/j.procbio.2012.05.006 |
| [19] |
Subramanian J, Ramesh T, Kalaiselvam M. Fungal laccases-properties and applications:A review[J]. Int J Pharm Biol Arch, 2014, 5(2): 8-16. |
| [20] |
Yang J, Ng TB, Lin J, et al. A novel laccase from basidiomycete Cerrena sp.:Cloning, heterologous expression, and characterization[J]. Int J Biol Macromol, 2015, 77: 344-349. DOI:10.1016/j.ijbiomac.2015.03.028 |
| [21] |
罗开昆, 彭红, 龚跃法. 漆酶的固定化及其在废水处理中的应用[J]. 工业水处理, 2005, 25(5): 14-17. DOI:10.11894/1005-829x.2005.25(5).14 |
| [22] |
司静, 李伟, 崔宝凯, 等. 真菌漆酶性质, 分子生物学及其应用研究进展[J]. 生物技术通报, 2011(2): 48-55. |
| [23] |
Giardina P, Faraco V, Pezzella C, et al. Laccases:A never-ending story[J]. Cellular and Molecular Life Sciences, 2010, 67(3): 369-385. DOI:10.1007/s00018-009-0169-1 |
| [24] |
葛宏华, 武赟, 肖亚中. 漆酶空间结构, 反应机理及应用[J]. 生物工程学报, 2011, 27(2): 156-163. |
| [25] |
Baldrian P. Fungal laccases-occurrence and properties[J]. FEMS Microbiol Rev, 2006, 30(2): 215-242. DOI:10.1111/j.1574-4976.2005.00010.x |
| [26] |
Riva S. Laccases:Blue enzymes for green chemistry[J]. Trends in Biotechnology, 2006, 24(5): 219-226. DOI:10.1016/j.tibtech.2006.03.006 |
| [27] |
王国栋, 陈晓亚. 漆酶的性质, 功能, 催化机理和应用[J]. 植物学通报, 2003, 20(4): 469-475. |
| [28] |
Mayer AM, Staples RC. Laccase:New functions for an old enzyme[J]. Phytochemistry, 2002, 60(6): 551-565. DOI:10.1016/S0031-9422(02)00171-1 |
| [29] |
高玉千, 张利明, 张世敏, 等. 真菌漆酶高级结构研究进展[J]. 食品与生物技术学报, 2011, 30(2): 166-171. |
| [30] |
Palmer AE, Lee SK, Solomon EI. Decay of the peroxide intermed-iate in laccase:Reductive cleavage of the O-O bond[J]. Journal of the American Chemical Society, 2001, 123(27): 6591-6599. DOI:10.1021/ja010365z |
| [31] |
Garavaglia S, Cambria MT, Miglio M, et al. The structure of Rigidoporus lignosus laccase containing a full complement of copper ions, reveals an asymmetrical arrangement for the T3 copper pair[J]. Journal of Molecular Biology, 2004, 342(5): 1519-1531. DOI:10.1016/j.jmb.2004.07.100 |
| [32] |
Su J, Fu J, Wang Q, et al. Laccase:a green catalyst for the biosyn-thesis of poly-phenols[J]. Critical Reviews in Biotechnology, 2018, 38(2): 294-307. DOI:10.1080/07388551.2017.1354353 |
| [33] |
Christopher LP, Yao B, Ji Y. Lignin biodegradation with laccase-mediator systems[J]. Frontiers in Energy Research, 2014, 2: 12. |
| [34] |
Peng X, Yuan X, Liu H, et al. Degradation of polycyclic aromatic hydrocarbons(PAHs)by laccase in rhamnolipid reversed micellar system[J]. Applied Biochemistry and Biotechnology, 2015, 176(1): 45-55. DOI:10.1007/s12010-015-1508-3 |
| [35] |
Sun K, Huang Q, Li S. Transformation and toxicity evaluation of tetracycline in humic acid solution by laccase coupled with 1-hydroxybenzotriazole[J]. Journal of Hazardous Materials, 2017, 331: 182-188. DOI:10.1016/j.jhazmat.2017.02.058 |
| [36] |
赖超凤, 李爽, 彭丽丽, 等. 漆酶及其在有机合成中应用的研究进展[J]. 化工进展, 2010(7): 1300-1308. |
| [37] |
靳蓉, 张飞龙. 漆酶的结构与催化反应机理[J]. 中国生漆, 2012, 31(4): 6-16. |
| [38] |
Dodor DE, Hwang HM, Ekunwe SIN. Oxidation of anthracene and benzo[a]pyrene by immobilized laccase from Trametes versicolor[J]. Enzyme and Microbial Technology, 2004, 35(2): 210-217. |
| [39] |
Han MJ, Choi HT, Song HG. Degradation of phenanthrene by Trametes versicolor and its laccase[J]. The Journal of Microbiology, 2004, 42(2): 94-98. |
| [40] |
邓寒梅, 邵可, 梁家豪, 等. 漆酶的来源及固定化漆酶载体研究进展[J]. 生物技术通报, 2017, 33(6): 10-15. |
| [41] |
王新, 刘丽, 陆佳靓, 等. 固定化漆酶载体研究进展[J]. 生态学杂志, 2013(10): 2823-2829. |
| [42] |
潘洪艳, 张安龙, 张佳. 漆酶的固定化及其在造纸废水处理中的应用[J]. 黑龙江造纸, 2011, 39(1): 43-45. |
| [43] |
游金坤, 余旭亚, 赵鹏. 吸附法固定化酶的研究进展[J]. 化学工程, 2012(4): 1-5. |
| [44] |
王美银, 张新颖, 汤真平. 固定化漆酶处理染料废水的研究进展[J]. 能源与环境, 2017(3): 85-86. |
| [45] |
乔德亮, 胡冰, 曾晓雄. 酶固定化及其在食品工业中应用新进展[J]. 食品工业科技, 2008(1): 304-308. |
| [46] |
代云容, 袁钰, 于彩虹, 等. 静电纺丝纤维膜固定化漆酶对水中双酚A的降解性能[J]. 环境科学学报, 2015, 35(7): 2107-2113. |
| [47] |
Xu Y, Zhou G, Wu C, et al. Improving adsorption and activation of the lipase immobilized in amino-functionalized ordered mesoporous SBA-15[J]. Solid State Sciences, 2011, 13(5): 867-874. DOI:10.1016/j.solidstatesciences.2011.03.003 |
| [48] |
Tan Y, Deng W, Ge B, et al. Biofuel cell and phenolic biosensor based on acid-resistant laccase-glutaraldehyde functionalized chitosan-multiwalled carbon nanotubes nanocomposite film[J]. Biosensors and Bioelectronics, 2009, 24(7): 2225-2231. DOI:10.1016/j.bios.2008.11.026 |
| [49] |
王颖, 张笛, 茹加, 等. 壳聚糖固定化漆酶酶学性质及其催化氧化水中2, 4-二氯酚的效能与途径[J]. 环境化学, 2013, 32(10): 1901-1908. DOI:10.7524/j.issn.0254-6108.2013.10.012 |
| [50] |
杜东霞, 王宜磊. 固定化漆酶对刚果红染料脱色降解的研究[J]. 安徽农业科学, 2013, 41(11): 4985-4987. DOI:10.3969/j.issn.0517-6611.2013.11.102 |
| [51] |
罗贵民. 酶工程[M]. 北京: 化学工业出版社, 2003, 251-253.
|
| [52] |
陈冬梅. 固定化酶及其在食品工业中的应用[J]. 现代农业科技, 2010(19): 330-332. DOI:10.3969/j.issn.1007-5739.2010.19.218 |
| [53] |
傅婉秋, 谢星光, 戴传超, 等. 植物-微生物联合对环境有机污染物降解的研究进展[J]. 微生物学通报, 2017, 44(4): 929-939. |
| [54] |
冯秋园, 吴桐, 万祎, 等. 持久性有机污染物(POPs)在水生生态系统中的环境行为[J]. 北京大学学报:自然科学版, 2017, 53(3): 588-596. |
| [55] |
Dai Y, Yin L, Niu J. Laccase-carrying electrospun fibrous membranes for adsorption and degradation of PAHs in shoal soils[J]. Environmental Science & Technology, 2011, 45(24): 10611-10618. |
| [56] |
Kudanga T, Nyanhongo GS, Guebitz GM, et al. Potential applications of laccase-mediated coupling and grafting reactions:A review[J]. Enzyme and Microbial Technology, 2011, 48(3): 195-208. DOI:10.1016/j.enzmictec.2010.11.007 |
| [57] |
Farnet AM, Gil G, Ferre E. Effects of pollutants on laccase activities of Marasmius quercophilus, a white-rot fungus isolated from a Mediterranean schlerophyllous litter[J]. Chemosphere, 2008, 70(5): 895-900. DOI:10.1016/j.chemosphere.2007.06.086 |
| [58] |
孙凯, 李舜尧. 漆酶催化氧化水溶液中三氯生转化的作用机理[J]. 中国环境科学, 2017, 37(8): 2947-2954. |
| [59] |
夏青, 谢卫平, 刘国强, 等. 漆酶催化氧化水中雌激素的研究[J]. 环境科学, 2013, 34(8): 3119-3124. |
| [60] |
陈辉, 张剑波, 刘小鹏, 等. 漆酶催化降解氯酚类有机污染物[J]. 北京大学学报:自然科学版, 2005, 41(4): 605-611. |
| [61] |
Singh R, Cabrera ML, Radcliffe DE, et al. Laccase mediated transformation of 17β-estradiol in soil[J]. Environmental Pollution, 2015, 197: 28-35. DOI:10.1016/j.envpol.2014.11.023 |
| [62] |
赵月春, 付蓉, 莫测辉, 易筱筠. 固定化反胶团漆酶及其在修复土壤DDT污染中的应用[J]. 生态环境, 2008(2): 606-610. |
| [63] |
Li X, Lin X, Yin R, et al. Optimization of laccase-mediated benzo[a]pyrene oxidation and the bioremedial application in aged polycyclic aromatic hydrocarbons-contaminated soil[J]. Journal of Health Science, 2010, 56(5): 534-540. DOI:10.1248/jhs.56.534 |
| [64] |
林先贵, 吴宇澄, 曾军, 等. 多环芳烃的真菌漆酶转化及污染土壤修复技术[J]. 微生物学通报, 2017, 44(7): 1720-1727. |
| [65] |
葛世杰. 固定化阿特拉津降解酶制备及其土壤修复效果研究[D]. 哈尔滨: 东北农业大学, 2013.
|
| [66] |
Sukor MZ, Yin CY, Savory RM, et al. Biodegradation kinetics of naphthalene in soil medium using Pleurotus ostreatus in batch mode with addition of fibrous biomass as a nutrient[J]. Bioremediation Journal, 2012, 16(3): 177-184. DOI:10.1080/10889868.2012.687417 |
| [67] |
任大军, 许琴, 张元元, 等. 漆酶/ABTS介体系统对蒽的降解研究[J]. 工业安全与环保, 2013(12): 1-3. DOI:10.3969/j.issn.1001-425X.2013.12.001 |
| [68] |
Bautista LF, Morales G, Sanz R. Biodegradation of polycyclic aromatic hydrocarbons(PAHs)by laccase from Trametes versicolor covalently immobilized on amino-functionalized SBA-15[J]. Chemosphere, 2015, 136: 273-280. DOI:10.1016/j.chemosphere.2015.05.071 |
| [69] |
Li X, Wang Y, Wu S, et al. Peculiarities of metabolism of anthracene and pyrene by laccase-producing fungus Pycnoporus sanguineus H1[J]. Biotechnology and Applied Biochemistry, 2014, 61(5): 549-554. DOI:10.1002/bab.2014.61.issue-5 |
| [70] |
Hu X, Zhang Y, Zhao X, et al. Biodegradation of benzo[a]pyrene with immobilized laccase:Genotoxicity of the products in HaCat and A3 cells[J]. Environmental and Molecular Mutagenesis, 2007, 48(2): 106-113. DOI:10.1002/(ISSN)1098-2280 |
| [71] |
Lloret L, Hollmann F, Eibes G, et al. Immobilisation of laccase on Eupergit supports and its application for the removal of endocrine disrupting chemicals in a packed-bed reactor[J]. Biodegradation, 2012, 23(3): 373-386. DOI:10.1007/s10532-011-9516-7 |
| [72] |
Blánquez P, Guieysse B. Continuous biodegradation of 17β-estradiol and 17α-ethynylestradiol by Trametes versicolor[J]. Journal of Hazardous Materials, 2008, 150(2): 459-462. DOI:10.1016/j.jhazmat.2007.09.085 |
| [73] |
Arca-Ramos A, Eibes G, Feijoo G, et al. Potentiality of a ceramic membrane reactor for the laccase-catalyzed removal of bisphenol A from secondary effluents[J]. Appl Microbiol Biotechnol, 2015, 99(21): 9299-9308. DOI:10.1007/s00253-015-6826-4 |
| [74] |
Liang S, Luo Q, Huang Q. Degradation of sulfadimethoxine catalyzed by laccase with soybean meal extract as natural mediator:Mechanism and reaction pathway[J]. Chemosphere, 2017, 181: 320-327. DOI:10.1016/j.chemosphere.2017.04.100 |
| [75] |
Peralta-Zamora P, Pereira CM, Tiburtius ERL, et al. Decolorization of reactive dyes by immobilized laccase[J]. Applied Catalysis B:Environmental, 2003, 42(2): 131-144. DOI:10.1016/S0926-3373(02)00220-5 |
| [76] |
袁海生, 戴玉成, 曹云, 等. 白腐真菌染料脱色菌株的筛选及一色齿毛菌脱色条件的研究[J]. 菌物学报, 2010(3): 429-436. |
| [77] |
赵林果, 季永新, 李强, 等. 固定化漆酶对染料酸性紫43的脱色和降解[J]. 工业微生物, 2007, 37(6): 35-40. |
| [78] |
Manu B, Chaudhari S. Anaerobic decolorisation of simulated textile wastewater containing azo dyes[J]. Bioresource Technology, 2002, 82(3): 225-231. DOI:10.1016/S0960-8524(01)00190-0 |
| [79] |
付时雨, 詹怀宇. 漆酶/介体系统漂白尾叶桉硫酸盐浆的初步研究[J]. 中国造纸, 2000(2): 8-12. |
| [80] |
Rich JO, Anderson AM, Berhow MA. Laccase-mediator catalyzed conversion of model lignin compounds[J]. Biocatalysis and Agricultural Biotechnology, 2016, 5: 111-115. DOI:10.1016/j.bcab.2016.01.001 |
| [81] |
Wang Q, Liu S, Yang G, et al. Modeling laccase-induced lignin removal in prehydrolysis liquor from kraft-based dissolving pulp production[J]. Bioresource Technology, 2015, 175: 638-641. DOI:10.1016/j.biortech.2014.10.149 |
| [82] |
刘娜娜. 固定化漆酶在SBR处理造纸废水中的应用[J]. 天津造纸, 2015, 37(2): 7-10. |
| [83] |
刘帅, 张安龙, 罗清. 固定漆酶与游离漆酶对造纸废水深度处理的研究[J]. 纸和造纸, 2012, 31(3): 63-65. |
| [84] |
张昱, 赵倩, 李冠华. 漆酶在食品领域的应用研究进展[J]. 食品工业科技, 2016, 17: 77. |
| [85] |
Minussi RC, Pastore GM, Durán N. Potential applications of laccase in the food industry[J]. Trends in Food Science & Technology, 2002, 13(6): 205-216. |
| [86] |
Alberts JF, Gelderblom WCA, Botha A, et al. Degradation of aflatoxin B 1 by fungal laccase enzymes[J]. International Journal of Food Microbiology, 2009, 135(1): 47-52. DOI:10.1016/j.ijfoodmicro.2009.07.022 |
| [87] |
Brinch DS, Pedersen PB. Toxicological studies on laccase from Myceliophthora thermophila expressed in Aspergillus oryzae[J]. Regulatory Toxicology and Pharmacology, 2002, 35(3): 296-307. DOI:10.1006/rtph.2002.1538 |
| [88] |
王岁楼, 王琼波. 漆酶在食品工业中的应用及其产生菌的研究[J]. 食品科学, 2005(2): 260-263. |
| [89] |
刘佳, 殷立峰, 代云容, 等. 电化学酶传感器在环境污染监测中的应用[J]. 化学进展, 2011, 24(01): 131-143. |
| [90] |
García-Arellano H, Fink D, Hernández GM, et al. Nuclear track-based biosensors with the enzyme laccase[J]. Applied Surface Science, 2014, 310: 66-76. DOI:10.1016/j.apsusc.2014.03.074 |
| [91] |
Casero E, Petit-Domínguez MD, Vázquez L, et al. Laccase biosensors based on different enzyme immobilization strategies for phenolic compounds determination[J]. Talanta, 2013, 115: 401-408. DOI:10.1016/j.talanta.2013.05.045 |
| [92] |
陈玲. 生物传感器的研究进展综述[J]. 传感器与微系统, 2006, 25(9): 4-7. |
| [93] |
Liu J, Niu J, Yin L, et al. In situ encapsulation of laccase in nanofibers by electrospinning for development of enzyme biosensors for chlorophenol monitoring[J]. Analyst, 2011, 136(22): 4802-4808. DOI:10.1039/c1an15649g |
| [94] |
曹治云, 郑腾, 谢必峰, 等. 漆酶在生物检测中的应用进展[J]. 传感器技术, 2004, 23(8): 1-3. |
| [95] |
Riffaldi R, Levi-Minzi R, Cardelli R, et al. Soil biological activities in monitoring the bioremediation of diesel oil-contaminated soil[J]. Water, Air, & Soil Pollution, 2006, 170(1): 3-15. |
| [96] |
宁娜, 谭慧军, 孙新新, 等. 真核生物来源漆酶的异源表达研究进展[J]. 生物工程学报, 2017, 33(4): 565-577. |