2. 河南师范大学水产学院,新乡 453007
2. College of Aquaculture, Henan Normal University, Xinxiang 453007
我国年产秸秆总量位居世界第一,但由于缺少有效的技术手段,导致这一生物资源的严重浪费,同时也污染环境[1-2]。秸秆的主要成分是纤维,主要集中于细胞壁,细胞壁含量占70%以上,由纤维素、半纤维素和木质素组成;其中纤维素、半纤维素可在牛羊的瘤胃中被纤维分解菌酸解,生成挥发性脂肪酸,如乙酸、丙酸、丁酸等,被牛羊吸收作为能源利用[3-5]。已有研究表明这类物质的有机物消化率很低,一般牛羊很少超过50%[6]。因此要提高秸秆的吸收利用率,对木质素的降解已是重中之重。
在众多秸秆处理的方法中,微生物降解有着独特的优势。木质素的完全降解是真菌、细菌、微生物群落共同作用的结果,其中真菌起着重要的作用。在降解秸秆木质素方面主要包括三类酶,漆酶(Laccase)、木质素过氧化物酶(Lignin peroxidase)、锰过氧化物酶(Manganese peroxidase),目前研究最多的是真菌漆酶[7]。漆酶是一种多铜氧化酶,可以氧化分解木质素中的酚类物质,近年来,对漆酶的研究也越来越多,并已经取得了显著的结果,在环境保护、造纸、食品等行业中也变现出极大的研究价值和应用潜力[8-9]。尽管漆酶的研究已经取得一定的进展,但自然界中漆酶的产量较少,目前国内对产漆酶的菌种培养研究还处于起步阶段[10],因此利用分子生物学方法研究漆酶基因并制备表达漆酶的工程菌,对实现漆酶的大规模生产和漆酶在各行业应用具有重要的意义[11]。
漆酶在造纸、环保、能源及食品等领域极富利用价值[12],目前漆酶的发酵主要来自于真菌,但工业化生产却较难实现,究其原因,主要是因为易污染、酶活不稳定且活力相对较低所致[13-15]。此外,大部分真菌漆酶只有在中温且弱酸条件下才能表现出较高的催化活性,限制了真菌漆酶在某些工业领域的应用[16-17]。因此,通过克隆性质优良的新型漆酶基因,构建高效异源表达载体及蛋白质改造等,是解决漆酶资源短缺、增强酶在较高温度下的稳定性及在碱性条件下的高催化活性的重要途径[18-19]。
人们对漆酶基因的克隆研究也有近百年的历史,虽然很多学者克隆出不少漆酶基因,也都在酵母和大肠杆菌等表达体系中进行表达,但表达分泌均较弱,到现在为止并没有可以应用于大规模生产的工程菌[20]。究其原因,可能在于未获得酶活较高菌株作为克隆模板,表达稳定性差等[21-22]。课题组前期研究了黄孢原毛平革菌Phanerochaete chrysosporium产漆酶的生化性质和生产性能。该菌株与报道过的其他菌株相比,酶活力高,降解性能较好,同时产酶的条件也好控制,为研究漆酶基因的克隆表达和漆酶的纯化奠定了基础,对构建好的工程菌产生的漆酶进行了分离纯化和酶学性质研究,为后续运用蛋白质工程的方法改造酶的催化活力和稳定性奠定了基础。
1 材料与方法 1.1 材料 1.1.1 菌株黄孢原毛平革菌Phanerochaete chrysosporium由河南师范大学生命科学学院从菌肥中分离获得,大肠杆菌Escherichia coli BL21(DE3)由本实验保存,pET24a载体,来自上海生工公司。
1.1.2 工具酶与其他试剂限制性内切酶Nde Ⅰ、Xho Ⅰ、T4 DNA连接酶、Taq DNA聚合酶购自TaKaRa公司;小提质粒试剂盒及胶回收试剂盒购自TaKaRa;卡那霉素购于Ameresco公司;IPTG购自Merck公司;丙烯酰胺(Acr)及甲叉双丙烯酰胺(Bis)购自Promega公司;引物合成和克隆质粒测序由上海英骏生物工程公司完成;其余试剂均为国产分析纯。
1.2 方法 1.2.1 白腐真菌漆酶基因的克隆及序列分析根据根据NCBI中公布的白腐真菌的漆酶的基因序列(GenBank:AY225437.1),应用NCBI-Blast进行保守结构域分析,表明该基因有3个保守的结构域:即Cu-oxidase_3、Sufl和CuRO_2_MCO_like_1。其中Sufl是多铜氧化酶三蛋白结构域,与细胞周期调控、细胞分裂、染色体分离、无机离子转运与代谢有关;第二个是Cu-oxidase_3的结构域,这项包含许多不同的铜氧化酶样结构域;第3个是CuRO_2_MCO_like_1的结构域,包含未知的多铜氧化酶二蛋白结构域;根据该基因的基因组序列和PET24a表达载体的MCS位点,设计特异性PCR primers为:
Lac-F1:5'-CATATCCATATGCTGTTTGCCCTGCTGGCCCTG-3';
Lac-R1:5'-AATCACCTCGAGTGCGGCGCTG CACATATTTG-3'。
其中F1中含有Nde Ⅰ酶切位点;R1中含有Xho Ⅰ酶切位点。提取黄孢原毛平革菌总DNA为模板,PCR扩增条件为94℃,5 min预变性;94℃,1 min,58℃;30 s,72℃,2 min;29个循环;72℃延伸10 min。所得片段胶回收后与克隆载体pET24a载体连接,转化E. coli BL21(DE3),挑取阳性转化子,提取质粒酶切鉴定后测序,测序由上海生工公司完成。
1.2.2 大肠杆菌表达载体的构建及漆酶基因的诱导表达将克隆好的漆酶基因用Nde I和Xho I进行双酶切,胶回收漆酶基因片段,将其与经相同酶切线性化的pET24a(+)载体连接,并将其转化大肠杆菌E. coli BL21(DE3),筛选出阳性转化子。酶切验证正确后,挑选阳性转化子接种于含50 μg/ml Kan的4 ml LB培养液的试管中,37℃ 220 r/min摇过夜并冻存;次日按1:100接种于50 μg/ml Kan的30 mL LB培养液中,37℃ 220 r/min振摇至菌体OD600为0.4(约2 h);取出1 mL培养物,12 000 r/min室温离心2 min,弃上清,用100 μL 1×上样缓冲液重悬菌体沉淀;向剩余的培养物中加入IPTG至终浓度为0.5 mmol/L,25℃ 220 r/min振摇5 h,诱导CPE融合蛋白表达;取出1 mL培养物,12 000 ×g室温离心2 min,弃上清,用100 μL 1×上样缓冲液重悬菌体沉淀,剩余培养物4℃ 4 000×g离心12 min,弃上清,沉淀置-20℃冻存。
1.2.3 SDS-PAGE确定表达产物的分布分别取10 μL经诱导的重组菌的上清及沉淀物,利用10% SDS-PAGE进行电泳分离,电压130 V,考马斯亮蓝R250染色显带,Gel Doc2000成像系统分析。
1.2.4 漆酶融合蛋白的纯化将过夜诱导表达的菌液于12 000 r/min,4℃离心15 min,收集菌体,采用超声波细胞破碎法,用pH7.4 PBS缓冲液悬浮菌体,经0.45 μm滤膜过滤后上柱,经Ni-IDA-Sepharose CL-6B亲和层析柱纯化得到纯化后的漆酶蛋白,收集流出液,进行12% SDS-PAGE分析。
1.2.5 表达产物的Western blotting鉴定收集不同诱导表达时间的表达产物100 μL,加入100 μL 2×Sample Buffer重悬,开水煮沸5 min。各取10 μL上样进行10% SDS-PAGE电泳。然后以半干法电转移至硝酸纤维素膜上,取下硝酸纤维素膜利用TBST缓冲液短暂漂洗后经5%光明脱脂奶粉室温封闭l h,再用TBST漂洗3次后,与His-Tag单抗孵育过夜,次日TBST漂洗3次后,与IRDye800标记的羊抗鼠IgG孵育l h,最后TBST 3次洗膜经Odyssey红外激光成像系统扫描实验结果。
2 结果 2.1 漆酶基因的克隆及分析提取黄孢原毛平革菌基因组DNA,用Lac-F1和Lac-R1引物进行扩增,连接pET24a载体后,测序得到长度为1 680 bp的基因内部片段,将其命名为lac1680(图 1)。测得扩增获得的基因lac1680核苷酸序列与GenBank公布的漆酶基因的全基因组核苷酸序列(GenBank:AY225437.1)同源性达98%。

|
| 图 1 漆酶基因核苷酸序列以及推导的氨基序列 |
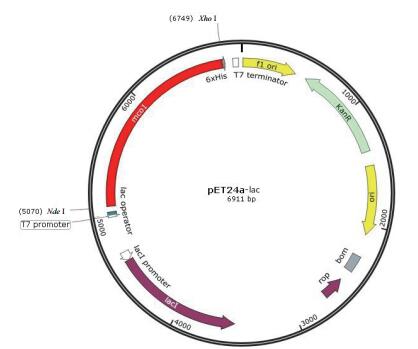
根据载体序列和lac基因的序列最终构建成完整的全质粒图谱,lac基因通过Nde I和Xho I两个酶切位点插入到PET24a-lac里面全质粒图谱如图 2所示。
|
| 图 2 pET24a质粒图谱 |
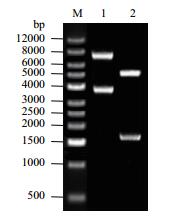
提取质粒后,用Nde I和Xho I进行双酶切。如图 3所示,在2号泳道出现1 600 bp左右和5 000 bp左右的片段,其中较小条带与目的条带相似,较大条带为质粒载体,说明表达载体连接成功。
|
| 图 3 pET24a-lac重组表达质粒双酶切验证的琼脂糖凝胶电泳 1:pET24a-lac重组质粒;2:pET24a-lac重组质粒Xba I-Xho I双酶切验证;M:DNA Marker |
将重组质粒转化至大肠杆菌进行诱导表达,结果如图 4所示,经IPTG诱导的泳道出现了一条大小约75 kD的蛋白条带,而未诱导的没有条带,进而说明诱导表达成功。

|
| 图 4 pET24a-lac-BL21(DE3)重组菌预表达的全菌裂解物SDS-PAGE检测 1:pET24a-lac-BL21(DE3)重组菌未诱导对照;2:pET24a-lac-BL21(DE3)重组菌经IPTG诱导后;M:预染蛋白分子量标准 |
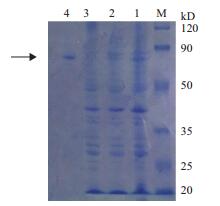
通过SDS-PAGE检测纯化后的蛋白,结果如图 5所示,4号泳道明显呈现出一条与目的蛋白大小一致的单一蛋白条带,几乎看不到任何杂带,说明纯化效果良好。
|
| 图 5 SDS-PAGE检测纯化的lac-c-His6蛋白 1:pET24a-lac-BL21(DE3)重组菌放大诱导后全菌;2:pET24a-lac-BL21(DE3)重组菌放大诱导破碎后上清;3:上样流出液;4:纯化洗脱下来的lac-c-His6蛋白;M:预染蛋白分子量标准 |
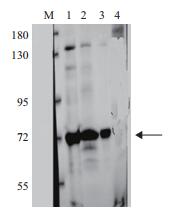
利用Western blotting技术,进一步验证漆酶蛋白的可靠性。结果如图 6所示,4号未经诱导的菌株在目的位置没有条带;相反,无论洗脱纯化后还是浓缩后的溶液中均出现了目的条带,从而证明该条带即为诱导纯化后的漆酶蛋白。
|
| 图 6 WB验证lac-c-His6蛋白(用His的抗体) 1:pET24a-lac-BL21(DE3)重组菌放大诱导破碎后上清;2:浓缩的lac-c-His6蛋白;3:纯化洗脱下来的lac-c-His6蛋白;4:阴性对照(未诱导的pET24a-lac-BL21(DE3)重组菌);M:预染蛋白分 |
为了解重组菌的产酶活力,以野生型黄孢原毛平革菌为对照,比较了不同时间两株菌的产酶活力。结果显示,二者酶活力都是随着培养时间的增加而增加,其中野生菌株菌株在第6天达到最大值(图 7-A),构建好的工程菌株活力在第48小时即可达到最大值(图 7-B),产酶时间大大缩短。此外,收集了菌株产酶能力最高时的细胞悬液,经细胞破碎后,通过SDS-PAGE分析表明,构建好的工程菌在蛋白水平上比原野生型菌株有了明显的提高,而且其酶活力比野生菌株提高了近39%。
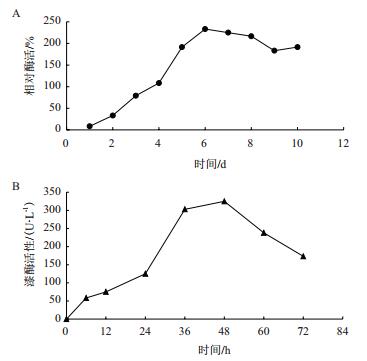
|
| 图 7 黄孢原毛平革菌(A)和工程菌(B)产漆酶能力折线图 |
决定生物学功能的潜在因素是基因的分子特征,本研究前期对黄孢原毛平革菌漆酶基因进行了载体的构建,成功克隆了黄孢原毛平革菌漆酶基因的cds区。序列分析表明,lac1680基因编码的漆酶蛋白具有3个保守的结构域,通过与其它已报道的漆酶的保守结构相比较,经PCR扩增、SDS-PAGE及Western blotting双重验证,证实了我们所筛选得到的阳性转化子表达的重组蛋白能够被分泌,同时明确证实了基因lac1680能够编码分泌漆酶蛋白。
与目前国际上所采用的漆酶基因的克隆方法而言,传统基因克隆一般采用探针杂交来获得其全长的cDNA序列,也有运用RACE技术进行克隆基因的例子,但其最终目的都是为了提高漆酶基因的表达量,或者是提高漆酶活性。近年来对菌株产酶条件、降解条件的优化、漆酶载体的研究仍是研究热点,例如邓寒梅等[23]通过对固定化漆酶载体的研究来提高酶活性,张雪玲等[24]对漆酶Lac1338的酶学特性测定分析酶解染料影响。大肠杆菌重组菌具有生长快速、分泌能力强、易工业化生产等优点,虽然也有构建失败的事例[25],但迄今为止还是被人们认为是最具市场前景的前沿技术[26-27]。如杨建强等将野生革耳来源的漆酶基因在大肠杆菌中表达,得到可溶性漆酶蛋白,在可溶性漆酶蛋白中添加CuSO4并在室温下孵育复性,获得有活性的漆酶。
通过对比工程菌与野生型菌株所产生的粗酶液,酶的比活力相差不大,只是酶活力有所提高,这可能与该漆酶基因来自与同一物种有关,同时检测重组蛋白所处的环境对酶活性也有一定的影响,后续将对构建好的工程菌酶学性质进行研究。未来在加强分子生物学和基因工程方面的研究,实现高效的异源表达,更加详细的了解其功能,将其应用于实践生产[28]。
4 结论本研究以先前筛选到的高产漆酶的黄孢原毛平革菌为模板,利用同源克隆技术合成一个全长为1 680 bp的漆酶基因,将该基因连接到构建好的pET-24a载体上,并转入大肠杆菌中,通过诱导表达,获得漆酶蛋白。经过SDS-PAGE及Western Blotting双重验证,充分证明了我们得到的就是诱导纯化后的漆酶,初步建立起漆酶基因的异源表达及重组蛋白纯化体系。通过对比基因工程菌和野生型菌株在不同培养时间段内的酶活力,结果表明,构建好的工程菌活力比原菌酶活力提高了39%。
| [1] |
Heikinheimo L, Suominen P, Suominen P, et al. Treating denim fabrics with Trichoderma reesei cellulases[J]. Textile Research Journal, 2000, 70(11): 969-973. DOI:10.1177/004051750007001106 |
| [2] |
谢长校, 孙建中, 李成林, 等. 细菌降解木质素研究进展[J]. 微生物学通报, 2015, 42(6): 1122-1132. |
| [3] |
李彬, 陈向楠, 张建法, 等. 产胞外多糖菌株的筛选及胞外多糖结构分析[J]. 生物技术通报, 2016, 32(5): 165-171. |
| [4] |
曹文娟, 袁海生. 桦褶孔菌漆酶固定化及其对染料的降解[J]. 菌物学报, 2016, 35(3): 343-354. |
| [5] |
甄静, 李冠杰, 李伟, 等. 毛栓孔菌XYG422菌株产漆酶发酵条件优化及对玉米秸秆生物降解的研究[J]. 菌物学报, 2017, 36(6): 718-729. |
| [6] |
魏炳栋, 邱玉朗, 陈群, 等. 发酵玉米秸秆对育肥羊生长性能、营养物质消化率及甲烷排放的影响[J]. 中国畜牧兽医, 2016, 43(12): 3200-3205. |
| [7] |
Dittmer JK, Patel NJ, Dhawale SW, et al. Production of multiple laccase isoforms by Phanerochaete chrysosporium grown under nutrient sufficiency[J]. FEMS Microbiol Lett, 1997, 149(1): 65-70. |
| [8] |
张泽雄, 刘红艳, 邢贺, 等. 漆酶可降解底物种类的研究进展[J]. 生物技术通报, 2017, 33(10): 97-102. |
| [9] |
刘家扬, 蔡宇杰, 廖祥儒, 等. 漆酶高产菌的筛选及产酶优化[J]. 食品与机械, 2010, 74(26): 15-16. |
| [10] |
司静, 崔宝凯, 贺帅, 等. 微酸多年卧孔菌产漆酶条件优化及其在染料脱色中的应用[J]. 应用与环境生物学报, 2011, 17(5): 736-741. |
| [11] |
司静, 李伟, 崔宝凯, 等. 真菌漆酶性质、分子生物学及其应用研究进展[J]. 生物技术通报, 2011(2): 48-55. |
| [12] |
曹文娟, 袁海生. 桦褶孔菌漆酶固定化及其对染料的降解[J]. 菌物学报, 2016, 35(3): 343-354. |
| [13] |
Giardina P, Faraco V, Pezzella C, et al. Laccases: a never-ending story[J]. Cellular and Molecular Life Sciences, 2010, 67(3): 369-385. DOI:10.1007/s00018-009-0169-1 |
| [14] |
Rodgers CJ, Blanford CF, Giddens SR, et al. Designer laccases: a vogue for high-potential fungal enzymes[J]. Trends in Biotechnology, 2010, 28(2): 63-72. DOI:10.1016/j.tibtech.2009.11.001 |
| [15] |
Maestre-Reyna M, Liu WC, Jeng WY, et al. Structural and functional roles of glycosylation in fungal laccase from Lentinus sp[J]. PLoS One, 2015, 10(4): e0120601. DOI:10.1371/journal.pone.0120601 |
| [16] |
梁倩倩, 魏生龙, 席亚丽, 焦扬. 响应面法优化荷叶离褶伞菌丝体产漆酶条件[J]. 菌物学报, 2016, 35(3): 335-342. |
| [17] |
刘冬忍, 田芳, 王小飞, 等. 启动子替代构建糙皮侧耳漆酶高产菌株[J]. 菌物学报, 2016, 35(5): 597-604. |
| [18] |
余小霞, 刘晓青, 田健, 等. 来源于枯草芽孢杆菌的漆酶cotA基因克隆与表达及其酶学性质的研究[J]. 中国农业科技学报, 2015, 17(1): 102-108. |
| [19] |
Pardo I, Vicente AI, Mate DM, et al. Development of chimeric laccases by directed evolution[J]. Biotechnol Bioeng, 2012, 109(12): 2978-2986. DOI:10.1002/bit.v109.12 |
| [20] |
Shekher R, Sehgal S, Kamthania M, et al. Laccase: microbial sources, production, purification, and potential biotechnological applications[J]. Enzyme Research, 2011. DOI:10.4061/2011/217861 |
| [21] |
甄静, 李冠杰, 李伟, 等. 毛栓孔菌XYG422菌株产漆酶发酵条件优化及对玉米秸秆生物降解的研究[J]. 菌物学报, 2017, 36(6): 718-729. |
| [22] |
郑飞, 孟歌, 安琪, 等. 白腐真菌东方栓孔菌在两种液体培养基中产漆酶过程的生理学研究[J]. 菌物学报, 2017, 36(5): 582-597. |
| [23] |
邓寒梅, 邵可, 梁家豪, 等. 漆酶的来源及固定化漆酶载体研究进展[J]. 生物技术通报, 2017, 33(6): 10-15. |
| [24] |
张雪玲, 陈小利, 李荷. 漆酶Lac1338的酶学特性测定及定向突变对其酶解染料影响[J]. 生物技术通报, 2016, 32(7): 170-177. |
| [25] |
高健, 关可兴, 焦晶, 等. 细菌漆酶的结构、催化性能及其应用[J]. 分子催化, 2014, 28(2): 188-196. |
| [26] |
秦澎, 辜运富, 曾先富, 向泉桔. 香菇漆酶高产菌株筛选及漆酶基因的表达研究[J]. 菌物学报, 2017, 36(9): 1243-1250. |
| [27] |
司静, 崔宝凯, 戴玉成. 栓孔菌属漆酶高产菌株的初步筛选及其产酶条件的优化[J]. 微生物学通报, 2011, 38(3): 405-416. |
| [28] |
闵华, 周晓舟, 林贤普, 等. 高效利用木质素、半纤维素的草菇菌株初筛试验[J]. 安徽农业科学, 2008, 36(23): 9947-9948. DOI:10.3969/j.issn.0517-6611.2008.23.055 |




