2. 东华理工大学省部共建核资源与环境国家重点实验室培育基地,南昌 330013
2. State Key Laboratory Brecding base of Nuclear Resoures and Environment, East China University of Tehnology, Nanchang 330013
霉菌是一种广泛存在于自然界中的多细胞微生物,是丝状真菌的统称,可分为毛霉属、根霉属、曲霉属、木霉属和青霉属等几大类。近几年内在工业方面占有重要地位。除生产淀粉酶、酸性蛋白酶、木聚糖酶、植酸酶[1-2]等超过30种酶制剂外,还生产有机酸(如柠檬酸[3]、葡萄糖酸和没食子酸等)及抗生素等,以及各种传统食品(如酱油、酿酒和制醋等),并且在污水处理等方面都有涉及。因此霉菌是一类很有经济价值的微生物。
近年,随着环境友好的生物冶金技术的深度发展,人们认识到已被广泛应用的自养型铁/硫氧化微生物在非硫化矿浸出中的局限性,与此同时,生产有机酸的霉菌进入生物冶金研究者的视野。有研究表明部分霉菌生长过程中生产的有机酸可与矿物中的有用金属形成可溶性络合物,从而将其从矿石中浸出,可作用于硫化矿物的浸出[4],也适用于氧化矿物、磷酸盐矿物的浸出,且有机酸基本属于弱酸,对环境的影响小,同时这些有机酸可被自然界中的微生物分解,有利于环保。王永东[5]等就曾利用黑曲霉浸出某铀矿,刁宁宁[6]等研究了黑曲霉发酵液浸出高碱性氧化铜尾矿。与其他浸矿方法相比,开发应用霉菌浸出具有一定发展前景,而从溶浸体系中分离适合冶金的霉菌菌株则是首要工作。
本研究从新疆某铀矿酸性浸出液分离得到一株霉菌,本实验中命名为MJ 5,一方面为霉菌浸出铀矿做菌种储备,另一方面为开展耐酸的霉菌胞外酶研究做准备。本研究结合形态学特征、rDNA ITS序列分析以及Biolog鉴定系统对这株霉菌进行鉴定,通过构建系统进化树得出亲缘关系,通过碳源代谢分析了解该菌的生长情况及优势碳源,为后续的优化培育等实验提供有用的参考。
1 材料与方法 1.1 材料 1.1.1 菌株来自常年15-18℃新疆某铀矿矿层、深度为328-335 m之间酸性浸出溶液中分离的霉菌,该浸出液pH为1.82,铀浓度为65 mg/L。
1.1.2 培养基2%麦芽汁培养基:2%麦芽汁,2%琼脂,冷却后调整pH值至5.5±0.2(28℃),于1×105 Pa灭菌20 min;Dox培养基(g/L):NaNO3 2.0,KH2PO4 1.0,MgSO4 ·7H2O 0.5,KCl 0.5,FeSO4·5H2O微量,蔗糖30.0,酵母提取物0.5%,琼脂粉20.0,倒平板时加入0.5 mL溴甲酚紫指示剂。
1.2 方法 1.2.1 菌株的分离、纯化与保存分离与纯化:用灭菌后的涂布棒将100 μL适当处理的铀矿酸性浸出液均匀涂布于固体培养基的平板上,倒置放于30℃恒温培养箱中进行培养,待固体培养基上长出菌落时,用接种环挑取少量菌丝在平板上进行划线分离。反复3次以获得微生物纯种,将获得的纯种单菌落挑取至100 mL液体培养基,放入摇床30℃,150 r/min进行培养。保存:将分离出的真菌进行平板划线,并置于恒温培养箱中培养,直至菌丝顶端产生孢子后(3 d),在洁净工作台内将灭菌的棉签(或接种环)用含1%Tween-20的灭菌双蒸水沾湿,轻轻刮取孢子,尽量避免沾染菌丝,将刮取的孢子洗脱到含2 mL灭菌培养基的离心管中洗脱,震荡5 min,过滤,去除菌体,从而制得孢子悬液,取500 μL孢子悬液至1.5 mL的保种管中,加入灭菌的20%甘油500 μL,将保种管置于-80℃冰箱中保存。
1.2.2 菌体的形态学观察固体平板划线分离的纯菌株经过48 h恒温培养后,挑取少量菌丝于载玻片上,用0.5%的品红染色液进行简单染色,加盖玻片后用光学显微镜进行显微观察。
1.2.3 rDNA ITS序列以及进化树的构建 1.2.3.1 样品预处理将100 mg纯化后的菌体重悬于1 mL TE(pH8.0)中,反复吹打均匀,将菌体培养基残液洗去,12 000 r/min,常温,离心10 min,去除上清液,反复几次使上清pH大于7.5,菌体可直接使用或保存于-80℃冰柜,作为总DNA的提取材料。
利用Ezup柱式真菌基因组DNA抽提试剂盒(上海生工,B518259)提取霉菌DNA,收集的产物可用1%琼脂糖凝胶电泳验证。
1.2.3.2 菌株的基因组序列测定实验扩增选用以下ITS系列[7]引物:
ITS 1:5'-TCCGTAGGTGAACCTGCGG-3',
ITS 4:5'-TCCTCCGCTTATTGATATGC-3'。
以总DNA模板进行PCR扩增,总体积为25 μL,PCR扩增反应体系为:18.3 μL的双蒸水,2.5 μL 10×Extaq Buffer,2.0 μL dNTP(2.5 mmol/L),引物ITS1(20 μmol/L)和ITS4(20 μmol/L)各0.5 μL,0.2 μL Extaq酶,1 μL模板DNA。
PCR反应程序:94℃预热处理4 min;94℃变性1 min,55℃退火45 s,72℃延伸90 s,32个循环;72℃延伸10 min。PCR产物用1%的琼脂糖凝胶验证后,通过离心柱型琼脂糖凝胶DNA回收试剂盒DP209切胶回收,回收产物送生物工程(上海)股份有限公司测序。
1.2.3.3 MEGA 5[8]软件构建系统进化树测序结果在NCBI网站进行同源性序列比对,并且利用MEGA 5软件构建系统进化树。
1.2.4 Biolog鉴定系统(美国Biolog公司)在Bio-log FF鉴定板培养24 h、48 h、72 h、96 h和120 h时,分别放置到Biolog菌种鉴定仪上,读取不同孔的OD490与OD750值。利用Excel 2016和OriginPro8.0对菌株利用不同碳源的吸光值Ci进行均值统计分析。
利用碳源的平均活性:菌株利用碳源的能力,可用平均吸光值(Average well color development,AWCD[9])表示,通过计算和绘制菌株的AWCD值随时间的变化,得到菌株利用碳源的平均活性。AWCD计算公式:AWCD=[Σ(Ci-R)]/n。其中,Ci是除对照孔外各孔吸光度值,R是板内对照孔吸光度值,n为碳源数量,本研究中n为95[10]。绘制AWCD随时间变化的曲线,得出碳源利用情况。
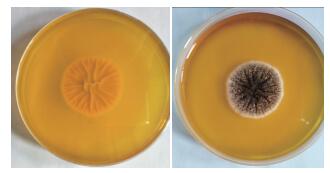
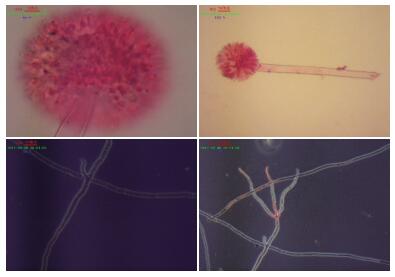
2 结果 2.1 平板单菌落以及在光学显微镜下的形态特征观察从图 1中单菌落平板可知,菌丛黑褐色,菌丝为白色,背面呈现褶皱状,嗅甲酚紫是一种酸碱指示剂,在酸性环境下由紫色变黄色。图 1中为加入该指示剂的平板,并且很明显看出颜色变为黄色,说明MJ 5具有一定的产酸能力。由图 2可看出分生孢子梗从壁厚而膨大的菌丝细胞垂直生出,菌丝有隔膜,光滑,上部较粗大,顶端膨大成球形的泡囊,从泡囊的全部表面以放射状生出小梗分生孢子串生于小梗顶端,呈柱形辐射状,分生孢子穗为黑色;并且可以很明显看出菌丝内有隔膜,被隔膜隔开的一段菌丝成一个细胞,菌丝体由很多细胞组成,菌丝发达,多分枝,有多核的多细胞真菌,小梗双层。通过查阅真菌鉴定手册[11]初步确定为丛梗孢科,曲霉属。
|
| 图 1 MJ 5在Dox固体平板上培养72 h后的单菌落形态 |
|
| 图 2 MJ 5在Dox固体平板培养基培养48 h后的形态 |
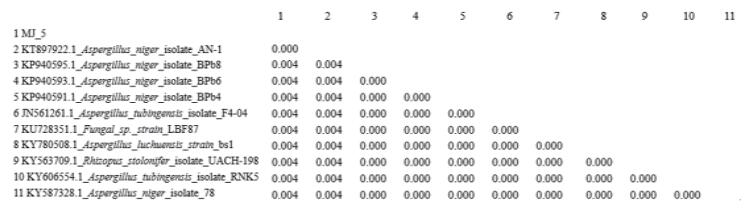
根据生工生物工程(上海)股份有限公司测序结果,在NCBI网站内进行同源序列比对,并通过比对结果经MEGA 5软件构建系统进化树以及进化距离矩阵数据,结果显示菌株(MJ 5)与Aspergillus niger AN-1的相似度达99%,并由如图 3和图 4可看出菌株与Aspergillus niger AN-1位于同一分支。

|
| 图 3 以rDNA ITS基因序列为分子标记的霉菌菌株系统进化树 |
|
| 图 4 以rDNA ITS基因序列为分子标记的霉菌菌株进化距离矩阵数据 |
Biolog鉴定系统每个显示的结果均含有3种重要的参数,即可能性Probability(PROB),相似性Similarity(SIM)和位距Distance(DIS)。SIM和DIS是最重要的2个值,SIM值表示测试结果与数据库相应数据条的相似程度,DIS值表示测试结果与数据库相应数据条的位距。Biolog系统规定:丝状真菌培养24 h时SIM值≥ 0.9,培养48 h时SIM值≥ 0.70,培养76 h时SIM值≥ 0.65,培养96 h时SIM值≥ 0.60,系统会自动给出较为可靠的鉴定结果,SIM值越接近1.00,鉴定结果的可靠性越高[12]。
Biolog FF鉴定板培育第4天时,系统显示出3个理想重要参数,SIM值=0.695>0.60,DIST值=4.477 < 5.0,PROB值=0.985,接近于1,与数据库有一个良好的匹配,初步鉴定菌株为黑曲霉(Aspergillus niger)。
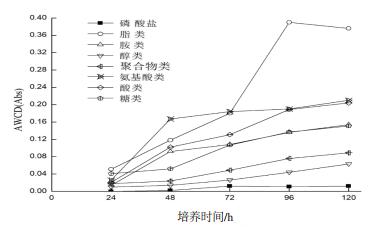
2.3.1 霉菌对不同碳源的利用情况为了解菌株对于不同碳源的利用情况,将95种碳源划分为8类,即糖类、酸类、氨基酸类、聚合物类、醇类、胺类、磷酸盐、脂类[13]。通过计算每类碳源的AWCD值来知道霉菌利用情况,如图 5所示。
|
| 图 5 霉菌对8类碳源的利用结果 |
由图 5可知,霉菌最初对氨基酸类、脂类、酸类的使用情况较于其他碳源的情况要高一些,磷酸盐的利用一直处于一个较平稳且利用率较低的状态。并且从图 5中可看出菌株在每个时期对于碳源的利用情况不用,96 h前,对于8类碳源的吸收处于上升期,到120 h后,聚合物类、糖类以及胺类的吸收基本到达稳定期,而脂类的利用则显现下滑,对碳源的利用随着时间的变化而改变,由此可知,菌种不同的生长阶段都会影响对碳源的利用,并且该菌对酸类碳源的利用率排在前几位,说明在一定的酸性环境下菌株也能正常生长,而且其活性相较于其他类碳源高。
2.3.2 霉菌优先利用的15种碳源通过95种不同碳源的比较,从中挑选出利用率较好的15种碳源,以此来了解霉菌对于碳源的消耗情况,如图 6所示。
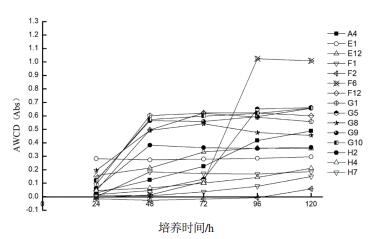
|
| 图 6 霉菌对15种碳源的利用情况 A4:N-乙酰基-β-D-葡萄糖胺;E1:D-核糖;E12:D-木糖;F1:y-氨基丁酸;F2:溴代琥珀酸;F6:P-羟苯乙酸;F12:奎尼酸;G1:D-葡萄糖二酸;G5:琥珀酸甲基酯;G8:L-丙氨酸;G9:L-丙氨酰胺基乙酸;G10:L-天冬酰胺;H2:鸟氨酸;H4:脯氨酸;H7:L-苏氨酸 |
从图 6中可以看出该菌株对P-羟苯乙酸的利用率最高,但是在72 h前需求量并不大,在后期利用率提高并趋于平稳,P-羟苯乙酸的pH一般在2.0-2.4之间,说明在低pH的环境下,该菌株可以存活,并且后期生长迅速,由此可认为菌株具有一定的耐酸性,其次为琥珀酸甲基酯、L-丙氨酰胺基乙酸、L-天冬酰胺,这几种碳源在48 h前呈直线上升,48 h左右达到最高并稳定,而D-核糖的消耗率一直处于一个平稳的状态,其他碳源的利用在72-96 h左右达到最高,随后基本保持稳定。
3 讨论形态学观察主要利用显微镜对菌丝的特征,子实体的形态(如孢子囊等的形态),孢子的形态(如孢囊孢子、分生孢子等)。据资料显示rDNA基因内转录区间(Internal transcribed spacer,ITS)具有变异性强和分化程度高的特性,可利用不同物种间或相同物种的不同菌株间可能存在的差异为依据,反映出生物的亲缘关系及分类关系,被广泛应用于真菌的鉴定、分类与种属间系统学研究[14]。由于基因库的完善程度、高度同源性序列的多少以及具体物种ITS区可变程度等因素的影响[15],在运用ITS序菌种鉴定时可与其他鉴定方法相结合,提高鉴定结果的可信度。碳源代谢分析主要是通过菌株对Biolog微孔鉴定板上95种不同碳源的利用情况,通过计算平均吸光值(AWCD)了解霉菌的生长情况以及各类碳源的消耗量,运用数据分析霉菌的碳源利用情况。同时该系统可针对于丝状真菌对不同碳源代谢率的差异,通过检测微生物细胞利用不同碳源进行新陈代谢过程中产生的氧化还原酶与显色物质发生反应而导致的颜色变化(吸光度)以及由于微生物生长造成的浊度差异(浊度),可与标准菌株数据库进行比对,并得出一个鉴定结果[16-17]。
从霉菌的形态观察中,可大致推断该菌株为丛梗孢科,曲霉属,通过Biolog鉴定系统可知该菌株为黑曲霉,同时rDNA ITS序列的测序结果Blast数据比对与Aspergillus niger AN-1的相似度达99%,综上所述可确定从铀矿酸性浸出液分离纯化得到的菌株为黑曲霉。
形态学观察可知菌体的大致外形以及结构,但是并不能确定具体的种类,通过rDNA ITS序列进化速率相对较快,可以提供较丰富的变异位点和信息位点,得到菌株具体的信息,但是由于同源性等因素限制,且操作过程繁琐,有时需与其他鉴定手段相结合,可提高鉴定准确度,Biolog鉴定系统不仅可了解菌株的碳源代谢情况,同时还可知菌株的生长情况,操作简便,鉴定速度快,但是相对于其他鉴定方法Biolog鉴定系统对菌种库收录的范围较窄,有很多菌种名并没有被扩充进去,因此,结合以上3种鉴定手段,不仅增加可信度还可以通过分析来了解菌株的碳源代谢,为后续菌体的研究提供有用的参考价值。
通过Biolog鉴定系统对霉菌碳代谢特征研究得知,菌株在不同阶段对碳源的消耗量以及通过比较可以了解菌株对不同碳源的利用率,以便设计出最适培养基,在生长过程中较先利用的碳源是氨基酸类、脂类、酸类,由图 4可看出菌株对P-羟苯乙酸的利用率最高,从不同碳源利用情况可知,菌种对碳源的利用随生长时间的变化而改变,菌种的来源以及不同生长阶段都会影响对碳源的利用,而且根据图 4和图 5可推断菌株对酸具有一定的耐受性,在一定环境下能以酸性碳源为能源,并且后期生长比其他多数碳源迅速。在培养过程中发现该菌株的pH可以降至1.9-2.0之间,有机酸产量较高,在起始pH为2.5到2.0的培养基中依然可以存活,对酸的适应程度较高,根据谭媛[18]等对黑曲霉浸矿效果的研究,说明黑曲霉可适用于微生物浸矿方面。有些资料显示真菌最适碳源利用为D-阿拉伯糖、L-阿拉伯糖和D-果糖等[19]大部分糖类,但是本文中利用率较高的为氨基酸类、脂类、酸类,造成两者差异可能是由于菌株长期生长在一定的环境下,对周围环境产生一定的适应性,并改变其生存的条件,因此,不同的环境可能会导致菌株代谢之间的差别。
4 结论从新疆十红滩某铀矿酸性浸出液中分离得到1株霉菌,经分子生物学、形态生物学观察以及Biolog鉴定系统3种方法相结合鉴定该菌株为黑曲霉(Aspergillus niger)。菌株可产有机酸;对在培育96 h后对碳源的利用情况基本稳定,其中利用率最高的为P-羟苯乙酸,说明该菌株具有一定耐酸性。
| [1] |
Grimm LH, Kelly S, Krull R, et al. Morphology and pro-ductivity of filamentous fungi[J]. Applied Microbiologyand Biotechnology, 2005, 69(4): 375-384. DOI:10.1007/s00253-005-0213-5 |
| [2] |
李文, 王陶, 李同祥. 氯化锂诱变黑曲霉原生质体选育高产植酸酶菌株[J]. 食品与发酵工业, 2012, 38(2): 69-73. |
| [3] |
Sun JB, Lu X, Rinas U, et al. Metabolic peculiarities of Aspergillus niger disclosed by comparative metabolic genomics[J]. Genome Biol, 2007, 8(9): R182. DOI:10.1186/gb-2007-8-9-r182 |
| [4] |
王永东, 李广悦, 丁德馨, 等. 黑曲霉产有机酸浸出铀矿石的影响因素[J]. 化工学报, 2012, 63(5): 1584-1591. |
| [5] |
王永东. 浸铀异养微生物的筛选及黑曲霉浸铀机理研究[D]. 衡阳: 南华大学, 2014. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D619681
|
| [6] |
刁宁宁. 黑曲霉浸出高碱性氧化铜尾矿研究[D]. 衡阳: 南华大学, 2015. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D775668
|
| [7] |
叶光斌, 罗惠波, 杨晓东, 等. 浓香型大曲中黑曲霉的分离鉴定及其安全性初步研究[J]. 酿酒科技, 2013(10): 20-23. |
| [8] |
Tamura K, Peterson D, Peterson N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology & Evolution, 2011, 28(10): 2731-2739. |
| [9] |
Khalil S, Alsanius BW. Utilisation of carbon sources by Pythium, Phytophthora and Fusarium species as determined by Biolog microplate assay[J]. The Open Microbiology Journal, 2009, 3: 9-14. DOI:10.2174/1874285800903010009 |
| [10] |
邢华铭, 杜海涛, 张黎黎, 程景. PCR-DGGE与Biolog技术在土壤微生物多样性研究中的比较[J]. 农业开发与装备, 2013(10): 48-49. DOI:10.3969/j.issn.1673-9205.2013.10.041 |
| [11] |
Blinkovsky AM, Byun T, Brown KM, et al. Purification, characteriz-ation, and heterologous expression in Fusarium venenatum of a novel serine carboxypeptidase from Aspergillus oryzae[J]. Appl Environ Microbiol, 1999, 65(8): 3298-3303. |
| [12] |
姚粟, 程池, 李金霞, 胡海蓉. Biolog微生物自动分析系统——丝状真菌鉴定操作规程的研究[J]. 食品与发酵工业, 2006, 32(8): 63-67. |
| [13] |
张惠艳, 李艳菊, 顾金刚, 等. 基于Biolog-FF技术的金霉素降解真菌的碳代谢特征研究[J]. 微生物学通报, 2015, 42(7): 1241-1247. |
| [14] |
王友升, 张燕, 陈玉娟. 5株桃、李果实采后褐腐病菌鉴定、rDNA ITS序列与碳源代谢指纹图谱分析[J]. 食品科学, 2012, 33(16): 246-250. |
| [15] |
燕勇, 李卫平, 高雯洁, 等. rDNA-ITS序列分析在真菌鉴定中的应用[J]. 中国卫生检验杂志, 2008, 18(10): 1958-1961. DOI:10.3969/j.issn.1004-8685.2008.10.007 |
| [16] |
Stager CE, Davis JR. Automated systems for identification of microorganisms[J]. Clinical Microbiology Reviews, 1992, 5: 302-327. DOI:10.1128/CMR.5.3.302 |
| [17] |
Hobbie EA, Watrud LS, Maggard S, et al. Carbohydrate use and assimilation by litter and soil fungi assessed by carbon isotopes and BIOLOG? assays[J]. Soil Biology and Biochemistry, 1992, 35(2): 303-311. |
| [18] |
谭媛, 董发勤. 黑曲霉菌的浸矿效果研究[J]. 矿物学报, 2010, 30(4): 490-495. |
| [19] |
王友升, 张燕, 何欣萌, 等. 1株树莓果实采后病原真菌的rDNAITS序列及碳源代谢指纹图谱分析[J]. 中国食品学报, 2015, 15(8): 224-230. |




