色素能够赋予食品不同颜色、影响消费者选择、激发消费者食欲,是食品的加工生产和销售过程中一个重要因素[1]。近年来,随着消费者逐渐认识到合成色素存在潜在的致癌、致畸等副作用,而天然色素具有的抑菌、消炎、抗癌、抗氧化及免疫调节等生物活性,使天然色素备受青睐[2-4]。据估计,国际食品色素市场值每年以10%-15%的速度增加,到2019年将达23.1亿美元,而天然色素在2017年将达13.2亿美元,超过合成色素市场份额[1, 4]。可见,开发利用天然色素是当前食品色素市场发展的必然趋势。天然色素主要来源于动物、植物及微生物,动植物源天然色素依赖于原材料供给,品质不易控制,而微生物源色素色谱范围广、生产不受季节气候限制、原料廉价,且可以通过控制发酵参数来保证色素品质[2, 5-6]。丝状真菌能够合成包括类胡萝卜素、醌类、聚酮类及其衍生物等多种不同化学结构的色素,如红曲色素、Arpink redTM、β-类胡萝卜素及核黄素等[7-9]。当前,微生物发酵生产天然色素尚不成熟,其大规模生产仍是目前工业上面临的最大挑战,选育安全、高产及能够利用廉价生产原料新型产色素菌种是今后研究的重点之一[4]。本研究从形态特征和多位点核酸序列两个方面对来自广西大王岭自然保护区原始森林腐殖质中的一株产可溶性色素真菌DWL-C010进行鉴定,考察了其色素在不同温度下的热降解情况,并测定了该菌纤维素半纤维酶和淀粉糖化酶的酶活,以期为该菌的后续开发利用提供理论依据。
1 材料与方法 1.1 材料 1.1.1 菌株来源由作者从百色大王岭原始深林土壤中分离得到,编号为DWL-C010,保存于百色学院农业与食品工程学院-80℃超低温冰箱中。
1.1.2 培养基查氏培养基(Czapek’s agar,CZ)、查氏酵母提取物培养基(CYA)、查氏酵母盐培养基(YAS)、酵母提取物蔗糖培养基(YES)、PDA和PDB液体培养基;产酶培养基(g/L):麦麸(过80目)40,Avicel 10,KH2PO4 4,(NH4)SO4 4,MgSO4·7H2O 0.6,CaCl2 0.6,Tween-80 2,pH 6.5。
1.2 方法 1.2.1 形态观察分别在PDA、CYA、YES及CZ等4种培养基上3点接种,每点约2×106个孢子,于25℃恒温培养7 d,测量菌落直径并观察菌落形态宏观特征;采用插片培养,观察显微结构和孢子特征。
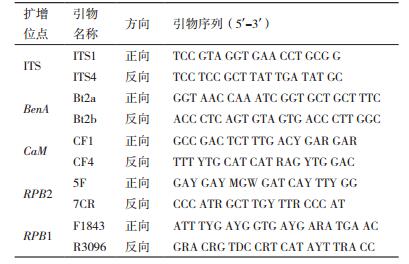
1.2.2 分子鉴定 1.2.2.1 基因组DNA提取、PCR扩增与测序采用EP管液氮研磨法微量提取基因组DNA;浓度稀释至50-100 ng/μL后,分别扩增ITS序列、β-微管蛋白基因(BenA)、钙调蛋白基因(CaM)、RNA聚合酶Ⅱ第二大亚基基因(RPB2)及RNA聚合酶Ⅱ大亚基基因(RPB1),引物如表 1所示[10]。扩增体系为25 μL,其中DNA模板、上游引物及下游引物各1.0 μL,PrimeSTAR Max DNA聚合酶12.5 μL,ddH2O 9.5 μL。PCR扩增条件为94℃预变性3 min;94℃变性30 s,退火30 s,72℃延伸30 s,30个循环后,72℃再延伸10 min;ITS、BenA及CaM退火温度分别为60℃、55℃和50℃。RPB2和RPB1基因扩增程序为:94℃预变性3 min;94℃变性30 s,48℃退火30 s,72℃延伸1 min,反应5轮;后50℃退火,反应5轮;再52℃退火,反应25轮;最后72℃延伸10 min;扩增结束后,取2.0 μL产物在0.8%琼脂糖凝胶上进行电泳检测,后将PCR产物送华大基因有限公司进行测序[11]。
原始序列用DNAStar中的Seqman拼接,人工校对后递交到GenBank获取序列号。利用MEGA7.0.14对编辑好的相关序列进行比对分析,分别用邻接法(neighbor-joiningmethod,NJ)中的Kimura2-参数模型分别构建系统发育树,空缺完全删除,并进行1 000次自举分析(Bootstrap)置信度。
1.2.3 菌株DWL-C010色素热稳定性分析 1.2.3.1 色素样品制备PDB液体培养基100 mL,接种量约1.0×108个孢子,160 r/min,28℃培养7 d后,培养基过滤除菌体,滤液10 000 r/min、4℃离心10 min。取上清液,按照1:4(V/V)加入无水乙醇,4℃过夜醇沉,离心弃底部沉淀。醇沉后上清液置于旋转蒸发仪中进行减压浓缩,浓缩液即为色素样品。
1.2.3.2 DWL-C010红色素最大吸收波长确定色素原液用适当稀释后,在400-600 nm范围内扫描,记录数据,绘制波普曲线,确定最大吸收波长。
1.2.3.3 色素稳定性分析将色素浓缩液用柠檬酸-磷酸氢二钠缓冲液适当稀释后,分别置于40、50、60、70和80℃水浴锅中,连续热处理6 h,每隔1 h测定OD,记作A,第0 h测得的OD记作A0。
1.2.3.4 DWL-C010色素热解动力学参数求解研究表明,聚酮类色素热降解遵循一级动力学反应规律[12-13]。DWL-C010色素热解速率常数(Dc)可以通过方程(1)表示,通过边界条件(即t=0时,A=A0;t=t时,A=A)可将方程(1)转化为方程(2):其Dc可通过做色素保留率对数与热作用时间之间的函数求得。
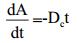 (1)
(1)
 (2)
(2)
其中,A为最大波长下的吸光度,t为时间(h),Dc为热降解速率常数(h-1)。
半衰期t1/2利用方程(3)计算,指数递减时间(D)利用方程(4)计算,即:
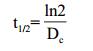 (3)
(3)
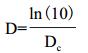 (4)
(4)
色素降解温度依赖性可以通过Arrhenius方程(5)表示,方程(5)可以线性化成方程(6)。根据不同温度的Dc,以ln(Dc)对1/T作线性回归,求出活化能Ea。
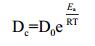 (5)
(5)
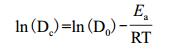 (6)
(6)
其中,D0为前指因子,Ea为活化能,R为气体常数(8.314 J·mol-1·k-1),T为绝对温度。
1.2.4 菌株DWL-C010酶活测定 1.2.4.1 粗酶液制备100 mL产酶培养基接种量同1.2.3.1,28℃、180 r/min培养至第3天开始取样,至第8天结束,发酵液10 000 r/min、4℃离心10 min,取上清液作为粗酶液。
1.2.4.2 酶活测定采用DNS比色法[14-15]。纤维素内切酶和木聚糖酶活力定义为1 mL粗酶液在50℃,pH 5.0条件下,每分钟催化底物产生1 μmoL还原糖量为1个活力单位(U/mL);糖化酶活力定义为1 mL粗酶液在40℃,pH 4.6条件下,每分钟催化可溶性淀粉产生1 μmoL葡萄糖为1个活力单位(U/mL)。
2 结果 2.1 菌株DWL-C010形态学特征不同培养基上菌株DWL-C010的菌落大小和形态不同(图 1)。25℃培养7 d,PDA平板上菌落直径32-34 mm;黄色边缘,整齐,绒毛状;中心饼状凸起、绒状;分泌橘红色液体,呈同心圆状;反面呈鲜红色,具有可溶性红色素。

|
| 图 1 菌株DWL-C010形态特征 a-h:依次为PDA、YES、CYA和CZ培养基上菌落正面和反面;i:分生孢子梗;j:分生孢子 |
YES培养基上菌落直径23-24 mm;黄色边缘,辐射状凸起,中央呈火山口状,菌丝绒毛状,白色间有橘红色;反面菌落暗红色,辐射状开裂;少量红色素分泌至培养基中。
CYA培养基上菌落直径22-24 mm;黄色边缘1-3 mm,整齐;表面辐射状褶皱;中心呈火山口状,菌丝绒毛状,黄色;反面菌落红色;部分红色素分泌到培养基中。
CZ培养基上菌落直径9-13 mm;黄色边缘1-2 mm,整齐;中心馒头状凸起,毯状;有液体渗出;反面鲜红色;大量红色素分泌至培养基中。37℃培养时,CYA上不生长。分生孢子梗有隔,壁平滑;帚状枝二轮生;梗基3-8个;瓶梗针状,每个梗基3-8个;分生孢子球状或近球状,2.3-3.6×1.8-2.5 μm。基于上述形态特征,结合Yilmaz等报道[16],初步将菌株DWL-C010归属为蓝状菌。
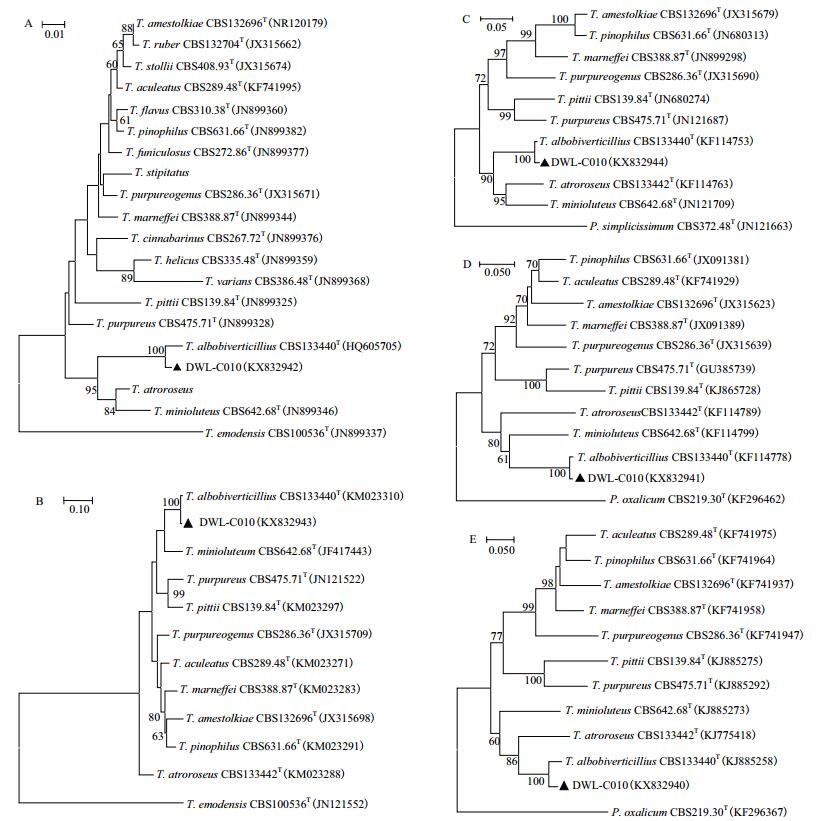
2.2 菌株DWL-C010系统发育分析ITS、RBP2、RBP1、BenA和CaM基因经过PCR扩增、测序,得到序列长度分别为521、852、826、327和556 bp;在NCBI中的核酸数据库中Blast发现,菌株DWL-C010的CaM基因序列与白二轮篮状菌CBS133440的对应核酸序列一致性为96%,而ITS序列、RBP2、RBP1和BenA基因序列一致性均高达99%。利用MEGA7.0中的ClustalW,将ITS、RBP2、RBP1、BenA和CaM序列分别与相关典型菌株对应序列进行多重比对,修剪后依次得到用于系统发育分析的序列长度为407、651、493、327和388 bp。与白二轮蓝状菌典型菌株133440相比,比对碱基序列中ITS共发生4个点突变,转换和颠换各占一半,均发生在转录间隔区;RBP2共发生9个点突变,其中2个转换,7个颠换,均为同义突变;RBP1共发生6个点突变,其中转化5个,颠换1个,也均为同义突变;BenA共发生4个点突变,其中2个颠换位点和1个插入位点位于内含子区,1个转换位于外显子区;CaM共发生20个点突变,13个转化、5个颠倒及1个缺失突变位点在内含子中,2个转化和1个颠倒突变位点在外显子中。5个基因位点的系统发育分析结果(图 2)表明,菌株DWL-C010均与白二轮篮状菌CBS133440聚在一起,并且置信度均达到了100%,故将菌株DWL-C010鉴定为白二轮篮状菌(T. albobiverticillius)。
|
| 图 2 菌株DWL-C010的ITS序列(A)、RBP2(B)、RBP1(C)、BenA(D)和CaM(E)基因系统发育树 埃地篮状菌作为ITS序列和RBP2基因的外群,草酸青霉作为BenA和CaM基因的外群,简青霉作为RBP1基因的外群;置信度表示节点支持率,图中只显示大于60的置信度;T:典型菌株 |
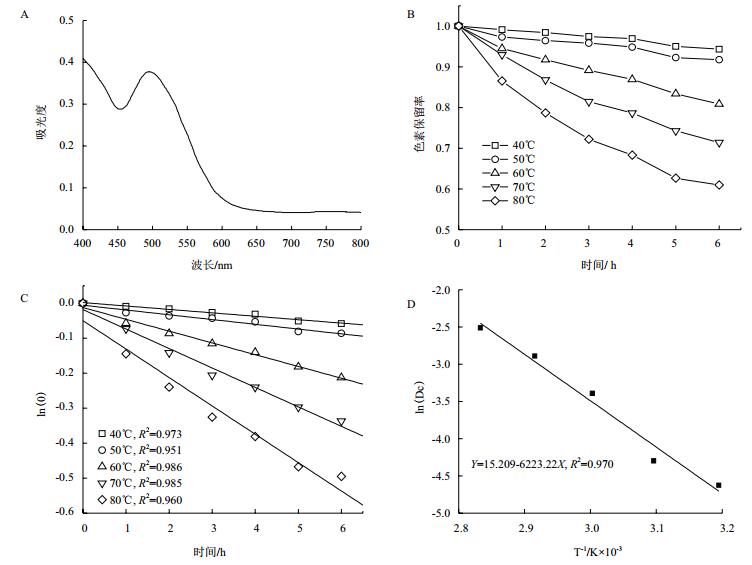
稀释后的红色素溶液在400 nm到600 nm扫描,其波普如图 3-A所示。菌株DWL-C010红色素吸光度先降低,在450 nm处开始升高,在495 nm处又开始降低,约在600 nm处开始趋于稳定。可见,495 nm是菌株DWL-C010红色素的特征吸收峰。
|
| 图 3 菌株DWL-C010红色素热解动力学分析 A:红色素的波普扫描图;B:不同温度下红色素保留率随时间的变化;C:不同温度下红色素随时间变化的降解动力学曲线;D:不同温度下红色素降解的Arrhenius图 |
分别在40、50、60、70和80℃5个温度梯度下,每隔1 h测定其色素OD495,其色素保留率如图 3-B所示。从图 3-B可知,在40和50℃时,其红色素降解缓慢;60℃开始,其色素保留率开始显著降低,尤其在80℃时,其色素保留率急剧下降。通过做ln(A/A0)与时间的函数,进行线性拟合,发现各温度的回归曲线线性良好,相关系数R2均大于0.95,符合一级动力模型(图 3-C)。通过线性方程,可知各温度下红色素的热降解速率常数Dc在每小时0.009 8-0.081 2之间(表 2);通过方程(3)和(4),可知其半衰期t1/2和指数递减时间D分别在70.73 h-8.54 h和234.96 h-28.36 h。通过作ln(Dc)与时间倒数的函数,进行曲线拟合,发现其线性良好(图 3-D),R2为0.970,求得菌株DWL-C010红色素的活化能Ea为51.82 kJ·mol-1,前指因子自然对数为15.21。
白二轮蓝状菌DWL-C010具有一定的产糖化酶(Glucoamylase)、纤维素内切酶(CMCase)和半纤维素酶的能力。其中,木聚糖酶(Xylanase)活最高,CMCase酶活次之,糖化酶酶活最低(图 4)。木聚糖酶酶活前5 d提升明显,第6天达到最大酶33.098 U/mL;CMCase酶活除第3天外,其酶活均显著高于糖化酶酶活(P < 0.05),但二者也在第6天酶活达到最大,分别为1.880 U/mL和0.976 U/mL;第6天以后,3种酶酶活均略有下降,这可能培养基中营养成分耗尽和菌体自身裂解有关。
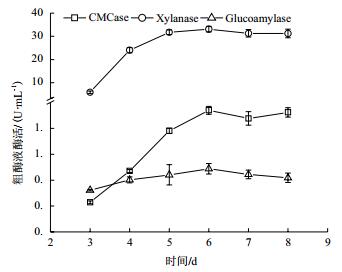
|
| 图 4 白二轮蓝状菌DWL-C010不同发酵时间的酶活 |
丝状真菌色素是重要的天然色素来源之一。目前,报道的产色素丝状真菌主要有青霉、拟青霉、曲霉、德氏霉、镰刀菌、脉孢菌和蓝状菌等[8, 17]。蓝状菌最初由Benjamin用于描述青霉菌属的有性阶段,后Yilmaz等[16]将蓝状菌和青霉双轮亚属合并单列一新属。蓝状菌中,T. amestolkiae,T. ruber和T. stolii因产素色不能分泌到胞外而不利于下游分离纯化,T. purpurogenus因产真菌毒素而不能用于工业生产,马尼菲蓝状菌(T. marneffei)虽不产真菌毒素,但是机会致病菌,也不能用于生产食品添加剂[5, 9, 11]。然而,深玫色蓝状菌(T. atroroseus)和白二轮蓝状菌不仅能够将所产色素有效分泌胞外,且未见有产真菌毒素的报道,是潜在的红色素工业化生产菌种[18]。Venkatachalam等[19]对来自海洋的一株白二轮蓝状菌色素成分进行了分析,发现的12种化合物中4种为红曲类色素,并首次报道了1种新化合物。本实验通过5个基因位点序列分析,结合形态学特征,将菌株DWL-C010鉴定为白二轮蓝状菌。
稳定性是色素性能的重要评价指标之一。在食品加工过程中,热处理是常用保鲜手段之一。为了考察菌株DWL-C010红色素的热稳定性,利用一级动力学模型分析了其色素在40-80℃的降解情况。结果发现,在40℃时,其半衰期和指数递减时间可分别长达近3 d和10 d;在50℃时,其半衰期和指数递减时间可分别长达2 d和7 d之多;在高温80℃时,其半衰期和指数递减时间还可分别长达8.54 h和28.36 h。同时,其红色素活化能为51.82 kJ·mol-1,高于产紫青霉(P. purpurogenum)的42.4 kJ·mol-1[13]、红曲霉(Monascus ruber)的11.49 kcal·mol-1[12]和紫红曲霉(M. purpureus)的40.81 kJ·mol-1[20]。可见,菌株DWL-C010红色素具有较好的热稳定性。
此外,微生物炼制色素以工农业废弃物、植物源淀粉及木质纤维素等为底物,既能够降低生产成本,又能处理废弃物,防止环境污染。蓝状菌作为一类重要的工业用子囊菌,除了应用于食品工业和生物防治外,还能够分泌多种生物质降解酶。如嗜松蓝状菌、T. funiculosus和T. cellulolyticus能够纤维素酶,且嗜松蓝状菌还能产内切葡糖苷酶和淀粉酶,T. leycettanus能产热稳定的木聚糖酶,T. lanuginosus能产糖化酶[16, 21-23]。本实验以Avice为碳源,添加麦麸,对菌株DWL-C010进行液体摇瓶培养,测得在第6天其糖化酶、纤维素内切酶和半纤维素酶酶活最大,分别为0.976、1.880和33.098 U/mL,表明其具有一定的利用廉价生产原料潜力。
4 结论从广西大王岭原始森林腐殖质土壤中分离得到的一株产可溶性红色素真菌DWL-C010,通过多基因位点序列分析,结合其形态学特征,将其鉴定为白二轮蓝状菌。其可溶性红色素的特征吸收峰位于495 nm处,具有较好的热稳定性。在40-80℃时,其红色素降解复合一级动力学模型,其Ea为51.82 kJ·mol-1。另外,菌DWL-C010具有一定的产糖化酶、纤维素内切酶和半纤维素酶能力。可见,菌株DWL-C010具有潜在的工业化生产价值,其红色素在食品工业具有一定的应用前景。
| [1] |
Martins N, Roriz CL, Morales P, et al. Food colorants: Challenges, opportunities and current desires of agro-industries to ensure consumer expectations and regulatory practices[J]. Trends in Food Science & Technology, 2016, 52: 1-15. |
| [2] |
Mapari SA, Thrane U, Meyer AS. Fungal polyketide azaphilone pigments as future natural food colorants?[J]. Trends Biotechnol, 2010, 28(6): 300-307. DOI:10.1016/j.tibtech.2010.03.004 |
| [3] |
Tuli HS, Chaudhary P, Beniwal V, et al. Microbial pigments as natural color sources: current trends and future perspectives[J]. J Food Sci Technol, 2015, 52(8): 4669-4678. DOI:10.1007/s13197-014-1601-6 |
| [4] |
Nigam PS, Luke JS. Food additives: production of microbial pigments and their antioxidant properties[J]. Current Opinion in Food Science, 2016, 7: 93-100. DOI:10.1016/j.cofs.2016.02.004 |
| [5] |
Mapari SA, Nielsen KF, Larsen TO, et al. Exploring fungal biodiversity for the production of water-soluble pigments as potential natural food colorants[J]. Curr Opin Biotechnol, 2005, 16(2): 231-238. DOI:10.1016/j.copbio.2005.03.004 |
| [6] |
Lopes FC, Tichota DM, Pereira JQ, et al. Pigment production by filamentous fungi on agro-industrial byproducts: an eco-friendly alternative[J]. Appl Biochem Biotechnol, 2013, 171(3): 616-625. DOI:10.1007/s12010-013-0392-y |
| [7] |
Dufosse L, Fouillaud M, Caro Y, et al. Filamentous fungi are large-scale producers of pigments and colorants for the food industry[J]. Curr Opin Biotechnol, 2014, 26: 56-61. DOI:10.1016/j.copbio.2013.09.007 |
| [8] |
Lebeau J, Venkatachalam M, Fouillaud M, et al. Production and new extraction method of polyketide red pigments produced by ascomycetous fungi from terrestrial and marine habitats[J]. Journal of Fungi, 2017, 3(3): 34. DOI:10.3390/jof3030034 |
| [9] |
Rodriguez-Amaya DB. Natural food pigments and colorants[J]. Current Opinion in Food Science, 2016, 7: 20-26. DOI:10.1016/j.cofs.2015.08.004 |
| [10] |
Visagie CM, Houbraken J, Frisvad JC, et al. Identification and nomenclature of the genus Penicillium[J]. Stud Mycol, 2014, 78: 343-371. DOI:10.1016/j.simyco.2014.09.001 |
| [11] |
Mapari SA, Meyer AS, Thrane U, et al. Identification of potentially safe promising fungal cell factories for the production of polyketide natural food colorants using chemotaxonomic rationale[J]. Microb Cell Fact, 2009, 8: 24. DOI:10.1186/1475-2859-8-24 |
| [12] |
Vendruscolo F, Luise Müller B, Esteves Moritz D, et al. Thermal stability of natural pigments produced by Monascus ruber in submerged fermentation[J]. Biocatalysis and Agricultural Biotechnology, 2013, 2(3): 278-284. DOI:10.1016/j.bcab.2013.03.008 |
| [13] |
Morales-Oyervides L, Oliveira JC, Sousa-Gallagher MJ, et al. Effect of heat exposure on the colour intensity of red pigments produced by Penicillium purpurogenum GH2[J]. Journal of Food Engineering, 2015, 164: 21-29. DOI:10.1016/j.jfoodeng.2015.04.020 |
| [14] |
Jing L, Zhao S, Xue JL, et al. Isolation and characterization of a novel Penicillium oxalicum strain Z1-3 with enhanced cellobiohydrolase production using cellulase-hydrolyzed sugarcane bagasse as carbon source[J]. Industrial Crops and Products, 2015, 77: 666-675. DOI:10.1016/j.indcrop.2015.09.052 |
| [15] |
GB1886. 174-2016, 食品工业用酶制剂[S].
|
| [16] |
Yilmaz N, Visagie CM, Houbraken J, et al. Polyphasic taxonomy of the genus Talaromyces[J]. Studies in Mycology, 2014, 78: 175-341. DOI:10.1016/j.simyco.2014.08.001 |
| [17] |
Gmoser R, Ferreira JA, Lennartsson PR, et al. Filamentous ascomycetes fungi as a source of natural pigments[J]. Fungal Biology and Biotechnology, 2017, 4(1): 4. DOI:10.1186/s40694-017-0033-2 |
| [18] |
Frisvad JC, Yilmaz N, Thrane U, et al. Talaromyces atroroseus, a new species efficiently producing industrially relevant red pigments[J]. PLoS One, 2013, 8(12): e84102. DOI:10.1371/journal.pone.0084102 |
| [19] |
Venkatachalam M, Zelena M, Cacciola F, et al. Partial characterization of the pigments produced by the marine-derived fungus Talaromyces albobiverticillius 30548. Towards a new fungal red colorant for the food industry[J]. Journal of Food Composition and Analysis, 2018, 67: 38-47. DOI:10.1016/j.jfca.2017.12.036 |
| [20] |
Silveira ST, Daroit DJ, Sant'anna V, et al. Stability modeling of red pigments produced by Monascus purpureus in submerged cultivations with sugarcane bagasse[J]. Food and Bioprocess Technology, 2011, 6(4): 1007-1014. |
| [21] |
Wang X, Huang H, Xie X, et al. Improvement of the catalytic performance of a hyperthermostable GH10 xylanase from Talaromyces leycettanus JCM12802[J]. Bioresource Technology, 2016, 222: 277-284. DOI:10.1016/j.biortech.2016.10.003 |
| [22] |
Thorsen TS, Johnsen AH, Josefsen K, et al. Identification and characterization of glucoamylase from the fungus Thermomyces lanuginosus[J]. Biochimica et Biophysica Acta(BBA)-Proteins and Proteomics, 2006, 1764(4): 671-676. DOI:10.1016/j.bbapap.2006.01.009 |
| [23] |
Xian L, Wang F, Luo X, et al. Purification and Characterization of a Highly Efficient Calcium-Independent α-Amylase from Talaromyces pinophilus 1-95[J]. PLoS One, 2015, 10(3): e0121531. DOI:10.1371/journal.pone.0121531 |