我国设施蔬菜产业自20世纪80年代中期以来,得到迅速发展。截止2015年,我国设施蔬菜面积已经达到388.84万hm2,产值超过蔬菜总产值的60%[1]。由于设施蔬菜经济附加值高,长期处于高集约化、高复种指数、高肥料、农药施用量的生产状态,导致土壤次生盐泽化、养分失调、酸化,土壤肥力下降,微生物生态失衡,土传病虫害及农药残留等也日益加重[1]。利用微生物或生物制品可降解农药残留,防控土传病虫害,提升土壤肥力,是解决设施蔬菜可持续发展瓶颈的主要手段之一[2]。
木霉(Trichoderma)是土壤微生物的优势种群,一直作为生防菌或促生菌被广泛研究和应用,近年来的研究表明木霉在土壤和水源污染(如农药等有机物污染或重金属污染)修复方面也有较高的研究应用价值[3]。张广志等[4, 5]从长期施药的设施蔬菜土壤中分离出的多株木霉菌,在生防和农残修复方面,均表现出较强的应用潜力。木霉越来越成为一种极具应用开发潜力的微生物资源,可以协同解决设施农业土壤中存在的多个问题,发挥其功能多样化的优势[6]。但是微生物活体菌剂一直存在效果不稳定的应用瓶颈,通常在盆栽及小区试验,或者在无菌土壤以及与杀菌剂配合使用时,才能保证较理想的效果。原因主要在此试验环境下,菌种较容易保持其种群优势,有效发挥群体效应。而在设施田间使用时,活体菌种除了受到日益恶化的土壤环境因素影响外,还要受到其他微生物种群以及同类微生物群体的影响。此外,设施土壤普遍应用的消毒方式,也使得土壤原微生物种群多样性结构受到严重破坏,某些适应性强的有害微生物占据了优势,这些均会对施入微生物菌种的适应和定殖竞争造成威胁。为了更好了解设施土壤中木霉的多样性,本研究探索番茄根围土样中的木霉种群结构、相对种群密度及功能活性特征,旨在为研究木霉的生态学,深入挖掘木霉菌资源及提高在设施农业上的高效应用提供参考。
1 材料与方法 1.1 材料 1.1.1 土样选择样品采自山东寿光纪台镇任家洼村一个连续20多年种植番茄的日光温室,五点取样,植株连根拔起,轻抖,仅带根围表面少量土壤,无菌袋密封带回实验室。
1.1.2 试剂及培养基木霉选择性培养基(THSM):K2HPO4 0.90 g;MgSO4·7H2O 0.20 g;NH4NO3 1.0 g;KCl 0.15 g;葡萄糖3.0 g;孟加拉红0.15 g;琼脂15.0 g;蒸馏水1.0 L。灭菌后加入氯霉素0.25 g,链霉素0.03 g和五氯硝基苯0.2 g;PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂15 g、蒸馏水1 000 mL;无机盐液体培养基(MSM):K2HPO4 1.50 g,KH2PO4 0.50 g,MgSO4·7H2O 0.50 g,(NH4)2SO4 0.50 g,FeSO4·7H2O 0.002 g,CaCl2 0.04 g,NaCl 0.5 g,H2O 1 000 mL,pH7.0。
1.2 方法 1.2.1 木霉菌分离用无菌刷将根系表面土壤刷下,混合,取土样10 g,加到装有100 mL无菌水的三角瓶中,置于摇床140 r/min 15 min。取1 mL土壤悬液加入9 mL无菌水的试管中,以此稀释至104倍。采用混菌的方式,即将各稀释浓度的菌悬液1 mL,加入9 cm平板上,再倒入适量50-55℃的木霉选择性培养基(THSM)[7],混匀,每个稀释梯度3次重复。25℃恒温培养,24 h观察一次,有疑似木霉菌落出现,用接种针挑出转接到PDA平板上。同样条件培养3-5 d,根据形态特征分组,去同,保存备用。
将番茄根系用0.1%的升汞溶液和75%酒精表面消毒后,用解剖刀将根系切片,转接到上述木霉选择性培养基上,分离根系内生木霉菌,操作同上。通过稀释倍数和平板出现的菌落数,估算各个木霉菌株在土样中的相对种群密度和组成比例情况。
相对种群密度=稀释倍数×该稀释倍数平板上出现的菌落数平均数。
1.2.2 木霉菌种类鉴定和系统发育分析结合形态学特征和tef1-α序列鉴定分离的木霉种类。采用真菌基因组DNA快速提取试剂盒(北京艾德莱生物科技有限公司)提取DNA,以此为模板扩增tef1-α(引物EF1-728F:5'CATCGAGAAGTTCGAGAAGG 3'和TEF1-LLErev:5'AACTTGCAGGCAATGTGG 3')[8-9]。PCR采用C1000 Thermalcycler(BIO RAD),反应体系25 μL:1 μL各引物(10 μmol/L),12.5 μL 2×Pfu PCR MasterMix(北京艾德莱生物科技有限公司),1 μL模板DNA,9.5 μL dd H2O。反应条件:预变性95℃ 5 min;95℃变性40 s,55℃退火40 s,72℃延伸60 s,进行35个循环;72℃延伸10 min,4℃保存[10-11]。PCR产物送上海生工纯化并测序。测序结果提交TrichoBLAST(WWW.ISTH.info)和NCBI Nucleotide BLAST进行相似性比较分析。采用MEGA7.0软件构建tef1-α序列系统进化树[12]。
1.2.3 木霉对几种常见土传病原菌的抑菌作用测定用经灭菌的直径5 mm打孔器在分别活化2 d的木霉和病原菌(Rhizoctonia solani、Pythium ultimum和Fusarium solani)的菌落边缘打取菌苔,分别移置于直径9 cm的PDA平板上(间距6 cm),于25℃条件下对峙培养,每处理重复3次。以只接种病原菌的为对照。待对照病原菌菌落快长到木霉接菌点或木霉菌落快长到病原菌接菌点时,测量各自菌落的半径,并计算抑制率[4]。
1.2.4 木霉对毒死蜱的降解活性测定按100 mg/L的浓度将毒死蜱加入到灭菌后的装有50 mL无机盐液体培养基(MSM)的250 mL三角瓶中,分别接种各木霉菌株的孢子悬液(1.0×108 cfu/mL)1 mL,以不接木霉孢子悬液的处理为对照。每处理重复3次,置于30℃ 140 r/min培养5 d,并利用GC-ECD法检测毒死蜱残留量[13-14],并计算降解率。
2 结果 2.1 毒死蜱降解木霉的分离和鉴定在木霉选择性培养基上培养2 d后,陆续将4个稀释梯度,共计12个平板上的疑似木霉菌落全部转接到PDA平板上,再继续培养3-5 d,通过菌落特征确认木霉菌菌株,共获得木霉菌株126个,通过菌落形态结合镜检显微特征,进一步分组,共获得24个不同的组,组间菌株形态差异不明显,初步确认为同一菌株,并各挑一个代表菌株,依次编号T1-1-T1-24,重新转接至PDA培养基上,每个菌株3次重复,培养3-5 d,根据形态学和显微特征的细微差别进一步确认分组。从根系中分离内生木霉菌16株,同上,最终确认不同菌株3株,编号分别为TN1-1-TN1-3。分离所有27株木霉,PDA平板形态如图 1所示,产孢簇常呈鲜绿色到暗绿色,分布不均匀,常形成同心圆结构。

|
| 图 1 木霉菌株的菌落形态 |
将27个木霉菌株tef1-α序列,提交至TrichoBLAST(WWW.ISTH.info)和NCBI BLAST进行相似性检索,结果表明,土样中24个菌株,其中有11个菌株与T. virens代表菌株GJS 01-287相似度在99%,鉴定为T. virens(绿色木霉);6个菌株与T. simmonsii代表菌株S86相似度在99%,鉴定为T. simmonsii(西蒙斯木霉);3个菌株与T. atroviride代表菌株DAOM 222144相似度在99%,鉴定为T. atroviride(深绿木霉);2个菌株与T. crassum代表菌株DAOM 164916相似度在99%,鉴定为T. crassum(厚木霉);1个菌株与T. atrobrunneum代表菌株S369相似度在99%,鉴定为T. atrobrunneum(深褐木霉)。另有1株木霉,经过对比,与所有登记的木霉tef1-α序列相似度均在95 %以下。根据Bissett[15]公布的木霉种类名录以及近两年发表的新种[16-19],目前所有被认可的木霉种类,均有相应的tef1和rpb2序列作为代表序列。tef1和rpb2序列是目前木霉系统发育分析及种类鉴定的主要依据,tef1通常比rpb2具有更高的分辨率,除个别种类外,依据tef1序列可以对木霉实现准确的种类认定[15, 20]。因此根据tef1序列与GenBank所有登记的木霉tef1序列的对比结果,初步鉴定菌株T1-24为一木霉新种(T. sp.nov.)。3株内生木霉菌株TN1-1、TN1-2和TN1-3分别鉴定为T. atroviride、T. simmonsii和T. atrobrunneum,平板菌落形态与土样中的同种菌株具有明显差异,菌落颜色也普遍浅于土样中菌株。
2.2 木霉菌株的相对种群密度土样中木霉,通过稀释倍数和平板出现的菌落数,估算各个木霉菌株在土样中的相对种群密度。该设施番茄的根围土样中,木霉的总的种群密度大约在104 CFU/g。各个菌株的组成,如图 2所示,T1-8、T1-23和T1-24三个菌株是其中优势菌株,占比分别为30%、20%和20%;其它菌株占比均在5 %或5 %以下。个别菌株,如T1-2、T1-7、T1-12、T1-16和T1-20,仅能在稀释10倍的平板上出现,相对种群密度分别为10 CFU/g、20 CFU/g、30 CFU/g、10 CFU/g、20 CFU/g。
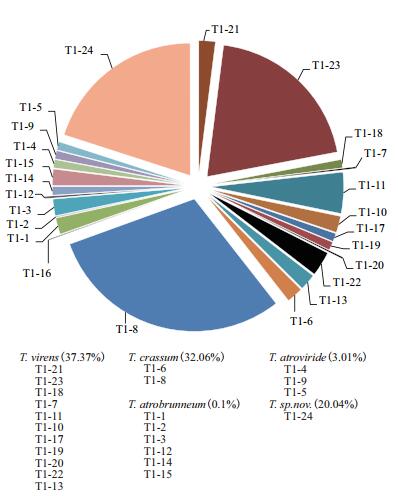
|
| 图 2 土壤中木霉各菌株的相对种群密度组成 |
木霉菌株的tef1-α序列极大似然(ML)发育树如图 3所示,已知木霉种类的菌株都在临近的一条发育分支上,只有一个疑似新种与其他26株木霉的tef1-α序列相似性仅为92%,且位于相对较远的发育分支上。由于本发育树基于相对保守序列tef1进行构建,无法真实反映木霉种类下的各个菌株的系统进化情况,导致其中部分菌株,如T. virens的T1-21、T1-23、T1-18、T1-7和T1-11,在同一个发育位点上,序列相似性达到100%,但形态特征上,尤其菌落特征,如产孢簇分布、密度、颜色、形成同心圆个数及大小等方面,具有明显的差异,仍可确认为不同菌株。T1-24菌株与所有登记的木霉tef1-α序列相似度在95%以下,与其他几个种的菌株相距较远,形态特征更是未见相似报道,现确定为一疑似木霉新种,为土壤木霉种类的优势种群(20.04%),仅次于T. virens(37.37%)和T. crassum(32.06%);此外该木霉在多个设施菜地土样中常有发现,应该为设施菜地土壤中的常见木霉种类。
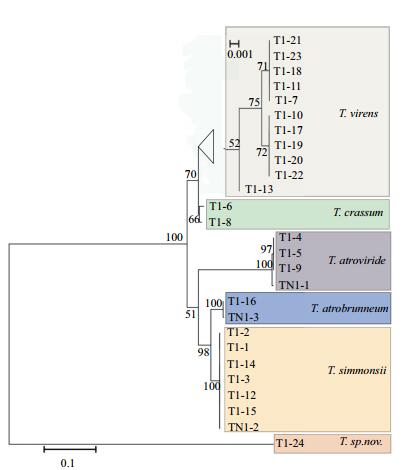
|
| 图 3 基于菌株tef1-α序列构建的最大似然进化树 |
平板对峙条件下,所有27个木霉菌株对3个供试病原真菌均有一定的抑菌作用,且同种不同菌株的抑菌效果有明显的差异,表明这些同种不同菌株存在进化上(功能活性)的差异。其中木霉对立枯丝核菌(R. solani)的抑菌效果最为显著(图 4),有13个菌株的抑菌率超过50%;而西蒙斯木霉(T. simmonsii)的7个菌株中有6个菌株的抑菌率超过82.0%,T1-2的抑菌率也达60.4%,表现普遍的生防潜能;绿色木霉(T. virens)、厚木霉(T. crassum)和深绿木霉(T. atroviride)中也各有1个菌株对立枯丝核菌有较高的生防潜能,抑菌率超过80%。
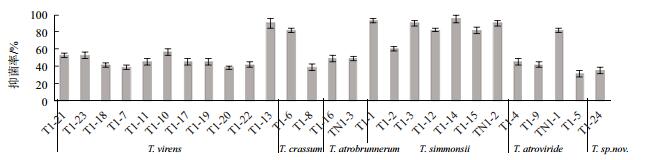
|
| 图 4 木霉菌株对立枯丝核菌的抑菌效果 |
所试木霉菌株对病原真菌F. oxysporum的抑菌率相对较低(图 5),仅有7个菌株的抑菌率超过50%。其中绿色木霉的T1-22、T1-13菌株和厚木霉的T1-8菌株,抑菌率分别为54.1%、55.7%和54.0%;深绿木霉3个菌株抑菌率分别达78.7%、77.1%和63.9%,菌株T1-9却仅为27.9%;新种T1-24抑菌率也达67.2%。对病原菌V. dahliae的抑菌率普遍较差(图 6),除西蒙斯木霉T1-15菌株抑菌率51.6%外,其它菌株抑菌率均在50%或50%以下;其中西蒙斯木霉的几个菌株,相对较好,抑菌率集中在45.3%-51.6%。
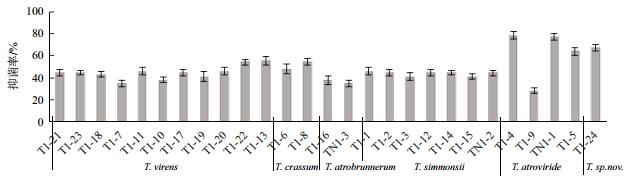
|
| 图 5 木霉菌株对尖孢镰孢菌的抑菌效果 |

|
| 图 6 木霉菌株对大丽轮枝菌的抑菌效果 |
降解试验结果如图 7所示,除深褐木霉(T. atrobrunneum)两个菌株对毒死蜱的降解效果不明显外;其它种类的木霉,均有菌株能有效降解毒死蜱,如绿色木霉T1-10、西蒙斯木霉的T1-2、深绿木霉的TN1-1、厚木霉的T1-6和疑似新种的T1-24菌株对毒死蜱的降解率分别最高达到58.3%、82.5%、72.1%、63.0%和38.2%。也有一些菌株,如绿色木霉T1-21、西蒙斯木霉T1-12等5个菌株孢子在含有100 mg/L毒死蜱的无机盐溶液中不能萌发或生长,也未见有降解效果。降解实验结果同时表明,同一个种的不同木霉菌株,对毒死蜱的降解效果也存在显著差异,表明木霉菌的系统进化过程,不仅表现在形态学特征上,在功能活性上也有体现。
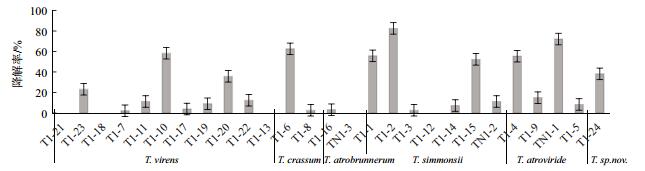
|
| 图 7 木霉菌株对毒死蜱的降解效果 |
通过对设施番茄根围土样和根围内生木霉进行分离,依照形态学特征上的差异,共获得27个不同木霉菌株(3株属于内生木霉菌),这些木霉菌株产孢簇呈鲜绿色到暗绿色,产孢簇分布不均匀,常围绕接菌点形成同心圆结构。同种类的木霉不同的菌株,形态学特征相似,但仍存在细微差别可以加以区分。结合tef1-α序列分析,鉴定27个菌株分别属于5个已知木霉种和1个疑似新种。所有菌株对R. solani、F. oxysporum和V. dahliae三种具有代表性的土传病原真菌具有普遍的不同程度的拮抗作用,同时,除厚木霉外,其它种类的木霉均有少数个别菌株能有效降解毒死蜱,表现土壤农残修复的潜力。因此利用木霉菌,更容易筛选到兼具两种功能甚至多种功能的木霉菌资源,实现生物防治与土壤农化残留降解的协同应用目标,对于设施农业减少杀菌剂使用,延缓抗药性;降解农药残留,减少农残危害具有重要的意义。系统发育树的构建,一定程度上反映了各个种类及菌株的进化发育关系,但由于tef1-α作为种类鉴定的序列标记,并不能反映菌株实际进化上的差异,因此,同种下的木霉部分菌株tef1-α序列相似性达到100%,在系统发育树上处于同一进化分支。土壤中的木霉通常由几种不同种类组成,每个种类的木霉可能存在不同的进化菌株,本研究中各菌株形态特征的细微差异及功能活性的不同差异给予其有效地证明。
不同的木霉菌株在土壤中的的种群密度也存在巨大差异,如T1-12相对种群密度仅为30 CFU/g,而T1-8相对种群密度约为T1-12的100倍,因此对土样的木霉菌株最大程度的分离是研究土壤木霉资源及生态多样性的基础。本研究通过专用的木霉选择性分离培养基,设置不同的土壤稀释梯度,并通过混菌的方式,最大程度地对土样中的木霉菌株进行了分离,尤其对种群密度相对极低的5个木霉菌株(10-30 CFU/g)也能有效进行分离,效率显著。本研究表明,设施菜地土壤中,木霉具有丰富的多样性,功能活性上的差异,也验证了形态学特征上的菌株差异在不同菌株确认上应用的可行性,该特征可指导土壤中功能木霉的挖掘和筛选工作。该根围土样中木霉总的种群密度总体不高,约在104 CFU/g,优势种为T. virens、T. crassum和T. sp. nov.,且只是个别菌株(T. virens T1-23、T. crassum T1-8和T. sp. nov. T1-24)占优势,表明这3个菌株在设施番茄根围土样中具有更好的适应性和竞争能力。但在对3种病原真菌的抑菌试验以及对毒死蜱的降解试验中,表现却并不理想。因此在功能活性菌株的筛选过程中,很容易被舍去,而是选择抑菌活性高或降解毒死蜱效率的菌株,如菌株T1-14、T1-4、T1-15以及T1-2,但这些菌株在土壤中的相对种群密度却很低,即1.0×102 CFU/g、1.0×102 CFU/g、2.0×102 CFU/g或10 CFU/g,预示在设施农业土壤中可能适应性或定殖竞争能力差,外源加入该环境的土壤中,种群优势很难得到持久保障,难以更长时间地发挥作用。由此表明,在农业微生物菌株的筛选过程中,除了考虑功能活性的高低外,也要考虑其种群密度或在环境中的适应性,才能筛选获得更具实际应用潜力的菌株资源;或者通过其它措施提高试验期内的种群密度优势,从而保证发挥其群体效应。
4 结论从连续多年栽培番茄的设施大棚根围土样中分离木霉菌,研究其种群多样性和相对种群密度,同时测定对植物病原真菌的抑菌活性和对有机磷农药降解活性。共获得6个不同的木霉种类,27个不同的木霉菌株。各木霉菌株在土样中种群密度差异很大。所有木霉菌株对几种常见土传病原真菌具有普遍的不同程度的抑菌活性,部分菌株能有效降解有机磷农药毒死蜱,可以实现生物防治与土壤农化残留降解的协同应用目标。
| [1] |
杨淏然, 马兆红, 司智霞. 山东寿光设施蔬菜土壤修复对策与实例[J]. 中国蔬菜, 2016, 6: 1-5. |
| [2] |
Yang L, Zhao YH, Zhang BX, et al. Isoation and characterization of a chlorpyrifos and 3, 5, 6-trichloro-2-pyridinol degrading bacterium[J]. FEMS Microbiol Lett, 2005, 251: 67-73. DOI:10.1016/j.femsle.2005.07.031 |
| [3] |
Tripathi P, Singh PC, Mishra A, et al. Trichoderma: a potential bioremediator for environmental clean up[J]. Clean Techn Environ Policy, 2013, 15: 541-550. DOI:10.1007/s10098-012-0553-7 |
| [4] |
张广志, 杨合同, 等. 毒死蜱降解木霉菌对几种重要植物病原真菌的生防活性[J]. 菌物学报, 2014, 33(6): 1292-1301. |
| [5] |
张广志, 张新建, 李红梅, 等. 土壤中木霉的分离及其对毒死蜱降解特性研究[J]. 生物技术通报, 2016, 32(6): 205-210. |
| [6] |
陈捷. 木霉菌生物学与应用研究—回顾与展望[J]. 菌物学报, 2014, 33(6): 1129-1135. |
| [7] |
Martin JP. Use of acid, rose gengal and streptomycin in the plate method for estimating soil fungi[J]. Soil Science, 1950, 69: 215-232. DOI:10.1097/00010694-195003000-00006 |
| [8] |
Jaklitsch WM, Samuels GJ, Dodd SL, et al. Hypocrea rufa.Trichoderma viride: a reassessment, and description of five closely related species with and without warted conidia[J]. Studies in Mycology, 2006, 56: 135-177. DOI:10.3114/sim.2006.56.04 |
| [9] |
Bissett J. A revision of the genus Trichoderma. Ⅲ. Infrageneric classification[J]. Can J Bot, 1991, 69: 2372-2417. |
| [10] |
Park MS, Oh SY, et al. Trichoderma songyi sp. nov., a new species associated with the pine mushroom(Tricholoma matsutake)[J]. Antonie Van Leeuwenhoek, 2014, 106: 593-603. DOI:10.1007/s10482-014-0230-4 |
| [11] |
Chaverri P, Gazis RO, Samuels GJ. Trichoderma amazonicum, a new endophytic species on Hevea brasiliensis and H. guianensis from the Amazon basin[J]. Mycologia, 2011, 103: 139-151. DOI:10.3852/10-078 |
| [12] |
Kumar S, Stecher G, Tamura K. MEGA7: Molecular evolutionary genetics analysis version 7. 0 for bigger datasets[J]. Molecular Biology and Evolution, 2016, 33: 1870-1874. DOI:10.1093/molbev/msw054 |
| [13] |
Lan WS, Cong J, Jiang H, et al. Expression and characterization of carboxylesterase E4 gene from peachpotato aphid(Myzus persicae)for degradation of carbaryl and malathion[J]. Biotechnol Letters, 2005, 27: 1141-1146. DOI:10.1007/s10529-005-8464-x |
| [14] |
石利利, 林玉锁, 徐亦钢, 等. 高尔夫球场土壤和水中毒死蜱农药残留的测定[J]. 农业生态环境, 2000, 16(3): 35-38. |
| [15] |
Bissett J, Gams W, Jaklitsch W, et al. Accepted Trichoderma names in the year 2015[J]. IMA fungus, 2015, 6(2): 263-295. DOI:10.5598/imafungus.2015.06.02.02 |
| [16] |
Qin WT, Zhuang WY. Four new species of Trichoderma with hyaline ascospores in the Brevicompactum and Longibrachiatum clades[J]. Mycosystema, 2016, 35(11): 1317-1336. |
| [17] |
Qin WT, Zhuang WY. Seven wood-inhabiting new species of the genus Trichoderma(Fungi, Ascomycota)in Viride clade[J]. Scientific Reports, 2016, 6: 27074. DOI:10.1038/srep27074 |
| [18] |
Qin WT, Zhuang WY. Seven new species of Trichoderma.Hypocreales)in the Harzianum and Strictipile Clades[J]. Phytotaxa, 2017, 305(3): 121-139. DOI:10.11646/phytotaxa.305.3 |
| [19] |
Chen K, Zhuang WY. Three new soil-inhabiting species of Trichoderma in the stromaticum clade with test of their antagonism to pathogens[J]. Curr Microbiol, 2017, 74: 1049-1060. DOI:10.1007/s00284-017-1282-2 |
| [20] |
Jaklitsch WM, Voglmayr H. Biodiversity of Trichoderma.Hypocreaceae)in Southern Europe and Macaronesia[J]. Studies in Mycology, 2015, 80: 1-87. DOI:10.1016/j.simyco.2014.11.001 |




