2. 沈阳农业大学生物科学技术学院,沈阳 110866;
3. 南开大学生命科学学院,天津 300071
2. College of Bioscience and Biotechnology, Shenyang Agricultural University, Shenyang 110866;
3. College of Life Science, Nankai University, Tianjin 300071
油菜是十字花科重要的作物之一,在我国主要分布在南方,栽种面积广,营养价值和观赏价值高,而且油菜籽可以榨油,是一种重要的油料产物[1]。油菜菌核病是油菜栽培中的重要病害之一,又称茎腐病,俗称白杆、空杆、霉蔸等,是一种由核盘菌Sclerotinia sclerotiorum引起的真菌性病害。油菜菌核病的发生会引起油菜植株早枯、角果减少、种子皱瘪、千粒重降低等,导致油菜减产10%-50%,重发病年份发病率可高达80%,给农业生产带来巨大损失[2]。油菜菌核病菌主要以菌核混在土壤中或附着在采种株上、混杂在种子间越冬或越夏,在潮湿土壤中菌核能存活1年,干燥土中可存活3年,因此菌核病的防治是一个全球范围内的难题[3]。目前,对油菜菌核病的防治多以农业防治和化学药剂防治相结合的方法,但是农业防治费时费力,而化学药剂防治对于作物的营养价值以及生态环境都有较大损害。随着人们对农药残留、病菌抗药性增强等问题认识程度的不断提高,化学农药的使用范围及剂量将会不断减少,与此同时,人们更多地将希望寄托于生物防治剂的开发与利用方面[4-5],内生真菌作为一个重要类群已被广泛研究[6-8]。
内生真菌与植物之间的互惠共生关系在高等植物中广泛存在,研究表明,内生真菌在从植物体内获取生存所需的空间以及养分的同时,往往也会带给植物一些选择上的优势,包括促进植物生长、增加植物产量、提高植物对一些生物胁迫和非生物胁迫的抵抗能力等[9]。因此,植物内生真菌有可能成为生物防治中有潜力的微生物农药和增产菌[10-12]。利用植物内生真菌控制作物病虫害、发掘并合理利用有益内生真菌以提高作物产量和品质,对农业的可持续发展具有重要意义。
本研究从兰科植物羊耳蒜(Liparis japonica)根部分离筛选得到一株对油菜菌核病菌具有较强拮抗作用的内生真菌,结合形态学和分子生物学方法对该拮抗真菌进行种类鉴定,并初步研究了其生物学特性,建立了该菌株的最适培养条件,以期为兰科植物内生真菌资源的筛选及有效利用提供科学依据,为油菜菌核病的无公害防治提供参考。
1 材料与方法 1.1 材料供试的羊耳蒜植株于2012年6月采自辽宁省沈阳市东陵山。剪取健康植株的根段,用封口袋带回实验室,24 h内进行根部内生真菌的分离。供试培养基为常规PDA培养基。马铃薯200 g,水1000 mL,沸水煮45 min后过滤得马铃薯汁,加入葡萄糖20 g,琼脂15 g,115℃高压灭菌20 min。
1.2 方法 1.2.1 内生真菌的分离与纯化将羊耳蒜的根段用流水冲洗干净,先表面消毒,用75%的酒精浸泡10 s,无菌水漂洗3次,每次30 s,0.1%升汞溶液浸泡5 min,无菌水漂洗3次,每次30 s,最后一次冲洗后将根段保存在无菌水中。然后用无菌解剖刀将根段切成长度约5 mm的小段,置于灭菌PDA培养基上,封口,25℃恒温培养箱中暗培养。接种后每天观察,当有致密的菌丝从根段切口长出时,挑取菌丝并将其转移到新的PDA培养基上,培养7 d后,再从颜色质地均匀的菌落边缘挑取一小块菌丝,接种到新的PDA培养基上,重复转接3次,以获得羊耳蒜根部的内生真菌单菌落。将分离纯化获得的内生真菌菌株接种于PDA培养基上培养10 d,用5 mm直径的打孔器打孔,制成菌饼备用。
1.2.2 抑菌活性检测采用平板对峙法。挑取一块油菜菌核病菌的菌饼接种到PDA平板中央,距离菌饼3 cm处的3个点接种内生真菌菌饼,25℃恒温暗培养,重复三皿。逐日观察抑菌作用,当内生真菌与油菜菌核病菌菌落相交后或菌落直径不再增加后,测量并记录抑菌圈的大小。
1.2.3 拮抗真菌的种类鉴定按照真菌形态鉴定的方法,将具有拮抗活性的纯菌株接种于PDA培养基上,25℃培养,根据菌落形态、菌丝直径、生长速率、分生孢子的大小、形态和着生方式等对其进行形态学鉴定。同时,采用Cenis[13]的方法快速提取基因组DNA,用White等[14]设计的引物ITS1和ITS4进行扩增。PCR扩增程序为:94℃ 5 min;94℃ 30 s,54℃ 30 s,72℃ 1 min,35个循环;72℃ 10 min。PCR产物送到上海生工生物工程公司测序。用GenBank中的BLAST程序搜索相似性序列并对其进行分子鉴定和序列提交,得到GenBank序列号。
1.2.4 拮抗真菌的生物学特性研究分别检测了该菌株在不同碳源、氮源、温度和pH值条件下的菌丝生长状况。实验以PA培养基(马铃薯200 g,水1 000 mL,沸水煮45 min后过滤得马铃薯汁,加入琼脂15 g,115℃高压灭菌20 min)为基本培养基并分别添加2%葡萄糖、蔗糖、果糖、麦芽糖、乳糖、木糖、淀粉,25℃暗培养,检测碳源对该菌株生长的影响;以2%葡萄糖为碳源,分别添加0.5%尿素、硫酸铵、硝酸钾、牛肉膏、硝酸铵配制琼脂培养基,25℃暗培养,检测氮源对该菌株生长的影响。同时,用PDA培养基检测温度为5、10、15、20、25、30、35、40℃时的菌株生长状况;用PDA培养基在温度为25℃条件下,检测pH值为5、6、7、8、9时的菌株生长状况。以上实验每个处理重复3皿,连续15 d每天测量菌落直径。
1.2.5 数据分析用SPSS软件进行数据处理,统计分析菌株生长速率并进行单因素方差分析。
2 结果 2.1 油菜菌核病拮抗真菌的筛选从羊耳蒜植株的根部分离得到的内生真菌菌株经纯化培养后,经平板对峙法筛选获得1株对油菜菌核病菌有较强拮抗效果的菌株,拮抗效果见图 1,抑菌圈直径为4.61±0.02 mm。
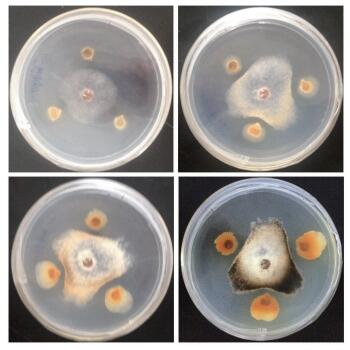
|
| 图 1 羊耳蒜内生真菌与油菜菌核病菌的拮抗作用 从左至右分别为对峙培养2 d,4 d,6 d,8 d |
形态观察发现,该拮抗真菌在PDA培养基上的初始菌落颜色为白色,3-5 d后变为乳黄色并逐渐呈现黄褐色,菌落质地毡状、致密,平均生长速率4.09±0.24 mm/d。菌丝主要沿培养基平铺生长,气生菌丝极少,菌丝有分隔及分枝,直径在2.44-4.15 μm之间,平均直径3.17 μm,纯培养25 d无任何孢子产生(图 2)。
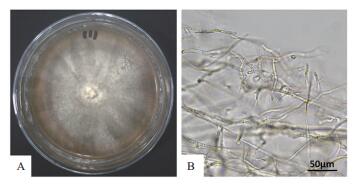
|
| 图 2 油菜菌核病拮抗真菌的菌落形态(A)和菌丝结构(B) |
提取该真菌的基因组DNA,利用ITS1和ITS4引物对其rDNA-ITS基因片段进行扩增,得到分子量约640 bp的单一扩增条带。测序后,在GenBank数据库中进行有效种的序列相似性搜索并对其进行分子鉴定,初步鉴定该菌株为多节孢属真菌Nodulisporium sp.。将序列提交至GenBank数据库,得到序列号KT719199。
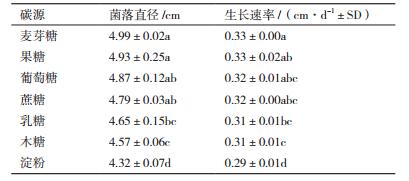
2.3 油菜菌核病拮抗真菌的生物学特性 2.3.1 最适碳源该油菜菌核病拮抗真菌在不同碳源培养基上纯培养15 d后的菌落直径和菌丝平均生长速率如表 1所示。可以看出,该菌株对碳源的要求不严格,在以麦芽糖、果糖、葡萄糖和蔗糖为碳源的培养基上长势最好,生长速率最快,且菌落直径和平均生长速率在4种碳源之间无显著差异。乳糖和木糖次之,而以淀粉作为碳源时长势最差,平均生长速率也最慢。
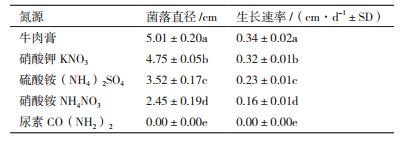
该油菜菌核病拮抗真菌在不同氮源培养基上纯培养15 d后的菌落直径和菌丝平均生长速率如表 2所示。结果表明,不同氮源对该菌株的长势及平均生长速率具有显著差异。其中最适氮源为牛肉膏,培养15 d后菌落直径最大,达到5.01 cm,平均生长速率0.34 cm/d。之后依次为硝酸钾、硫酸铵和硝酸铵,菌丝生长速率依次减慢。以尿素为氮源时效果最差,菌丝不生长,表明尿素对其菌丝生长有抑制作用。
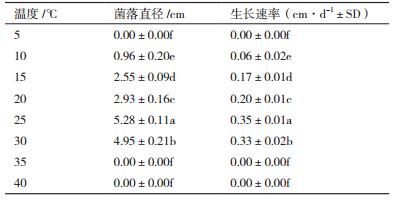
由表 3可知,温度能够显著影响该油菜菌核病拮抗真菌的生长。当温度低于10℃或高于30℃时,该真菌的菌丝生长将受到明显抑制。在10-30℃范围内能够正常生长,其中,25℃时的生长状况最好,是该真菌生长最适温度。
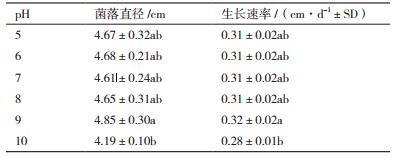
pH值对该油菜菌核病拮抗真菌生长的影响如表 4所示。可以看出,该菌株能够耐受较广的酸碱度范围,在pH5-10范围内均生长良好,其最适pH范围5-9,菌落直径和平均生长速率均无显著差异,在pH10条件下生长相对较差。
植物内生真菌是一个特殊的真菌类群,它们与植物互惠共生,能够提高植物对生物胁迫和非生物胁迫的抵抗能力。研究表明,植物内生真菌大多具有抗菌活性,存在抗菌活性物质,能够为寻找天然、安全的新型生防菌及新型抗菌药物提供丰富的潜在筛选源[8, 15-16]。本研究从羊耳蒜植株根部分离得到1株对油菜菌核病菌具有较强拮抗活性的内生真菌菌株,展现出较好的应用开发价值,表明羊耳蒜的内生真菌中蕴藏着潜在的具有抗菌活性的菌株资源。
据统计,植物内生真菌多数属于子囊菌门真菌,具有分布广、种类多的特点,据估计约有100万至数百万种内生真菌存在于高等植物细胞内或细胞间[17]。结合形态鉴定和ITS分子序列比对发现,本研究分离得到的对油菜菌核病菌具有拮抗作用的内生真菌隶属于子囊菌门粪壳菌纲炭角菌目炭角菌科的多节孢属,尚比对不到种。研究表明,多节孢属是具有潜在开发价值的真菌类群,其次生代谢产物丰富,且结构新颖的化合物种类较多,已发现的如生物碱、聚酮、萜及甾体等,部分具有显著生物活性[18-20]。本研究分离得到的多节孢属真菌对油菜菌核病菌具有较强的拮抗效果,表明其具有潜在的油菜菌核病生防能力,关于该真菌的分类学地位、抑菌生物活性物质和抑菌作用机制等都值得深入研究。
本研究采用单因素实验对该油菜菌核病拮抗真菌的体外培养条件进行优化,初步确定了该菌株的最适碳源、最适氮源、最佳培养温度和酸碱度,实验结果可以为后续的深入研究提供参考。
4 结论从兰科植物羊耳蒜根部分离并筛选得到1株对油菜菌核病菌具有较强拮抗作用的内生真菌,结合形态学特征和ITS分子序列分析将其鉴定为多节孢属Nodulisporium sp.。以麦芽糖、果糖、葡萄糖和蔗糖为碳源均能良好生长,最适氮源为牛肉膏,最适培养温度为25℃。在pH5-9范围内均生长良好。
| [1] |
王汉中. 我国油菜产业发展的历史回顾与展望[J]. 中国油料作物学报, 2010, 32(2): 300-302. |
| [2] |
张建忠, 绍兴华, 肖红艳. 油菜菌核病的发生与防治研究进展[J]. 南方农业学报, 2012, 43(4): 467-471. |
| [3] |
师俊玲, 堵国成, 陈坚. 盾壳霉在油菜菌核病菌生物防治中的应用[J]. 中国生物工程杂志, 2003, 23(4): 27-31. |
| [4] |
马炳田, 文成敬. 几种核盘菌菌核重寄生真菌生物防治潜能的研究[J]. 中国农学通报, 2002, 18(6): 38-63. |
| [5] |
杨立, 陈美兰, 邵爱娟, 等. 生防菌对药用植物土传病害的抗病机制及应用探讨[J]. 中国中药杂志, 2012, 37(21): 3188-3192. |
| [6] |
王艳红, 吴晓民, 朱艳萍, 等. 温郁金内生真菌Chaetomium globosum L18对植物病原菌的抑菌谱及拮抗机理[J]. 生态学报, 2012, 32(7): 2040-2046. |
| [7] |
丁婷, 孙微微, 王帅, 等. 杜仲内生真菌中抗玉米纹枯病活性菌株的筛选[J]. 植物保护, 2014(6): 29-35. |
| [8] |
赵欢. 药用植物内生真菌的研究进展[J]. 北方园艺, 2017(13): 170-175. |
| [9] |
文才艺, 吴元华, 田秀玲. 植物内生菌研究进展及其存在的问题[J]. 生态学杂志, 2004, 23(2): 86-91. |
| [10] |
任安芝, 高玉葆. 植物内生真菌——一类应用前景广阔的资源微生物[J]. 微生物学通报, 2001, 28(6): 90-93. |
| [11] |
姜怡, 杨颖, 陈华红, 等. 植物内生菌资源[J]. 微生物学通报, 2005, 32(6): 146-147. |
| [12] |
石晶盈, 陈维信, 刘爱媛. 植物内生菌及其防治植物病害的研究进展[J]. 生态学报, 2006, 26(7): 2395-2401. |
| [13] |
Cenis JL. Rapid extraction of fungal DNA for PCR amplification[J]. Nucleic Acids Research, 1992, 20(9): 2380. DOI:10.1093/nar/20.9.2380 |
| [14] |
White TJ, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]// Innis MA, Gelfand DH, Sninsky JJ, et al. PCR Protocols: a guide to methods and applications. USA: Academic Press, 1990: 315-322.
|
| [15] |
杨润亚, 冯培勇, 李清. 植物内生真菌农药活性的研究进展[J]. 农药, 2006, 45(7): 440-444. |
| [16] |
范黎. 植物内生真菌次级代谢产物抗菌机制分析[J]. 微生物学通报, 2016, 43(7): 1660. |
| [17] |
Rodriguez RJ, Jr WJ, Arnold AE, et al. Fungal endophytes: diversity and functional roles[J]. New Phytologist, 2009, 182(2): 314. DOI:10.1111/j.1469-8137.2009.02773.x |
| [18] |
郑启昌, 赵欢, 陈国栋, 等. 多节孢属真菌次生代谢产物研究进展[J]. 国际药学研究杂志, 2013, 40(6): 721-725. |
| [19] |
王高乾, 赵琴, 郑启昌, 等. 多节孢属Nodulisporium sp.真菌中一个新的生物碱类化合物[J]. 中国中药杂志, 2015, 40(13): 2598-2601. |
| [20] |
Wu ZC, Li DL, Chen YC, et al. A new isofuranonaphthalenone and benzopyrans from the endophytic fungus Nodulisporium sp. A4 from Aquilaria sinensis[J]. Helvetica Chimica Acta, 2010, 93(5): 920-924. |