2. 天津农学院食品科学与生物工程学院,天津300384
2. College of Food Science and Biotechnology, Tianjin Agricultural University, Tianjin 300384
漆酶(Laccase,EC 1.10.3.2)是一类含铜的多酚氧化酶,属于蓝色多铜氧化酶家族,由日本学者Yoshida[1]于1883年在日本漆树漆液中首次发现。漆酶能够降解酚类、芳胺类、羧酸、金属有机化合物等底物生成醌类化合物、羰基化合物和水[2],在食用菌栽培[3-5]、饮料加工[6]、生物制浆[7]、废水脱色[8-11]、食品安全[12]和环境保护[13]等方面具有广泛的应用潜力,已成为生物学、化学、环境科学等交叉领域的研究热点[14-15]。
大球盖菇(Stropharia rugosoannulata),又名皱环球盖菇、皱球盖菇、酒红色球盖菇,属于担子菌门、层菌纲、伞菌目、球盖菇科、球盖菇属[16]。大球盖菇含有蛋白质、糖类、矿物质、维生素等营养物质,人体必需氨基酸齐全,作为一种无污染的安全食品,不仅是国际菇类交易市场的十大菇类之一,也是联合国粮农组织向发展中国家推荐栽培的新菇种之一。
分泌漆酶的真菌主要集中于担子菌、子囊菌及半知菌等高等真菌[1],如灵芝[2]、黑木耳[17]、平菇[18]、灰树花[19]、白灵菇[20]、云芝[21-23]等,但不同种属产漆酶能力各不相同,其酶学性质也存在较大差异,目前大球盖菇产漆酶的报道较少。本研究从大球盖菇Sr-01菌株液体发酵液中分离到漆酶,对其进行酶学性质研究,旨在为其工业化生产与应用提供理论指导。
1 材料与方法 1.1 材料 1.1.1 菌株大球盖菇Sr-01菌株由天津市林业果树研究所食用菌研究室保藏。
1.1.2 培养基PDA培养基(g/L):马铃薯200,葡萄糖20,琼脂15,pH 5.5。液体发酵培养基(g/L):葡萄糖20 g,蛋白胨3 g,MgSO4 1 g,KH2PO4 2 g,pH 5.5。
1.1.3 试剂ABTS,美国Sigma公司;Q-Sepharose琼脂糖凝胶、Superdex 200葡聚糖凝胶,美国GE Healthcare公司;蛋白质分子量标准Marker,宝生物工程(大连)有限公司;其它试剂均为国产分析纯。
1.1.4 仪器电子天平(BS224S型):北京赛多利斯仪器系统有限公司;pH计(PHS-3C型):上海精密科学仪器有限公司;卧式恒温摇床(HNY-211C型):天津欧诺仪器股份有限公司;紫外可见分光光度计(TU-1810型):北京普析通用仪器有限责任公司;高速冷冻离心机(GL-20C型):上海安亭科学仪器厂;电热恒温水浴锅(DK-320S型):上海精宏实验设备有限公司;蛋白凝胶电泳仪(DYCZ-24DN型):北京市六一仪器厂;全波长酶标仪(Multiskan FC型):美国Thermo Scientific公司。
1.2 方法 1.2.1 粗酶液的制备菌株活化:将供试菌株从试管斜面接入PDA固体平板,28℃培养6 d。发酵培养:取已活化的菌株,用打孔器切取直径1 cm的菌饼3块,接入装有100 mL发酵培养基的250 mL三角瓶中,28℃、150 r/min培养6 d。发酵结束后,4℃、10 000 r/min离心20 min,取上清,即粗酶液。
1.2.2 分离纯化 1.2.2.1 硫酸铵分级沉淀向粗酶液中加入(NH4)2 SO4至30%饱和度,4℃静置2 h,10 000 r/min离心20 min,取上清,继续加入(NH4)2 SO4至70 %饱和度,4℃静置2 h,10 000 r/min离心20 min,取沉淀,重悬于去离子水,置于MW 3500的透析袋中,4℃透析12 h,每隔4 h换1次水,10 000 r/min离心20 min,取上清,冷冻干燥,即粗蛋白[17]。
1.2.2.2 Q-Sepharose阴离子交换层析将样品重悬于50 mmol/L Tris缓冲液(pH 8.0),10 000 r/min离心10 min,取上清,上样于50 mmol/L Tris缓冲液(pH 8.0)已平衡的Q-Sepharose阴离子交换层析柱,先用50 mmol/L Tris缓冲液(pH 8.0)洗脱未吸附蛋白,再用含0-1 mol/L NaCl的50 mmol/L Tris缓冲液(pH 8.0)梯度洗脱,流速1.0 mL/min,收集洗脱液,每管1.0 mL,测定各洗脱峰的漆酶活性。
1.2.2.3 Superdex 200凝胶过滤层析用含500 mmol/L NaCl的50 mmol/L Tris缓冲液(pH 8.0)平衡Superdex 200凝胶过滤层析柱,将经Q-Sepharose阴离子交换层析的活性组分浓缩至2.0 mL,上样,用含500 mmol/L NaCl的50 mmol/L Tris(pH 8.0)缓冲液洗脱,流速1.0 mL/min,收集洗脱液,每管1.0 mL,测定各洗脱峰的漆酶活性。
1.2.3 酶学性质研究 1.2.3.1 最适反应温度和热稳定性将反应体系在不同温度下(10-80℃)处理5 min,测定漆酶活性,每组3个重复,以活力最高值为100%,计算其它温度下的相对酶活。将反应体系在不同温度下(10-80℃)处理60 min,测定漆酶活性,每组3个重复,以各温度下初始活力为100%,计算处理后残余活力。
1.2.3.2 最适反应pH和pH稳定性将反应体系分别置于pH 2.0-8.0缓冲液中,35℃处理5 min,测定漆酶活性,每组3个重复,以活力最高值为100%,计算其它pH下的相对酶活。将反应体系分别置于pH 2.0-8.0的缓冲液中处理60 min,测定漆酶活性,每组3个重复,以各pH下初始活力为100%,计算处理后的残余活力。
1.2.3.3 金属离子对酶活的影响在反应体系中分别添加终浓度为0.5 mmol/L的不同金属离子(Na+、K+、Mg2+、Ca2+、Mn2+、Fe2+、Cu2+、Zn2+、Cd2+、Hg2+),每组3个重复,35℃处理5 min,测定漆酶活性,以金属离子未处理的酶活力为100%,计算添加金属离子后的相对酶活。
1.2.4 指标测定 1.2.4.1 活性测定采用ABTS法[2]。2 mL反应体系,含0.5 mmol/L ABTS溶液(pH 5.0、0.1 mmol/L的HAc-NaAc缓冲液配制)1.9 mL,样品0.1 mL,以去离子水为空白对照,30℃反应5 min,420 nm波长处测吸光值。1个酶活力单位(U)定义为1 min氧化1 μmol/L底物ABTS所需的酶量。
1.2.4.2 相对分子质量测定采用SDS-PAGE法[24]。分离胶浓度12%,浓缩胶浓度5%,上样量10 μL。根据已知相对分子质量的标准蛋白Marker在SDS-PAGE中的相对迁移率,估计漆酶的相对分子质量。
1.2.5 数据处理所有试验均设3个重复,试验数据以平均值±标准偏差表示,采用SPSS 17.0软件进行数据分析。
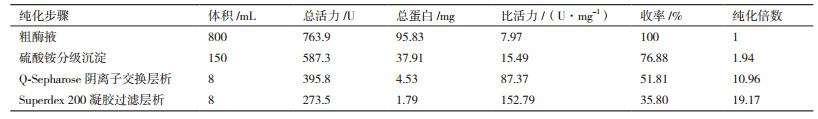
2 结果 2.1 分离纯化由图 1可知,粗蛋白经Q-Sepharose阴离子交换柱层析梯度洗脱后出现1个穿透峰(QF)和5个洗脱峰(QE1-5),5个洗脱峰所对应的NaCl浓度分别为0.1、0.2、0.4、0.6和0.8 mol/L,测定酶活发现活性组分集中在第2个洗脱峰,即洗脱至30 min时出现的吸收峰QE2具有漆酶活性。
|
| 图 1 Q-Sepharose阴离子交换层析洗脱曲线 |
由图 2可知,阴离子交换层析后得到的活性组分QE2经Superdex 200凝胶过滤层析后出现4个洗脱峰(SE1-4),测定酶活发现活性组分集中在第3个洗脱峰,即洗脱至80 min时出现的吸收峰SE3具有漆酶活性。

|
| 图 2 Superdex 200凝胶过滤层析洗脱曲线 |
纯化后的漆酶经SDS-PAGE检测,结果(图 3)显示为单一条带,表明样品已达到电泳纯,其相对分子质量约40 kD,凝胶过滤层析结果也显示相似的分子量,表明该漆酶为单体蛋白。

|
| 图 3 SDS-PAGE检测 SE1-4:Superdex 200凝胶过滤层析纯化后的馏分;M:标准分子量蛋白Marker |
漆酶分离纯化结果如表 1所示,纯化后的漆酶比活力为152.79 U/mg,回收率为35.8%。
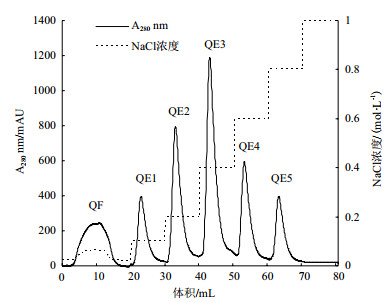
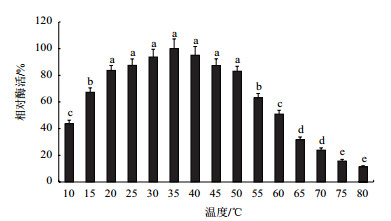
由图 4可知,大球盖菇漆酶在35℃时活性最高,在20-50℃范围内表现出较高活性,相对酶活保持在80%以上。高于70℃时,酶活显著降低,这可能是因为高温导致蛋白变性而使其失活。因此,该漆酶的最适反应温度为35℃,适宜在较温和条件下反应。由图 5可知,大球盖菇漆酶在10-40℃范围内表现出较好的稳定性,相对酶活保持在80%以上。随着温度升高,酶活逐渐降低,高于70℃时,漆酶已完全失活。因此,该漆酶对高温比较敏感,不适宜在高温条件下贮存。
|
| 图 4 温度对漆酶活性的影响 不同字母表示处理间差异显著(P < 0.05),下同 |
|
| 图 5 温度对漆酶稳定性的影响 |
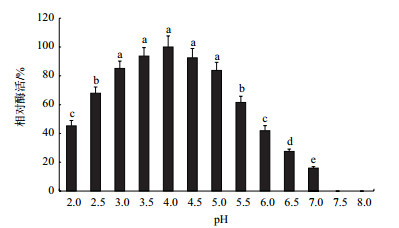
由图 6可知,大球盖菇漆酶在pH 4.0时活性最高,在pH 3.0-5.0范围内表现出较高的活性,相对酶活保持在80%以上。当pH小于3.0或大于5.0时,随着pH降低或升高,酶活逐渐降低,当pH大于7.0时,漆酶已完全失活。因此,该漆酶的最适反应pH为4.0,适宜在弱酸性条件下反应。由图 7可知,大球盖菇漆酶在pH 3.0-5.0范围内表现出较好的稳定性,相对酶活保持在80%以上。当pH小于3.0或大于5.0时,随着pH降低或升高,酶活逐渐降低。因此,该漆酶适宜在弱酸性条件下贮存。
|
| 图 6 pH对漆酶活性的影响 |

|
| 图 7 pH对漆酶稳定性的影响 |
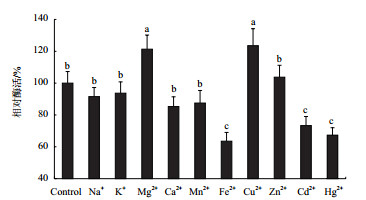
与空白对照相比,Mg2+、Cu2+、Zn2+对酶活有激活作用,其中Cu2+的激活作用最显著,使酶活提高23.5%;其它金属离子对酶活均表现出不同程度的抑制作用,其中Fe2+、Cd2+、Hg2+的抑制作用最显著,相对酶活分别为对照组的63.5%、73.3%、67.3%,而K+、Na+、Ca2+、Mn2+对酶活抑制作用较小(图 8)。
|
| 图 8 金属离子对漆酶活性的影响 |
根据温度、pH、金属离子的最适反应条件,在35℃、pH4.0、0.5 mmol/L Cu2+存在的条件下,对纯化后的漆酶进行活性测定,比活力可达222.93 U/mg,比优化前提高45.9%。
3 讨论大球盖菇作为一种新兴的珍稀优质食用菌,具有广阔的开发潜力和市场前景。但是,由于我国引种栽培较晚,国内有关研究较少,已有研究主要集中在育种、栽培等方面,对其活性成分的报道较少。因此,大球盖菇中活性蛋白及其功能的探讨与研究,对于蛋白质资源的开发与利用具有重要意义。
本研究采用硫酸铵分级沉淀、Q-Sepharose阴离子交换层析、Superdex 200凝胶过滤层析,从大球盖菇发酵液中分离到相对分子质量约40 kD的漆酶,其中所涉及的分离纯化方法与其他学者采用的技术手段类似,如翁彩红等[2]采用硫酸铵分级沉淀、DEAE-Sepharose离子交换层析,从松杉灵芝发酵液中分离到52 kD的漆酶。韩增华等[17]通过硫酸铵分级沉淀、DEAE-Sephacel离子交换层析,从黑木耳发酵液中分离到19 kD的漆酶LacC。马茜茜等[25]采用DEAE-cellulose、CM-cellulose和Q-Sepharose离子交换层析、Superdex 75凝胶过滤层析,从云芝发酵液中分离到67 kD的漆酶。陈晓平等[26]采用盐析、DEAE-Agarose离子交换层析、Sephadex G-100葡聚糖凝胶层析,从桑黄发酵液中分离到69.3 kD的漆酶。
食用菌漆酶的酶学性质在不同种属间差异较大,大多数食用菌漆酶的最适反应温度在25-50℃之间,最适pH值在4.0-6.0之间[1, 27]。如肖楚等[28]研究发现黑木耳漆酶的最适温度为45℃,最适pH值为4.0,姚良同等[29]研究发现滑菇漆酶的最适反应温度为30℃,最适反应pH值为4.8。但赵晓燕等[30]研究发现灰树花漆酶的最适反应温度和pH分别为65℃和2.2,佟硕秋等[19]研究表明灰树花漆酶催化ABTS的最适pH值为3.0,55℃时活性最高。
本研究中大球盖菇漆酶催化ABTS的最适反应温度为35℃,在低于40℃条件下处理60 min,相对酶活仍保持在80%以上。少数食用菌漆酶具有耐高温性,如韩增华等[17]研究发现黑木耳漆酶LacC的最适反应温度为55℃,窦隆等[18]研究发现糙皮侧耳漆酶的最适反应温度为63℃。
大多数食用菌漆酶在酸性pH值下催化效率较高[16, 20],且不同来源的漆酶最适pH范围不同。本研究中大球盖菇漆酶的最适反应pH值为4.0,在pH 3.0-5.0范围内处理60 min,相对酶活仍保持在80%以上,表明该漆酶为酸性蛋白,不适宜在过酸或偏碱的条件下反应。
大多数金属离子均可影响漆酶活性[27]。本研究发现Mg2+、Cu2+、Zn2+对大球盖菇漆酶具有激活作用,其中Cu2+激活作用最显著,而Fe2+、Cd2+、Hg2+则有显著抑制作用。因此,在生产应用中应严格控制反应体系中Fe2+、Cd2+、Hg2+的存在。
4 结论通过硫酸铵分级沉淀、Q-Sepharose阴离子交换层析、Superdex 200凝胶过滤层析,从大球盖菇Sr-01菌株液体发酵液中分离到相对分子质量约40 kD的漆酶,最适反应温度为35℃,在10-40℃范围内具有良好的稳定性,最适pH值为4.0,在pH 3.0-5.0范围内具有良好的稳定性,Mg2+、Cu2+、Zn2+对酶活有激活作用,Fe2+、Cd2+、Hg2+对酶活有显著抑制作用。
| [1] |
刘家扬, 焦国宝, 有小娟, 等. 真菌漆酶的性质、生产及应用研究进展[J]. 生物技术通报, 2016, 32(4): 24-33. |
| [2] |
翁彩红, 冯宏昌, 赖春芬. 松杉灵芝漆酶的分离纯化及酶学性质研究[J]. 药物生物技术, 2017, 24(1): 21-26. |
| [3] |
Montoya S, Orrego CE, Levin L. Growth, fruiting and lignocellulolytic enzyme production by the edible mushroom Grifola frondosa (maitake)[J]. World J Microbiol Biotechnol, 2012, 28(4): 1533-1541. DOI:10.1007/s11274-011-0957-2 |
| [4] |
Janusz G, Czuryło A, Frąc M, et al. Laccase production and metabolic diversity among Flammulina velutipes strains[J]. World J Microbiol Biotechnol, 2015, 31(1): 121-133. DOI:10.1007/s11274-014-1769-y |
| [5] |
韩美玲, 安琪, 等. 不同木质纤维素诱导对糙皮侧耳液体发酵产漆酶活性的影响[J]. 菌物学报, 2017, 36(3): 349-357. |
| [6] |
Lettera V, Pezzella C, Cicatiello P, et al. Efficient immobilization of a fungal laccase and its exploitation in fruit juice clarification[J]. Food Chemistry, 2016, 196(196): 1272-1278. |
| [7] |
Sharma A, Thakur VV, Shrivastava A, et al. Xylanase and laccase based enzymatic kraft pulp bleaching reduces adsorbable organic halogen(AOX)in bleach effluents: a pilot scale study[J]. Bioresource Technology, 2014, 169(169): 96-102. |
| [8] |
Zhu MJ, Du F, et al. Purification a laccase exhibiting dye decoloriz-ing ability from an edible mushroom Russula virescens[J]. Intern-ational Biodeterioration & Biodegradation, 2013, 8(82): 33-39. |
| [9] |
司静, 崔宝凯, 戴玉成. 东方栓孔菌在染料脱色中的应用及其脱色条件的优化[J]. 基因组学与应用生物学, 2011, 30(3): 364-371. |
| [10] |
司静, 崔宝凯, 贺帅, 等. 微酸多年卧孔菌产漆酶条件优化及其在染料脱色中的应用[J]. 应用与环境生物学报, 2011, 17(5): 736-741. |
| [11] |
Polak J, et al. Fungal laccases as green catalysts for dye synthesis[J]. Process Biochemistry, 2012, 47(9): 1295-1307. DOI:10.1016/j.procbio.2012.05.006 |
| [12] |
张初署, 孙杰, 等. 食用菌SJ-1漆酶酶学性质及降解黄曲霉毒素B1的研究[J]. 核农学报, 2017, 31(7): 1317-1322. DOI:10.11869/j.issn.100-8551.2017.07.1317 |
| [13] |
Rigas F, Papadopoulou K, Philippoussis A, et al. Bioremediation of lindane contaminated soil by Pleurotus ostreatus in non sterile conditions using multilevel factorial design[J]. Water Air & Soil Pollution, 2009, 197(1-4): 121-129. |
| [14] |
Cañas AI, Camarero S. Laccases and their natural mediators: biotechnological tools for sustainable eco-friendly processes[J]. Biotechnol Adv, 2010, 28(6): 694-705. DOI:10.1016/j.biotechadv.2010.05.002 |
| [15] |
Rivera-Hoyos CM, Morales-álvarez ED, et al. Fungal laccases[J]. Fungal Biology Reviews, 2013, 2(3-4): 67-82. |
| [16] |
萨仁图雅, 图力古尔. 大球盖菇研究进展[J]. 食用菌学报, 2005, 12(4): 57-64. |
| [17] |
韩增华, 刘佳宁, 党阿丽, 等. 黑木耳漆酶纯化及部分漆酶特性的研究[J]. 菌物研究, 2012, 10(4): 234-239. |
| [18] |
窦隆, 陈莎, 等. 糙皮侧耳P5漆酶酶学性质的初步研究[J]. 长江大学学报:自然科学版, 2015, 12(3): 61-64. |
| [19] |
佟硕秋, 王宝琴, 刘凤玉, 等. 灰树花漆酶的酶学性质及其脱色作用研究[J]. 山东化工, 2015, 44(6): 34-38. |
| [20] |
杨娟, 邹亚杰, 张瑞颖, 等. 白灵侧耳漆酶分离纯化及其酶学性质研究[J]. 菌物学报, 2015, 34(3): 456-464. |
| [21] |
郑飞, 孟歌, 安琪, 等. 白腐真菌东方栓孔菌在两种液体培养基中产漆酶过程的生理学研究[J]. 菌物学报, 2017, 36(5): 582-597. |
| [22] |
司静, 崔宝凯, 等. 栓孔菌属漆酶高产菌株的初步筛选及其产酶条件的优化[J]. 微生物学通报, 2011, 38(3): 405-416. |
| [23] |
Si J, Peng F, Cui BK. Purification, biochemical characterization and dye decolorization capacity of an alkali-resistant and metal-tolerant laccase from Trametes pubescens[J]. Bioresource Technology, 2013, 128(51): 49-57. |
| [24] |
郭尧君. 蛋白质电泳实验技术[M]. 北京: 科学出版社, 2005, 第2版.
|
| [25] |
马茜茜, 李淼, 王贺祥. 云芝漆酶的分离纯化和理化性质及抗增殖活性[J]. 食用菌学报, 2010, 17(2): 43-51. |
| [26] |
陈晓平, 郝鑫, 马吉霞. 桑黄漆酶发酵条件的优化及其分离纯化[J]. 食品与发酵科技, 2013, 40(6): 22-26. |
| [27] |
张鹏, 王延锋, 潘春磊, 等. 食用菌漆酶生物学性质及其应用研究进展[J]. 生物技术通报, 2014, 32(9): 39-44. |
| [28] |
肖楚, 刘佳, 许修宏. 黑木耳漆酶酶学性质的研究[J]. 中国农学通报, 2011, 27(25): 158-161. |
| [29] |
姚良同, 魏玮, 张建军, 等. 滑菇Pholiota nameko SW-01菌株产漆酶营养条件及部分酶学性质研究[J]. 安徽农业科学, 2014, 42(4): 969-971. |
| [30] |
赵晓燕, 邢增涛, 邵毅, 等. 灰树花漆酶酶学性质的初步研究[J]. 天然产物研究与开发, 2012, 24(6): 824-827. |