白灵侧耳(Pleurotus tuoliensis)是我国具有自主知识产权的珍稀食用菌品种[1-2]。野生白灵侧耳主要寄生或腐生于伞形花科植物阿魏的根茎,在我国白灵菇仅产于新疆木垒、青河、托里、塔城和阿勒泰等地[3]。20世纪90年代我国实现人工栽培,商品名白灵菇[4]。白灵侧耳子实体色泽洁白,风味独特,被誉为草原上的牛肝菌[5]。白灵侧耳营养丰富,且有很高的药用价值,其多糖具有抗肿瘤[6]、增强机体免疫力[7]、抗氧化、降血脂[8]和改善心脑血管疾病[9]等功效。但由于白灵菇生长周期长、出菇整齐度差、畸形菇比例高等问题制约产业发展[10]。探索参与白灵菇子实体发育形成的基因能够为分子辅助育种提供有效、快速标记,为选育出具有优良性状的白灵菇菌株奠定基础。
白灵菇子实体发育相关基因研究进展缓慢,陈苗苗等[11]通过mRNA差异显示技术筛选白灵菇菌丝和原基两个不同发育时期的差异,获得了8个差异片段,分别与细胞色素P450、糖基转移酶、扩展蛋白、糖苷水解酶家族3、核糖体蛋白L29、高半胱氨酸甲基转移酶和未知蛋白具有同源性;Fu等[12]通过比较转录组分析了白灵侧耳在后熟菌丝期、冷刺激的菌丝期、原基期和子实体形成期4个生长不同阶段基因的表达情况,筛选出了不同时期的差异表达基因,主要涉及形态发生、基础碳代谢、冷刺激和蓝光反应相关基因。
本实验室前期将白灵菇10号(JZB2106010)通过原生质体单核化获得两个不同极性的单核体后进行自交,获得一株具有锁状联合、菌丝洁白浓密的双核自交菌株45×49(JZB2106103)[13]。出菇实验表明JZB2106010能够形成子实体,而JZB2106103不形成子实体。因此,JZB2106010和JZB2106103是挖掘白灵菇子实体发育相关基因的优良实验材料。本实验分别对白灵菇菌株JZB2106010和JZB2106103进行了转录组测序,获得了转录组数据,对部分差异表达基因进行荧光定量PCR验证,发现了文献报道之外的基因参与了白灵菇的子实体发育。
1 材料与方法 1.1 材料 1.1.1 菌株白灵菇10号(JZB2106010)和白灵菇自交菌株45×49(JZB2106103)由北京市农林科学院植物保护环境保护研究所提供。
1.1.2 试剂SYBR Premix Ex Taq Ⅱ购自宝生物工程(大连)有限公司,RNase-Free DNase Set和RNeasy Mini kit购自Qiagen公司,琼脂糖购自Sigma公司,PDB和PDA培养基购自Difco公司,Revert Aid First stand cDNA synthesis kit购自Thermo公司,所用引物在生工生物工程(上海)股份有限公司合成
1.2 方法 1.2.1 RNA的提取JZB2106010和JZB2106103在PDB液体培养基中培养12 d,过滤收集菌丝,采用RNeasy Mini kit提取RNA,RNase-Free DNase Set消化残余的DNA。通过琼脂糖电泳和Nanodrop检测RNA的完整性,OD260/280为1.8-2.2之间,28S:18S≥1。
1.2.2 转录组测序用Oligo(dT)25磁珠进行mRNA的纯化;mRNA破碎后,反转录合成第一链和第二链,构建测序文库,利于cluster station制备测序样品簇,Hiseq2000上机测序,每个菌株测定1个样品。
1.2.3 生物信息学分析数据过滤原始数据后,采用Trinity软件进行序列组装,利于Blast进行Unigene的比对;对Unigene进行GO注释及功能分类统计;将Unigene和COG数据库比对分析及功能分类统计;在KEGG网站进行代谢通路的分析;采用FPKM法进行基因表达量计算,进行基因差异表达分析。
1.2.4 荧光定量PCR(qPCR)按照1.2.1进行RNA的提取以及DNA的消化,采用Revert Aid First stand cDNA synthesis kit进行反转录成cDNA,进行荧光定量PCR,反应体系如下:上下游引物各10 pmol,cDNA 1 µL,SYBR Premix Ex Taq Mix 10 µL,RoxⅡ 0.4 µL,ddH2O补充水至20 µL。ABI7500进行荧光定量PCR检测。每个样品3个重复。
2 结果 2.1 转录组测序及数据组装注释白灵侧耳JZB2106010和JZB2106103菌株采用Hiseq2000进行了转录组测序,采用Trinity进行序列的组装拼接。JZB2106010获得26 136个Unigene,JZB2106103获得27 753个Unigene,共计获得30 125个Unigene。通过blastx将Unigene序列比对到蛋白数据库NR、Swiss-Prot、KEGG和COG(evalue < 0.00001),并通过blastn将Unigene比对到核酸数据库Nt(evalue < 0.00001),得到跟给定Unigene具有最高序列相似性的蛋白,从而得到该Unigene的蛋白功能注释信息。共计22 923个Unigene能够比对到NR数据库,占Unigene基因总数的76.1%。
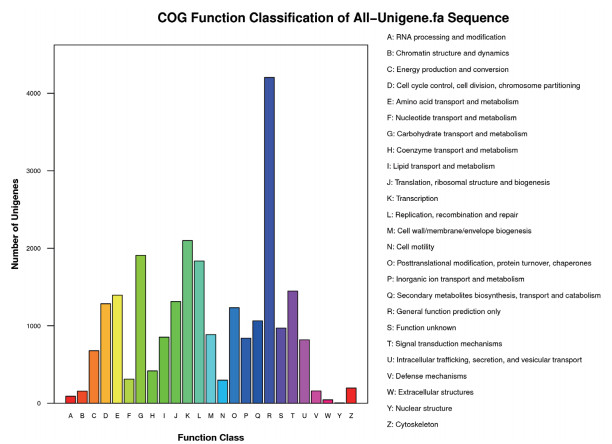
2.2 Unigene的GO和COG分类对Unigene进行GO功能注释和分类,在生物过程(Biological process)、细胞组成(Cellular component)和分子功能(Molecular function)3个本体中,分别获得15 821、8 250和10 647个注释条目。COG是对基因产物进行直系同源分类的数据库,对白灵菇的Unigene进行了功能分类,其中4 203个Unigene被归在了R类(General function prediction only),占Unigene总数的17.1%;其中2099个Unigene被归在了K类(Transcription),占Unigene总数的8.6%(图 1)。
|
| 图 1 COG功能注释 |
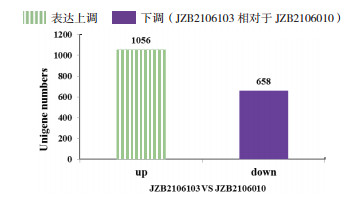
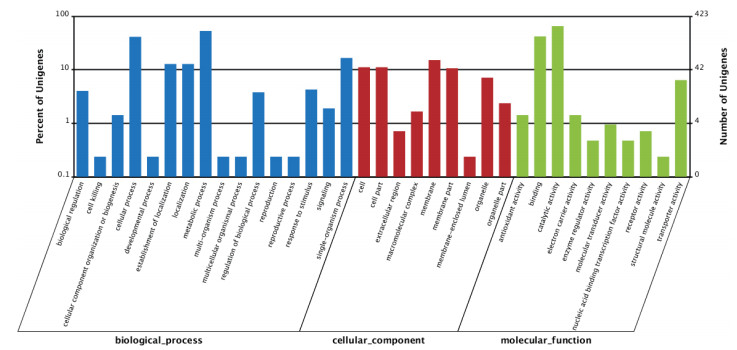
由图 2可知,白灵侧耳JZB2106103相对于JZB2106010有1 056个Unigene表达量上调,658个Unigene表达量下调。对差异表达基因进行GO功能分析,结果(图 3)显示在生物过程中差异基因数目最多的是代谢过程(Metabolic process),共计224个基因;细胞组成中差异基因数目最多的是细胞膜(Membrane),共计64个基因;分子功能中差异基因最多的是催化活性(Catalytic activity)共计276个基因。
|
| 图 2 白灵侧耳JZB2106010和JZB2106103的基因差异表达 |
|
| 图 3 白灵侧耳JZB2106010和JZB2106103的差异表达基因功能分类 |
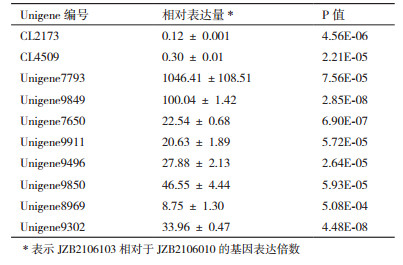
选取代谢过程(metabolic process)和催化活性(catalytic activity)中部分差异表达量显著的基因进行荧光定量PCR验证,同时也选取白灵菇JZB2106010和JZB2106103差异表达量最大的Unigene7793进行验证(引物设计见表 1)。从图 3中可以看出Unigene7793、Unigene7650、Unigene9911、Unigene9496、Unigene9850、Unigene8969、Unigene9302、Unigene9849在不形成子实体的白灵菇JZB2106103中比JZB2106010表达显著上调,其中Unigene7793的表达量上调幅度大,为1 046.41倍,Unigene8969基因表达量上调幅度在供试基因中最低,为8.75倍;CL4509和CL2173在JZB2106010表达显著上调,分别是JZB2106103的3.33倍和8.33倍(表 2)。结果显示CL4509和CL2173的高表达利于白灵侧耳子实体的发育,而其他8个基因的低表达有利于白灵侧耳子实体的发育。
食用菌子实体发育相关基因的研究是一项复杂且具有重要理论和实际意义的工作[14]。在食用菌中常通过分析菌丝期和子实体形成期基因差异表达情况分析与子实体发育相关的基因,包括mRNA差异显示技术[15]、转录组技术、双向电泳技术[16]和蛋白质组分析[17]等。其中转录组技术优势显著,该方法无需预先设计特异性探针,因此无需了解物种基因或基因组信息,直接对任何物种进行最全面的转录组分析,且高通量测序成本的降低为全局考虑食用菌子实体形成的基因表达状态及调控提供便利。
近年来利用转录组测序在挖掘食用菌子实体发育相关基因上取得了一定的进展。Fu等[12]通过比较转录组分析了白灵菇在后熟菌丝期、冷刺激的菌丝期、原基期和子实体形成期4个生长不同阶段基因的表达情况,筛选出了不同时期的差异表达基因,主要涉及形态发生、基础碳代谢、冷刺激和蓝光反应相关基因。Tao等[18]分别采集了草菇生长发育不同阶段的样品进行转录组测序,菌丝体到原基期共得到1 503个差异表达基因,子实体形成的蛋形期到伸长期具有1 367个差异基因,通过对差异基因进行功能富集和代谢途径分析表明,在原基期上调表达的基因主要涉及到对细胞和代谢过程的调节,下调的基因参与的主要生物过程为细胞组分的生物合成;蛋形期到伸长期显著下调的是参与细胞分裂的基因。Yu等[19]对灵芝菌丝和子实体进行了转录组测序,在菌丝生长阶段表达上调的是生物合成相关的基因,如氨基酸代谢合成,ATP合成等,而相反的在子实体阶段与降解相关的基因表达上调,同时电子传递、能量代谢相关的基因在子实体中的表达量也上调。Zhou等[20]同样采用转录组测序分析了毛木耳菌丝与子实体发育不同阶段的基因差异表达,结果表明homeobox类型的转录因子在子实体中表达上调,而锌指类转录因子在菌丝中表达上调,裂褶菌中具有同样的结果。
本实验首次分别以能够正常形成子实体的白灵菇双核菌株JZB2106010和不能够形成子实体的白灵菇双核菌株JZB2106103为实验材料,通过转录组测序获得了两株菌基因差异表达数据,并进行富集分析,获得了一些与白灵侧耳子实体发育相关的基因,包括文献已经报道的基因(如碳代谢相关基因),JZB2106010和JZB2106103中具有表达差异的基因有22个,包括CL3723.Contig1、CL3291.Contig1、Unigene1780等;选取部分表达量差异显著的基因进行荧光定量PCR验证,获得了一些之前文献未报道过的与白灵侧耳子实体发育相关的基因。JZB2106010和JZB2106103中基因表达差异最大的Unigene7793,编码ATP依赖的DNA解旋酶,解旋酶是一类参与核酸代谢的重要保守酶类,如核酸复制、重组、修复和转录等[21],本实验结果表明DNA解旋酶基因的表达与子实体发育呈负相关。类苯丙烷类在维管植物的生长、发育中是必需的,苯丙氨酸裂解酶(PAL)是类苯丙烷类代谢途径的第一步,参与黄酮类、苯丙烷类和木质素等物质的合成[22],本实验结果也发现了PAL与白灵侧耳的子实体发育相关;乙醇氧化酶参与了真菌木质素的降解[23],在能够形成子实体的白灵侧耳中乙醇氧化酶基因表达量显著提高,也说明它与白灵侧耳子实体的发育相关。本研究发现的与白灵侧耳子实体发育相关基因为白灵侧耳的分子遗传育种奠定基础,后续应进一步明确基因功能以及遗传性状之间的关系。
4 结论本实验以JZB2106010和JZB2106103为实验材料,进行转录组测序,获得了两个菌株的差异表达基因并进行了功能富集分析,其中催化活性和代谢过程本体中差异基因数目最多,选取部分表达差异显著的基因通过荧光定量PCR进行验证,结果显示编码苯丙氨酸裂解酶的基因(CL4509)和编码乙醇氧化酶的基因(CL2173)在JZB2106010中表达量显著提高,与白灵侧耳的子实体发育相关;另外还发现一个编码DNA解旋酶的基因(Unigene7793)在JZB2106103中的表达量是JZB2106010的1046倍,实验结果表明该基因的大量表达是JZB2106103不能结实的一个原因。
| [1] |
谭笑, 滕立平, 路杨, 等. 白灵侧耳(白灵菇)杂交育种研究进展[J]. 菌物研究, 2015, 13(3): 175-180. |
| [2] |
Zhao M, Zhang J, Chen Q, et al. The famous cultivated mushroom Bailinggu is a separate species of the Pleurotus eryngii species complex[J]. Scientific Reports, 2016, 6: 33066. DOI:10.1038/srep33066 |
| [3] |
冯作山, 胡清秀, 张瑞颖, 等. 白灵侧耳研究进展[J]. 食用菌学报, 2010, 17(3): 73-77. |
| [4] |
Fu YP, Liang Y, Dai YT, et al. De Novo sequencing and transcriptome analysis of Pleurotus eryngii subsp. tuoliensis(Bailinggu)mycelia in response to cold stimulation[J]. Molecules, 2016, 21(5): pii: E560. DOI:10.3390/molecules21050560 |
| [5] |
许峰, 刘宇, 王守现, 等. 北京地区白灵菇菌株的RAPD分析[J]. 生物技术, 2010, 20(4): 21-23. |
| [6] |
Cha YJ, Alam N, Lee JS, et al. Anticancer and immunopotentiating activities of crude polysaccharides from Pleurotus nebrodensis on mouse sarcoma 180[J]. Mycobiology, 2012, 40(4): 236-243. DOI:10.5941/MYCO.2012.40.4.236 |
| [7] |
Wang C, Cui H, Wang Y, et al. Bidirectional immunomodulatory activities of polysaccharides purified from Pleurotus nebrodensis[J]. Inflammation, 2014, 37(1): 83-93. DOI:10.1007/s10753-013-9714-z |
| [8] |
Ren Z, Li J, Xu N, et al. Anti-hyperlipidemic and antioxidant effects of alkali-extractable mycelia polysaccharides by Pleurotus eryngii var. tuolensis[J]. Carbohydr Polym, 2017, 175: 282-292. DOI:10.1016/j.carbpol.2017.08.009 |
| [9] |
Yan B, Jing L, Wang J, et al. A polysaccharide(PNPA)from Pleurotus nebrodensis offers cardiac protection against ischemia-reperfusion injury in rats[J]. Carbohydr Polym, 2015, 133: 1-7. DOI:10.1016/j.carbpol.2015.06.076 |
| [10] |
张金霞, 黄晨阳, 张瑞颖, 等. 白灵菇中农1号特征特性和栽培技术要点[J]. 食用菌学报, 2010(3): 87-89. |
| [11] |
陈苗苗, 黄晨阳, 陈强, 等. 白灵侧耳结实相关基因片段的筛选与分析[J]. 生物技术, 2013, 23(3): 4-8. |
| [12] |
Fu Y, Dai Y, Yang C, et al. Comparative transcriptome analysis identified candidate genes related to Bailinggu mushroom formation and genetic markers for genetic analyses and breeding[J]. Scientific Reports, 2017, 7(1): 9266. DOI:10.1038/s41598-017-08049-z |
| [13] |
李莎, 刘宇, 等. 原生质体单核化技术在白灵菇菌种提纯复壮中的作用[J]. 江苏农业科学, 2015, 43(5): 248-250. |
| [14] |
申进文, 粱思思, 邱立友, 等. 糙皮侧耳子实体发育相关基因fst3的克隆及分析[J]. 食用菌学报, 2015, 22(1): 15-20. |
| [15] |
季哲, 李玉祥, 赵明文, 等. 运用mRNA差异显示技术研究黄伞发育相关基因[J]. 菌物学报, 2007, 26(2): 243-248. |
| [16] |
陈美元. 双孢蘑菇子实体原基与菇蕾蛋白质表达变化分析[J]. 食用菌学报, 2012, 19(3): 15-20. |
| [17] |
陈美元, 廖剑华, 李洪荣, 等. 双孢蘑菇子实体发育不同阶段蛋白质组分析[J]. 菌物学报, 2015, 34(6): 1153-1164. |
| [18] |
Tao Y, van Peer AF, Chen B, et al. Gene expression profiling reveals large regulatory switches between succeeding stipe stages in Volvariella volvacea[J]. PLoS One, 2014, 9(5): e97789. DOI:10.1371/journal.pone.0097789 |
| [19] |
Yu GJ, Wang M, Huang J, et al. Deep Insight into the Ganoderma lucidum by comprehensive analysis of its transcriptome[J]. PLoS One, 2012, 7(8): e44031. DOI:10.1371/journal.pone.0044031 |
| [20] |
Zhou Y, Chen L, Fan X, et al. De novo assembly of Auricularia polytricha transcriptome using Illumina sequencing for gene discovery and SSR marker identification[J]. PLoS One, 2014, 9(3): e91740. DOI:10.1371/journal.pone.0091740 |
| [21] |
Limudomporn P, Moonsom S, Leartsakulpanich U, et al. Characterization of Plasmodium falciparum ATP-dependent DNA helicase RuvB3[J]. Malaria Journal, 2016, 15(1): 526. DOI:10.1186/s12936-016-1573-2 |
| [22] |
Purwar S, Sundaram S, Sinha S, et al. Expression and in silico characterization of Phenylalanine ammonium lyase against karnal bunt(Tilletia indica)in wheat(Triticum aestivum)[J]. Bioinformation, 2013, 9(20): 1013-1018. DOI:10.6026/bioinformation |
| [23] |
Galperin I, Javeed A, Luig H, et al. An aryl-alcohol oxidase of Pleurotus sapidus: heterologous expression, characterization, and application in a 2-enzyme system[J]. Appl Microbiol Biotechnol, 2016, 100(18): 8021-8030. DOI:10.1007/s00253-016-7567-8 |