2. 四川农业大学水稻研究所,成都 611130
2. Rice Research Institute, Sichuan Agricultural University, Chengdu 611130
水稻稻曲病(Rice false smut)是由麦角菌科稻曲病菌Ustilaginoidea virens引起的真菌病害[1-2]。此病害已上升为水稻重要真菌病害之一[3]。稻曲病不但对水稻的产量和质量造成重大的影响,其稻曲球还产生对人和牲畜有剧毒作用的真菌毒素,毒素可抑制微管蛋白和细胞的有丝分裂[4-5]。近年来,对稻曲病菌的侵染过程、有性生殖类型、分子生物学等方面的研究有了较大的进展[6-8]。前人研究表明,稻曲病菌的菌丝能产生分生孢子和厚垣孢子,其分生孢子是病害的主要侵染源;分生孢子在水稻颖壳上附生,萌发生长成菌丝,随后菌丝通过内稃和外稃进入小穗内部,侵染雄蕊花丝,进而侵染整个花器官[9-10]。Fu等[11]研究报道,稻曲病菌的有性类型为同宗配合,通过同宗配合方式产生有性子囊孢子。子囊孢子也是稻曲病发生的初侵染源之一[12]。稻曲病菌的BAC(Bacterial artificial chromosome)文库[13]和cDNA文库[14]的构建,为致病基因的鉴定、比较基因组学等研究就奠定了基础。Zhang等[8]对稻曲病菌全基因组和功能基因的分析,为该菌侵染水稻机理提供了重要线索。
目前,稻曲病菌的基因组序列仍有许多gap,同时与致病相关的效能因子仍不明确。深入研究该菌的分子生物学水平的前提是获得理想的总DNA或RNA材料,而稻曲病菌的本身会产生大量的次生代谢产物,影响基因组DNA提取。虽然提取真菌DNA的方法比较多,但是不同真菌类群有不同的适宜提取方法[15]。江洁等[16]研究报道CTAB法对里氏木霉的基因组DNA提取效果优于SDS法;张宝俊等[17]通过比较试验发现SDS法对尖孢镰刀菌和禾谷镰刀菌的DNA提取效果优于CTAB法;贺羽等[18]研究结果表明CTAB法对苹果球壳孢腐烂病菌的DNA提取效果优于试剂盒法。本研究旨在筛选出一种适用于大量稻曲病菌基因组DNA提取的方法,进行测序,构建基因组小文库,并对文库数据进行分析,为稻曲病菌的基因组gap的填补和致病相关基因的鉴定提供数据。
1 材料与方法 1.1 材料 1.1.1 供试菌株稻曲病菌UV-cd2菌株为本实验室提供,采用马铃薯蔗糖固体培养基(PSA)进行培养。挑取PSA上培养的幼嫩菌丝于PS液体培养基中,置于28℃培养箱中进行振荡(150 r/min)培养,7 d后过滤收集菌丝;用无菌水洗涤菌丝2次,收集菌丝,-70℃保存备用。
1.1.2 主要试剂3% CTAB提取液(3% CTAB、1 mol/L NaCl、1 mol/L Tris-HCl(PH8.0)、0.5 mol/L EDTA、1% PVP、0.5% β-巯基乙醇)、3% SDS提取液(3% SDS、1 mol/L NaCl、1 mol/L Tris-HCl(PH8.0)、0.5 mol/L EDTA、1% PVP、0.5% β-巯基乙醇)、蛋白酶K(1 mg蛋白酶K溶于5 mL无菌双蒸水)、TE缓冲液(1 mmol/L EDTA(pH 8.0)、10 mmol/L Tris-Cl(pH 8.0))、醋酸钾溶液(5 mol/L KAC,-20℃预冷)、酚/氯仿/异戊醇(25:24:1)、氯仿/异戊醇(24:1)(-20℃预冷)、RNase溶液(5mg RNase溶于5 mL无菌水,混匀,-20℃保存)、75%乙醇水溶液、无水乙醇。
真菌DNA提取试剂盒(产品编号:D3390-02)(Omega Bio-Tek公司,美国)。试剂盒主要成分:缓冲液1、缓冲液2、缓冲液3、平衡缓冲液、RNA酶、DNA洗涤缓冲液和洗脱缓冲液。
1.2 方法 1.2.1 稻曲病菌DNA提取 1.2.1.1 CTAB提取法取1 g稻曲病菌菌丝,加液氮研磨至粉状,加入4 mL 3%CTAB提取缓冲液;65℃水浴45 min(每隔10 min振荡1次,让菌丝细胞充分裂解),10 000 r/min离心8 min,取上清液于一新离心管中,加入等体积的5 mol/L KAC(-20℃预冷),在冰上冰浴30 min,加入等体积的酚/氯仿/异戊醇(25:24:1)抽提2次;取上清液,加入等体积的氯仿/异戊醇(24:1)抽提2次;取上清液,加入2/3体积的-20℃冰冻的异丙醇,-20℃沉淀30 min以上(或过夜),直到出现白色絮状沉淀为止,10 000 r/min离心8 min,收集沉淀;用75%酒精洗涤沉淀2次;再用无水乙醇洗涤1次,风干;加适量体积的无菌超纯水溶解沉淀DNA;加2 µL RNase,37℃水浴30 min;加等体积氯仿/异戊醇(24:1)抽提1次;取上清液,10 000 r/min离心8 min;取沉淀,加适量的双蒸水,65℃水浴,溶解DNA;电泳检测DNA的量和纯度。并用分光光度计测量OD值。
1.2.1.2 SDS提取法取1 g稻曲病菌菌丝,加液氮研磨至粉状,加入4 mL 3% SDS,其它步骤同1.2.1.1 CTAB提取法。
1.2.1.3 试剂盒提取法真菌DNA具体提取方法参照Omega真菌DNA提取试剂盒说明书(产品编号:D3390-02)。
1.2.2 构建文库、测序取1 µg DNA利用超声仪(Fisher)打断,切胶回收180 bp的片段,随后纯化DNA片段用TruSeqTM DNA Sample Prep Kit-Set A(Illumina,美国)制备文库,并利用TruSeq PE Cluster Kit(Illumina,美国)进行扩增,最后在Illumina机器上进行测序反应。
1.2.3 数据装配与分析使用Velvet(V1.2.03)软件进行组装,再使用ABySS分析基因组数据的杂合率、重复度和GC含量等。
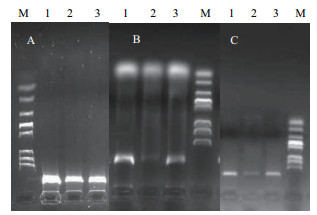
2 结果 2.1 稻曲病菌基因组DNA制备采用CTAB法、SDS法和真菌DNA试剂盒法3种方法提取稻曲病菌基因组DNA,进行电泳,成像。可以看出采用CTAB提取稻曲病菌DNA(图 1-A)的效果优于SDS和真菌DNA试剂盒(图 1-B和1-C)。用分光光度计测OD值,CTAB法和试剂盒法的OD260/OD280在1.8-2.0之间,表明没有杂质污染;而SDS法的OD260/OD280 < 1.6,表明有蛋白质、糖类等杂质污染。对样品浓度进行计算,其中CTAD法DNA浓度最大,浓度达到750 ng/µL;其次为SDS法,DNA浓度达350 ng/µL;最小为试剂盒法DNA浓度,只有100-120 ng/µL。
|
| 图 1 稻曲病菌基因组DNA提取 A:CTAB提取法;B:SDS提取法;C:真菌DNA试剂盒提取法(1-3:DNA;M:DNA marker) |
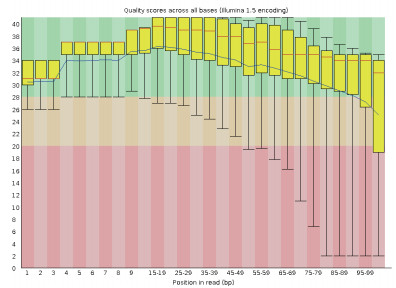
用Solexa测序PE(pair end)库,一共得到18 187 350碱基对序列,总碱基数为3.6 G。在测序的碱基识别(Base calling)过程中,碱基的正确识别率是98.59%即Q20为98.59%(图 2)。
|
| 图 2 稻曲病菌UV-cd2碱基质量分布 |
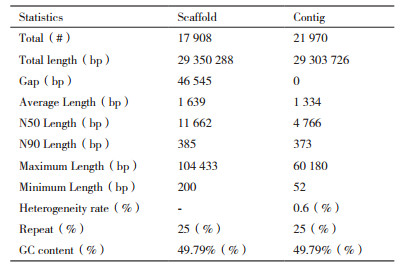
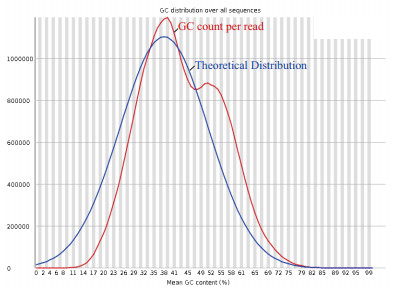
采用velvet(V1.2.03)软件进行组装,组装结果如表 1所示。稻曲病菌UV-cd2基因组180 bp文库的contig总数为21 970个,Scaffold的总数为17 908;Contig的平均长度为1 334 bp,Scaffold的平均长度为1 639 bp;Contig的N50长度为4 766 bp,Scaffold的N50为11 662;Contig的N90长度为373 bp,Scaffold的N90为385 bp;Contig的最长碱基数为60 180 bp,Scaffold的最长碱基数为104 433 bp;Contig最短长度为52 bp,Scaffold的最短长度为200 bp;总的碱基GC含量为49.79%(图 3)。
|
| 图 3 稻曲病菌UV-cd2总的碱基GC含量 |
曾有研究报道,不同方法提取的真菌基因组DNA效果不一样,如CTAB法对小麦条锈菌[15]、水稻纹枯病[19]、木霉[20]等真菌的提取效果好,而SDS法对部分镰刀菌的基因组DNA提取效果好[17]。用于文库构建的真菌基因组DNA需要高纯度、高浓度、片段在30-50 kb之间的DNA片段。在进行提取基因组DNA的过程中,所有操作器具都要经过灭菌处理。本实验采用CTAB法、SDS法和真菌DNA试剂盒法3种提取方法提取稻曲病菌基因组DNA,结果表明CTAB法能获得浓度达到750 ng/µL、OD260 / OD280在1.8-2.0之间的高质量DNA。真菌DNA试剂盒提取法也能获得纯度较高的DNA,但是获得的DNA量远远低于CTAB,这是因为试剂盒提取DNA时需要的菌丝量较少。因此,试剂盒提取法适用于需要较少量的基因组DNA提取。SDS提取的DNA有大量的杂质污染,这可能是因为SDS是阴离子去污剂,对多糖等杂质没有较好的去除效果,而CTAB是阳离子去污剂,可以很好地去除多糖等杂质。稻曲病菌在进行液体培养时,菌丝体本身会产生大量的次生代谢产物,菌丝体黏稠且呈黄绿色,因此在收集菌丝体时要用无菌水洗涤几次,以保证稻曲病菌菌丝体洁净。在稻曲病菌基因组DNA提取过程中,最常见的问题就是蛋白质和多糖的污染,因此在提取时,选择CTAB提取液能有效地去除多糖的污染,同时要加入5 mol/L KAC和蛋白酶K进行处理去除蛋白质,在提取DNA过程的最后,还要加入RNA酶,去除RNA的污染,以保证提取的稻曲病菌基因组DNA纯净。
高质量的DNA是构建基因组文库的保障。本实验成功构建了稻曲病菌UV-cd2基因组180 bp小文库。文库总碱基数为3.6 G,碱基的正确识别率Q20为98.59%,接近于正常的Q20值(99%),表明本研究构建的基因组文库质量不错。文库组装分析得出总的碱基的GC含量为49.79%,这与Zhang等[8]报道相似。从稻曲菌基因组DNA小文库构建数据分析可得出稻曲病菌的杂合率和重复度较高,这就预示着在稻曲病菌的全基因组或染色体组装比较困难。该文库的成功构建,将为稻曲病菌基因组gap的填补和致病相关基因的鉴定提供数据,促进稻曲病菌基因组学研究。
4 结论本研究筛选出稻曲病菌基因组DNA最佳的提取方法是CTAB提取法,并构建了基因组小文库,小文库测序组装共得29 350 288碱基(bp)和17 908 Scaffold,总碱基的GC含量为49.79%,碱基的正确识别率是98.59%。
| [1] |
Tanaka E, Ashizawa T, Sonoda R, et al. Villosiclava virens gen. nov., comb. nov., teleomorph of Ustilaginoidea virens, the causal agent of rice false smut[J]. Mycotaxon, 2008, 106(1): 491-501. |
| [2] |
Takahashi Y. On Ustilago virens Cooke and a new species of Tilletia parasitic on rice plant[J]. Botanical Magazine Tokyo, 1896, 10: 16-20. DOI:10.15281/jplantres1887.10.109_16 |
| [3] |
伏荣桃, 王剑, 卢代华, 等. 国内外水稻稻曲病研究进展[J]. 中国农学通报, 2016, 32(12): 189-194. DOI:10.11924/j.issn.1000-6850.casb15110037 |
| [4] |
Lu S, Tian J, Sun W, et al. Bis-naphtho-γ-pyrones from fungi and their bioactivities[J]. Molecules, 2014, 19: 7169-7188. DOI:10.3390/molecules19067169 |
| [5] |
Nakamura K, Izumiyama N, Ohtsubo K, et al. 'Lupinosis' -Like lesions in mice caused by Ustiloxin, produced by Ustilaginoidea virens: a morphological study[J]. Natural Toxins, 1994, 2: 22-28. DOI:10.1002/(ISSN)1056-9014 |
| [6] |
Fu RT, Ding L, Zhu J, et al. Morphological structure of propagules and electrophoretic karyotype analysis of false smut Villosiclava virens in rice[J]. The Journal of Microbiology, 2012, 50(2): 263-269. DOI:10.1007/s12275-012-1456-3 |
| [7] |
Tang XY, Jin J, Hu DW, et al. Elucidation of the infection process of Ustilaginoidea virens (teleomorph: Villosiclava virens) in rice spikelets[J]. Plant Pathology, 2012, 62(1): 1-8. |
| [8] |
Zhang Y, Zhang K, Fang AF, et al. Specific adaption of Ustilaginoidea virens in occupying host florets revealed by comparative and functional genomics[J]. Nature Communication, 2014, 5: 3849. |
| [9] |
Fan J, Guo XY, Huang F, et al. Epiphytic colonization of Ustilaginoidea virens on biotic and abiotic surfaces implies the widespread presence of primary inoculums for rice false smut disease[J]. Plant Pathology, 2014, 63: 937-945. DOI:10.1111/ppa.2014.63.issue-4 |
| [10] |
Hu ML, Luo LX, Wang S, et al. Infection process of Ustilaginoidea virens during artificial inoculation of rice panicles[J]. European Journal of Plant Pathology, 2014, 139: 67-77. DOI:10.1007/s10658-013-0364-7 |
| [11] |
Fu RT, Yin CC, Deng QM, et al. Mating type loci analysis indicates that Villosiclava virens, the casual agent of false smut disease of rice, is a homothallic fungus[J]. Tropical Plant Pathology, 2014, 39(3): 203-209. DOI:10.1590/S1982-56762014000300003 |
| [12] |
Singh RA, Dubey KS. Sclerotial germination and ascospore formation of claviceps oryzae-sative in India[J]. India Phytopathology, 1984, 37: 168-170. |
| [13] |
刘庆丽, 王晓明, 王革娇, 等. 稻曲病菌UV-2菌株细菌人工染色体文库构建及分析[J]. 微生物学通报, 2013, 40(9): 1715-1722. |
| [14] |
张震, 王教瑜, 杜新法, 等. 稻曲病菌cDNA文库的构建[J]. 植物病理学报, 2008, 38(5): 462-467. |
| [15] |
韩冰, 蔺瑞明, 曹远银, 等. 小麦条锈菌DNA提取方法的比较研究[J]. 中国农学通报, 2006, 22(4): 81-83. |
| [16] |
冮洁, 杜连祥, 路福平, 等. 基因工程菌里氏木霉染色体DNA的提取方法[J]. 生物技术, 2004, 14(2): 24-26. |
| [17] |
张宝俊, 李志岗, 张家榕, 等. 4种镰刀菌基因组DNA提取方法的比较研究[J]. 安徽农业科学, 2008, 38(31): 13559-13560, 13563. DOI:10.3969/j.issn.0517-6611.2008.31.033 |
| [18] |
贺羽, 李鑫, 王有福, 等. 苹果球壳孢腐烂病菌DNA不同提取方法的比较[J]. 江苏农业科学, 2012, 40(6): 38-40. |
| [19] |
秦培钢. 水稻纹枯病菌Rhizoctonia solani AG1 IA Fosmid基因组文库的构建及线粒体全基因组组装分析[D]. 成都, 四川农业大学, 2012.
|
| [20] |
张晓晖, 郭春华, 江晓霞, 等. 康氏木霉基因组DNA提取方法的比较研究[J]. 生物技术通报, 2007(5): 128-130. |