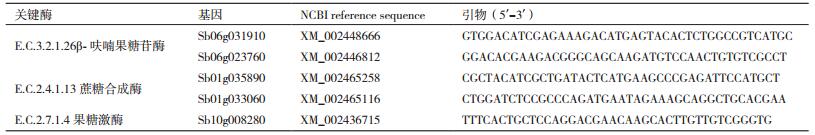
2. 辽宁登海种业有限公司,沈阳 110000
2. Liaoning Denghai Seed Co. Ltd., Shenyang 110000
甜高粱(Sorghum bicolor(L.)Moench)是粒用高粱的一个变种,也称为芦粟、甜秆、甜秫秸和糖高粱[1]。甜高粱作为非粮作物的能源植物,由于自身抗逆性比较强,可在干旱半干旱气候、贫瘠土地等恶劣环境生长,高度适应不同的气候和土壤,可产生较高的生物产量,是具有巨大潜力的可再生能源作物之一[2]。
甜高粱与普通高粱最大的区别在于茎秆的糖含量有所不同,因为甜高粱在成熟期时通常不产生大的种球,而是将大量的同化物运输分配到茎中。籍贵苏等[3]利用77个品种的粒用高粱和21个品种的甜高粱作为研究材料,对甜高粱的含糖量进行研究,结果表明,甜高粱茎秆中糖含量是粒用高粱2-5倍。
叶片作为植物的光合器官,承担着将光能转化为生物质能的重要作用,是甜高粱蔗糖合成、运输的源器官。有研究表明甜高粱在抽穗期与成熟期叶片内的蔗糖含量占有很高的比例,在成熟期其占比达到最大值,最高的相对含量达到了61.2%,对其蔗糖与总糖的含量进行相关性分析,发现蔗糖含量与总糖含量呈显著正相关(R=0.914,P < 0.01),所以叶片内蔗糖含量的变化是影响甜高粱体内总糖含量的根本原因[4]。前人在对甜高粱的不同生长发育时期叶片中蔗糖合成酶(Sucrose synthase,SS)进行表达检测发现,甜高粱苗期、开花期叶片中SS蛋白质表达量较高,拔节、抽穗期、腊熟期叶片和茎中SS蛋白质表达量较低。除苗期以外,甜高粱其他时期叶片和茎中SS的表达与茎中蔗糖含量变化趋势基本一致,甜高粱茎杆中的蔗糖含量与叶片及茎秆中SS蛋白质的表达相关系数分别为0.777和0.903,这与粒用高粱叶片中SS表达量变化相比呈现相反的趋势。说明甜高粱茎中蔗糖富集程度高可能与其叶片中SS蛋白表达高度相关[5]。
前人对于甜高粱蔗糖含量的研究多数集中在甜高粱与粒用高粱糖不同生育时期、不同部位间的含糖量的差异比较,以及在不同生育时期影响蔗糖合成与转运的关键酶类活性讨论,对于引起甜高粱较粒用高粱在蔗糖合成、转运上存在差异的分子机理鲜有报道。本研究通过对甜高粱与粒用高粱成熟期叶片转录组测序分析,寻找其组织间差异表达的相关基因,通过GO功能注释及相关联的Pathway分析,筛选与蔗糖积累与代谢酶类表达相关的基因,以利于充分挖掘甜高粱的生物学潜能,填补甜高粱分子领域研究的空白,以期为甜高粱的定向改良奠定坚实的基础。
1 材料与方法 1.1 材料供试高粱品种为辽甜1号和粒用高粱新苏2号,2012年5月种植于沈阳农业大学试验田,于2012年10月选取长势良好的自旗叶起第四片叶,经液氮速冻后-80℃保存,备用。
1.2 方法 1.2.1 总RNA提取及质量检测采用RNA prep pure植物总RNA提取试剂盒(购于TIANGEN公司)分别提取2个材料总RNA。用1%琼脂糖凝胶电泳检测总RNA的纯度及完整性,用Agilent2100进一步检测RNA的浓度和OD260/OD280、OD260/OD230比值。
1.2.2 cDNA文库的构建及Illumina测序用NEBN Poly(A)mRNA Magnetic Isolation Module富集mRNA,并以mRNA为模板构建cDNA上机文库,检测合格的文库最后用Illumina HiSeqTM2000进行双末端测序。
1.2.3 测序数据质量评估与新基因分析将各样品得到的数据与参考基因组进行比对,使用Cufflinks软件对reads进行组装,并与原有基因组的已知基因模型比较,过滤掉小于200 bp的序列后,发掘出该物种的新基因。
1.2.4 基因表达量分析与功能注释采用TopHat2将各样品测序得到的reads与参考基因组进行比对,根据比对信息,利用RPKM值反映对基因的表达丰度。在差异基因筛选中,选取FDR < 0.01且Flod Change≥2作为标准。将得到的差异表达基因,利用BLAST软件与nr、SwissProt、GO、COG进行功能注释与分类,最后将差异基因与KEGG数据库比对,分析其相关的代谢通路。
1.2.5 实时荧光定量PCR验证利用QuantScript RT Kit(购于TIANGEN公司)反转录试剂盒将提取的甜高粱与普通高粱成熟期总RNA合成cDNA第一链。将反转录合成的cDNA及所选基因序列委托五福星生物科技有限公司进行引物合成与实时荧光定量检测。
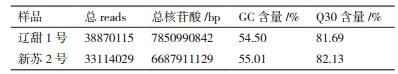
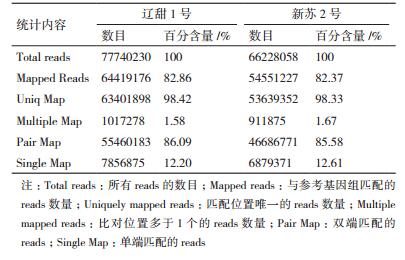
2 结果 2.1 测序结果与质量分析测序一共获得71.98 M条reads,总碱基数为14.54 Gb。在测序质量统计评估方面,碱基Q30都在81%以上(表 1)。使用Tophat软件将各样品测序得到的reads与参考基因组进行比对,2个样品的reads与参考基因组比对效率都在82%左右(表 2),表明测序及所选参考基因较好,满足分析需要。
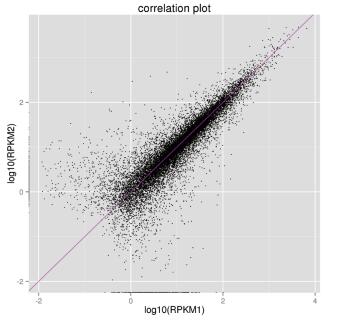
经过reads组装,与原有基因组比较,共发掘1 562个新基因和3 115个差异基因。在3 115个差异基因中,与对照组相比,试验组有1 499个基因上调,1 616个基因下调(图 1)。图 2为RPKM对数值散点图,说明样品间表达量的相关性较低,基因间的表达差异性较大。
|
| 图 1 样品成分组间基因表达量散点图 |
|
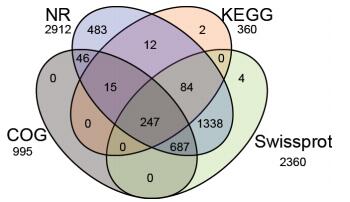
| 图 2 蛋白功能注释维恩图 |
使用BLAST软件对提取的新基因序列与各数据库进行比对,最终获得1 562个新基因(表 3)。
对筛选获得的3 115个差异基因,提取注释信息进行统计(表 4)。93.7%(2 918个)的差异基因得到了功能注释,其中大部分可以通过NR数据库得到其蛋白功能注释。运用不同的蛋白信息库对蛋白功能进行注释(图 2),通过维恩图可以清晰地看到,绝大多数基因可以通过NR数据库得到注释,只注释到KEGG、COG数据库的基因相对较少,分别为360和995。多数基因可以同时至少通过2个库得到注释,其中同时注释到4个数据库的基因有247个。
差异基因的GO分类可分为细胞组分、分子功能和生物学过程3大类,57个小类。在细胞组分功能类型中,一共有2 234个差异基因得到注释(图 3),其中“细胞”和“细胞部分”所占比例最高;在分子功能类型中,一共有2 036个差异基因得到注释,其中“蛋白结合”与“催化活性”所占比例最高;生物过程功能类型中,一共有2 151差异基因得到注释,其中“代谢过程”与“细胞过程”所占比例最高。
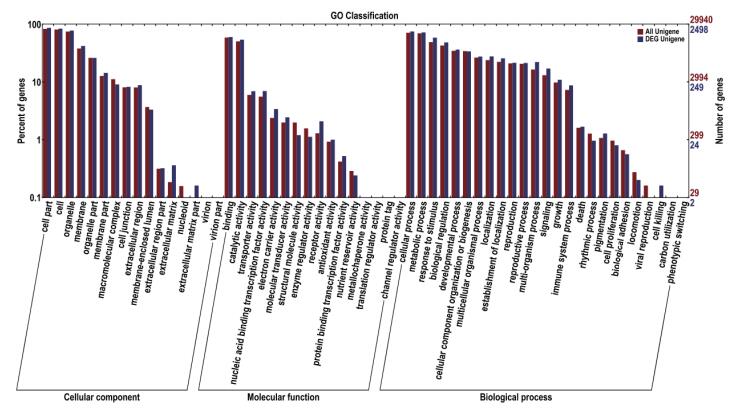
|
| 图 3 差异基因GO注释聚类图 |
运用COG数据库对基因产物进行直系同源分类(图 4)。在COG功能注释的25个类别中,“一般功能预测”为最大组,其次为“复制、重组及修复”及“转录”,最后为“信号转导”,“细胞运动”、“细胞外结构”和“核结构”均无差异基因。
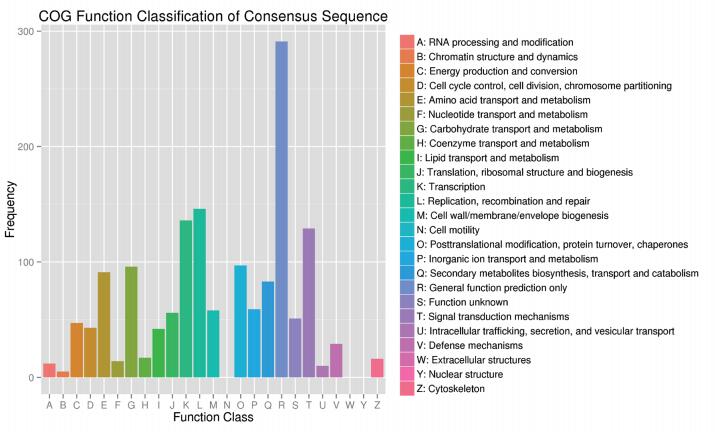
|
| 图 4 差异基因COG注释分类图 |
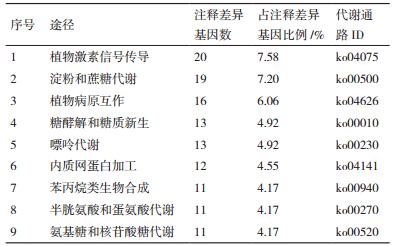
运用KEGG数据库进行功能分类和Pathway显著性富集分析(表 5),共264个差异基因富集到94个代谢通路。其中包括光合作用、蔗糖与淀粉代谢、植物病原互作、植物激素信号转导、内质网蛋白加工、苯丙烷类生物合成、半胱氨酸和蛋氨酸代谢、氨基糖和核苷酸糖代谢、糖酵解和糖质新生、嘌呤代谢等代谢通路。在这些代谢通路中,植物激素信号转导富集的差异基因最多(20,7.58%),其次为蔗糖和淀粉代谢通路(19,7.2%)。在淀粉与蔗糖代谢途径中,果胶酯酶、尿苷二磷酸葡萄糖6-脱氢酶、海藻糖-6-磷酸合成酶、果糖激酶和α-淀粉酶对应的基因都有不同程度的上调。α-1、4半乳糖醛酸转移酶、海藻糖-6-磷酸合酶、磷酸腺苷酰基转移酶和淀粉合酶对应的基因有不同程度的下调。尿苷二磷酸-葡萄糖醛酸酯-4-表异构酶、β-呋喃果糖苷酶、β-葡萄糖苷酶和蔗糖合酶对应的基因部分上调部分下调。其中尿苷二磷酸-葡萄糖醛酸酯-4-表异构酶对应的Sb02g029130基因下调最大,log2(FC)为-5.943 37。β-葡萄糖苷酶对应的Sb06g022450基因上调幅度最大log2(FC)为6.518 021。
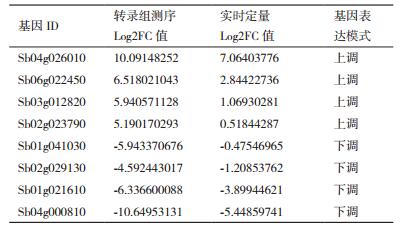
从RNA-Seq测序结果中挑取在辽甜1号与普通高粱成熟期不同程度差异表达的8个基因(表 6),以β-actin为内参基因进行实时荧光定量分析,并根据其在甜高粱与普通高粱成熟期叶片中表达情况是否与转录组测序结果相吻合,判断转录组数据的可靠性。
通过实时荧光定量PCR验证(图 5)。对样品中随机选取的8个基因在辽甜1号与普通高粱的相对表达量分析,其结果基本与转录组测序趋势相同,证明转录组测序获得的结果信息准确度较高,可靠性较强。
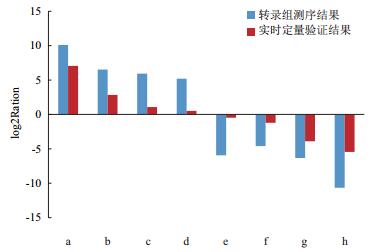
|
| 图 5 实时荧光定量PCR验证结果与转录组测序表达量差异的比较 a:Sb04g026010;b:Sb06g022450;c:Sb03g012820;d:Sb02g023790;e:Sb01g041030;f:Sb02g029130;g:Sb01g021610;h:Sb04g000810 |
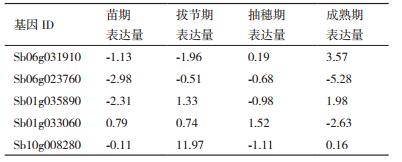
从淀粉与蔗糖代谢通路(Pathway ID:Ko00500)中取几个关键酶的差异基因,分别为Sb06g031910、Sb06g023760、Sb01g035890、Sb01g033060和Sb10g008280。进行引物设计(表 7),以β-actin为内参基因,以辽甜1号为试验组,普通高粱为对照组,分别在苗期、拔节期、抽穗期和成熟期4个生长发育时期随机取样,取材部位为自旗叶起第四片叶子,每个样品3个重复,进行实时荧光定量分析(表 8)。与对照相比,β-呋喃果糖苷酶调控基因Sb06g031910在辽甜1号苗期、拔节期的表达量下调,抽穗期与成熟期表达量上调。在拔节期下调程度最大,在成熟期上调程度最大。β-呋喃果糖苷酶调控基因Sb06g023760在辽甜1号4个生长时期均呈现下调,拔节期与抽穗期下调幅度最小。蔗糖合成酶调控基因Sb01g035890在辽甜1号苗期、抽穗期表达下调,拔节期成熟期上调。在苗期表达量差异最大,下调程度最明显。成熟期上调差异最大。蔗糖合成酶调控基因Sb01g033060在辽甜1号苗期、拔节期、抽穗期表达量上调,成熟期下调。并且在成熟期的相对表达差异最大。果糖激酶Sb10g008280基因在辽甜1号中下调,拔节期和成熟期上调。在苗期和成熟期表达差异不显著,在拔节期上调程度最大。
甜高粱是重要的能源作物,已为世界各国所认同,了解其糖分组成及决定因素对提高糖分含量具有重要意义。甜高粱中参与蔗糖代谢相关的酶主要是蔗糖合成酶、蔗糖磷酸合成酶和转化酶[6]。
β-呋喃果糖苷酶为蔗糖转化酶中的酸性转化酶,可以分解β-果糖类寡糖,催化蔗糖不可逆水解成葡萄糖。主要为可溶性酸性转化酶和细胞壁结合酸性转化酶,这两类形态的转化酶分别是由两类完全不同的基因家族编码[7]。聂元冬等[8]利用电子克隆与RT-PCR技术克隆得到甜高粱SAI-1基因全长序列,发现高、中糖品种甜高粱叶片中SAI-1表达的总和均明显的高于低糖品种,在甜高粱成熟期总糖和蔗糖含量均与叶片中SAI-1的表达量呈显著正相关关系。本研究β-呋喃果糖苷酶的Sb06g031910基因和Sb06g023760基因在甜高粱4个生长发育时期的表达模式不尽相同,b06g031910在苗期与拔节期处于下调趋势,在抽穗期与成熟期处于上调,在成熟期上调程度最为明显,这与前人的研究是相一致的。Sb06g023760在4个时期基本都处于下调趋势,成熟期的相对表达量都处于最大值,而此时叶片的酸性转化酶活性最低,蔗糖含量达到最大值。推测Sb06g023760可能在调控β-呋喃果糖苷酶的活性中发挥不同的功能,在成熟期发挥作用最大。
蔗糖合成酶在蔗糖代谢过程中既可以催化蔗糖合成又可催化其分解,是一种可逆酶,其作用取决于反应的底物浓度以及pH值(蔗糖合成最适pH8.0-9.5,蔗糖裂解最适pH5.5-6.5),但通常认为蔗糖合成酶主要起分解蔗糖的作用,即蔗糖合成酶催化蔗糖和UDP的转化产生UDP-葡萄糖和果糖[9]。安云蓉[10]指出蔗糖合成酶基因的表达差异很有可能是造成甜高粱与普通粒用高粱茎杆糖分含量存在差异的原因。Zhang等[11]根据在拟南芥中存在的六个蔗糖合成酶基因,在高粱中找到相应的同源蔗糖合成酶基因家族成员SbSusy1(Sb01g033060)和SbSusy4(Sb01g035890)。在本研究中蔗糖合成酶家族中的这两个基因的表达模式不尽相同,推测这两个基因可能控制蔗糖合成酶在甜高粱的生长发育不同阶段发挥不同功能。并且其在成熟期的表达差异也与RNA-Seq一致,SbSusy1下调,SbSusy4下调。SbSusy1在成熟期下调程度相对较大,推测其可能在此时期对蔗糖合成酶的功能影响较大;SbSusy4在苗期下调程度相对较大,成熟期上调较大,证明其分别在这两个时期发挥作用较大。
果糖激酶作为己糖激酶的一种,催化果糖的磷酸化,在植物库组织的代谢和分配中起主要作用[12]。Sb10g008280为高粱果糖激酶基因家族的SbFRK2。在本研究中其在辽甜1号和粒用高粱的拔节期表达量差异最大,而此时叶片中果糖含量也相对较高,因此推测其在此时期对果糖激酶发挥较大作用。
4 结论本研究采用RNA-Seq技术比较了辽甜1号与粒用高粱成熟期叶片的转录组数据,通过差异表达筛选出3 115个差异基因,其中1 499个基因上调,1 616个基因下调。将差异表达的基因进行了GO、COG等功能注释和代谢途径分类,初步明确了各个基因编码蛋白的功能。共计93.7%(2 918个)差异基因得到了功能注释。在富集的94个代谢通路中,植物激素信号转导和淀粉与蔗糖代谢通路富集差异基因最多,分别为20和19个。植物激素信号转导通路中上调基因6个,下调基因14个;淀粉与蔗糖代谢通路中上调基因10个下调基因9个。从淀粉与蔗糖代谢通路(Pathway ID:Ko00500)中选取5个差异基因(Sb06g031910、Sb06g023760、Sb01g035890、Sb01g033060和Sb10g0082805)进行分析,发现这些基因在不同生育时期的表达与其对应酶类的活性有很强的关联性,推测其在甜高粱叶片积累蔗糖的过程中发挥着至关重要的作用。
| [1] |
卢庆善. 甜高粱研究进展[J]. 世界农业, 1998(5): 21-23. |
| [2] |
Davila-Gomez F, Chuck-Hernandez C, Perez-Carrillo E, et al. Evaluation of bioethanol production from five different varieties of sweet and forage sorghums(Sorghum bicolor(L)Moench)[J]. Industrial Crops and Products, 2011, 33(3): 611-616. DOI:10.1016/j.indcrop.2010.12.022 |
| [3] |
籍贵苏. 甜高粱茎秆含糖量研究[J]. 华北农学报, 2006, 21(增刊): 81-83. |
| [4] |
毛鑫. 不同甜高粱品种叶片中糖分积累规律的研究[J]. 沈阳师范大学学报:自然科学版, 2015, 33(2): 305-309. |
| [5] |
杨明. 高粱蔗糖代谢相关酶SPS、SS表达与蔗糖积累的相关性研究[D]. 保定: 河北农业大学, 2008. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1306949
|
| [6] |
刘海波, 魏玉清. 土壤盐分胁迫对甜高粱茎秆糖分积累及蔗糖代谢相关酶活性的影响[J]. 西北农林科技大学学报, 2017, 45(5): 41-47. |
| [7] |
李肖蕖, 王建设, 张根发. 植物蔗糖转化酶及其基因表达调控研究进展[J]. 园艺学报, 2008, 35(9): 1384-1392. |
| [8] |
聂元冬, 钟海丽, 顿宝庆, 等. 甜高粱SAI基因的表达与茎秆糖分积累的相关性分析[J]. 中国农业科学, 2013, 46(21): 4506-4514. DOI:10.3864/j.issn.0578-1752.2013.21.013 |
| [9] |
Elling L. Effect of metal ions on sucrose synthase from rice grains-a study on enzyme inhibition and enzyme topography[J]. Glycobiology, 1995, 5(2): 201-206. DOI:10.1093/glycob/5.2.201 |
| [10] |
安云蓉. 甜高粱蔗糖合成酶基因的表达规律及其与糖分含量关系的研究[D]. 天津: 天津农学院, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10061-1013213427.htm
|
| [11] |
Zhang Js, Aroo J, Chen Yq, et al. Haplotype analysis of sucrose synthase gene family in three Saccharum species[J]. BMC Genomics, 2013, 14: 314-325. DOI:10.1186/1471-2164-14-314 |
| [12] |
Granot D. Role of tomato hexose kinase[J]. Functional Plant Biology, 2007, 34: 564-570. DOI:10.1071/FP06207 |