供试小麦品种为矮抗58,由郑州大学离子束实验室提供。MeJA饱和溶液购于上海瑞永生物技术有限公司。
1.2 方法 1.2.1 外源MeJA喷施和冷驯化处理实验设两组小麦幼苗:双蒸水低温处理(对照组)和外源MeJA喷施低温处理(实验组),每组50株小麦幼苗,每组设3组重复,小麦种子经0.1%HgCl2表面消毒15 min,蒸馏水清洗3次,浸种24 h后播种于蛭石、细沙的培养钵中,每钵10株,每5 d浇灌一次培养液(Hoagland全营养液),于4 000 lx,25℃光照培养箱中培养至三叶期后,使用双蒸水对对照组小麦幼苗叶片进行喷施,使用浓度为100 μmol/L的MeJA对实验组小麦幼苗叶片进行喷施后将幼苗置于4℃低温条件下处理7 d,第7天后分别取两组小麦叶片4 g经液氮处理后低温保存以备用[14]。
1.2.2 生理生化指标测定小麦幼苗低温伤害部位主要为叶片,多发萎蔫干枯失绿,随后发黄变干死亡[15]。7 d低温处理后,统计成活率;SOD、POD、CAT、MDA、脯氨酸和可溶性蛋白的测定参考高俊凤、张志良等方法[16-17],使用Thermo ScientificTM VarioskanTM LUX多功能微孔板读数仪测定吸光度。
1.2.3 TaCBFs抗寒应答转录因子qRT-PCR分析取两组小麦幼嫩叶片,TRizol试剂快速提取法提取RNA[18],反转录体系为120 μL,20 μL模板,使用oligo-dT引物法将RNA转录为cDNA[19]。根据GenBank数据库提供的TaCBF Ⅳ d-B4(EF028781)、TaCBF Ⅲ d-B19(EF028767)、TaCBF Ⅲ c-D3(EF028760)和TaCBF Ⅲ d-D19(EF028768)基因序列信息[9],利用Primer Premier 5.0设计引物序列,以GDPDH为参照基因,如表 1。使用SYBR Green作为荧光显示剂进行荧光实时定量PCR,反应总体系为15 μL,正反向引物各0.3 μL,cDNA模板1 μL,SYBR Green 7.5 μL,双蒸水5.9 μL,反应条件:95℃预变性2 min,94℃变5 s,62℃退火20 s,72℃延伸20 s,40个循环,65℃15 s生成溶解曲线,40℃冷却30 s。每个样品设3次重复。
使用Excel 2007软件对实验数据进行分析作图,使用IBM SPSS statistics13.0软件对数据进行单因素方差分析及显著性检验。基因表达量分析使用相对定量分析中的2-△△Ct法分析[20],计算所得全部数据将处理组矫正为1,以1作为相对表达量,实验组数据为其相对倍数。
2 结果 2.1 生理生化指标 2.1.1 成活率低温处理后对照组3组小麦幼苗成活率平均为84%;而经过外源MeJA喷施的低温处理的3组小麦幼苗成活率平均数达到91%。除小麦叶片干枯发黄冻死外,冷处理后小麦叶尖有发黄干枯现象,以低温处理组小麦发生居多。结果(图 1)表明,外源MeJA喷施可以减轻小麦受低温伤害,从而提高成活率,减少幼苗损失。
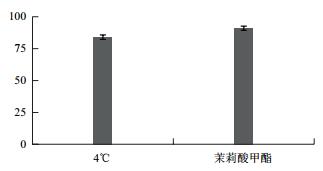
|
| 图 1 矮抗58小麦幼苗成活率 |
如图 2所示,经过外源MeJA喷施进行低温处理后的小麦幼苗中SOD、CAT和POD三种抗氧化酶活性较对照组分别提高了34%、50%和14%,MDA含量降低了5%。结果表明,低温处理后,外源MeJA的喷施可以有效提高小麦幼苗中SOD、CAT、POD抗氧化酶活性,同时降低MDA含量,通过提高抗氧化酶活性以降低小麦幼苗细胞损伤,提高小麦低温耐受能力。
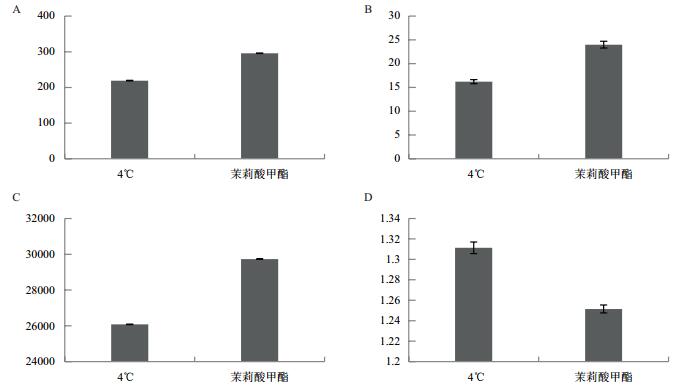
|
| 图 2 矮抗58小麦幼苗中SOD(A)、CAT(B)、POD(C)活性及MDA(D)含量 |
如图 3所示,外源MeJA喷施低温冷处理后小麦幼苗中可溶性蛋白和游离脯氨酸含量较对照组分别提高了30%和14%。结果表明,在低温处理后,外源MeJA的喷施可以有效提高小麦幼苗中的可溶性蛋白含量和游离脯氨酸含量,以此提升小麦抗低温能力。

|
| 图 3 矮抗58小麦幼苗中可溶性蛋白(A)及游离脯氨酸(B)含量 |
如图 4所示,经过外源MeJA喷施低温处理实验组小麦幼苗中TaCBF Ⅳ d-B4、TaCBF Ⅲ d-B19、TaCBF Ⅲ c-D3和TaCBF Ⅲ d-D19表达量较对照组有明显的提高,其中CBF Ⅳ d-B4荧光表达量在4个基因中最高,CBF Ⅳ d-B4基因表达量为对照组34.78倍,TaCBF Ⅲ c-D3基因表达量为对照组的24.2倍,CBFⅢ3d-B19基因表达量为对照组的21倍,CBF Ⅲ d-D19基因表达量为对照组的19.93倍。4个基因表达量结果皆表现为上调表达。结果表明,外源MeJA的喷施可以有效促进TaCBF Ⅳ d-B4、TaCBF Ⅲ d-B19、TaCBF Ⅲ c-D3和TaCBF Ⅲ d-D19的表达以应对冷环境胁迫。
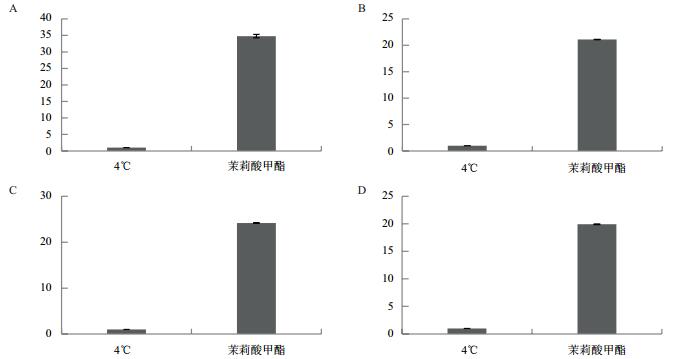
|
| 图 4 矮抗58小麦幼苗中CBF Ⅳ d-B4(A)、CBF Ⅲ 3d-B19(B)、TaCBF Ⅲ c-D3(C)和CBF Ⅲ d-D19(D)荧光表达量 |
小麦在进入越冬期之前会有较长的低温期,在经受低温胁迫时,小麦中抗寒应答转录因子CBF基因家族参与低温胁迫抗逆代谢,CBF转录因子在干旱、高盐及低温胁迫信号传递中能够起到重要作用[21-22]。近几年国内外对小麦CBF家族基因的研究主要为转基因以及抗寒诱导机制方面。CBF转录因子可激活具有DRE顺式作用原件的多个与干旱、高温及低温耐性有关功能基因的表达,从而使得小麦的抗逆性提高[23]。本实验结果显示,外源茉莉酸甲酯喷施后,小麦幼苗抗寒应答转录因子TaCBF Ⅳ d-B4、TaCBFⅢ3d-B19、TaCBF Ⅲ c-D3和TaCBF Ⅲ d-D19荧光表达量较低温处理组明显升高,表明在100 μmol/L浓度下外源MeJA可以诱导以上基因的表达。进一步说明,通过外源茉莉酸甲酯诱导抗寒基因的表达,可以促进小麦细胞内部生理生化机制的抗寒反应,生成小麦抗逆相关酶及抗逆物质,从而提高小麦抗低温能力。
当小麦受到低温胁迫时,会产生大量活性氧簇(Reactive oxygen species,ROS),会对脂膜、蛋白以及遗传物质造成伤害,MDA是细胞脂膜过氧化后的产物,而SOD、CAT及POD等抗氧化酶可以有效清除ROS,降低MDA含量。可溶性蛋白和游离脯氨酸可以调节胞内渗透压,降低小麦细胞基质冰点,以此保护细胞免受低温处理的伤害[24-25]。本实验结果显示,外源MeJA喷施的处理组小麦幼苗中SOD、CAT、POD抗氧化酶含量较对照组明显提高,同时降低了脂膜过氧化产物MDA含量,可溶性蛋白和脯氨酸含量也明显升高,有效提高了小麦幼苗的抗寒耐受能力,这与齐付国等[14]和刘彧等[26]研究结果相似。已有研究表明,外源MeJA可促进细胞衰老[27]。实验结果显示,经过外源MeJA喷施后低温处理的小麦幼苗存活率显著升高,降低了小麦死亡率,保证了后期小麦的产量。此外,外源MeJA除提高小麦抗寒能力以及其他环境胁迫抵抗能力之外,还能有效提高小麦抗病性,如白粉病、赤霉病和锈病[28-29]。
有研究表明,在低温环境下,外源茉莉酸甲酯的喷施可以有效提高小麦内源茉莉酸的含量[30],而内源茉莉酸可有效应对小麦受到的伤害以及病原体入侵,当小麦受到低温驯化后内源茉莉酸含量下降,直至第7天开始回升[31]。生理生化水平及分子水平皆显示,外源茉莉酸甲酯的喷施可有效提高小麦幼苗的耐寒能力。除此之外,有研究表明,外源水杨酸、赤霉素和脱落酸与茉莉酸甲酯有相似的作用[32-33]。目前,对于外源茉莉酸甲酯在小麦育种生产中的应用还不成熟,原因可能是茉莉酸类物质在植物体中的作用和作用机制还不够清楚。另外,茉莉酸类物质在市场售价较高,针对大面积作物的使用不够经济。因此,外源茉莉酸甲酯对冷处理小麦的作用和作用机制还需进一步地在分子和蛋白水平展开研究。
4 结论4℃低温处理7 d后,外源MeJA的喷施能显著提高小麦抗氧化酶活性及可溶性蛋白和脯氨酸含量、降低MDA含量,促进抗寒应答转录因子TaCBF Ⅳ d-B4、TaCBFⅢ3d-B19、TaCBF Ⅲ c-D3、TaCBF Ⅲ d-D19的表达,提高矮抗58小麦幼苗的低温耐受性。综上,通过对小麦幼苗叶片喷施茉莉酸甲酯能够有效提高小麦幼苗的低温耐受能力。
| [1] |
王纯枝, 钱拴, 谭方颖, 等. 2015/2016年冬季气候对农业生产的影响[J]. 中国农业气象, 2016, 37(02): 255-257. DOI:10.3969/j.issn.1000-6362.2016.02.016 |
| [2] |
曹淑华, 查向东. 超氧化物歧化酶研究综述[J]. 安徽农业科学, 2003(4): 599-601. |
| [3] |
包卓. 低温高光锻炼下烤烟幼苗叶片光合适应性的初步研究[D]. 哈尔滨: 东北林业大学, 2010. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2050565
|
| [4] |
周鹤, 林毅雄, 段起, 等. 果蔬成熟度与抗冷性的关系及其作用机理研究进展[J]. 包装与食品机械, 2014, 32(1): 45-49. |
| [5] |
夏金婵, 吕强, 郭梅芳, 等. 植物冷驯化相关信号机制[J]. 中国生物化学与分子生物学报, 2008, 22(4): 295-301. |
| [6] |
Guo Y, Xiong L, Ishitani M, et al. An Arabidopsis mutation in translation elongation factor 2 causes super induction of CBF/DREB1 transcription factor genes but blocks the induction of their downstream targets under low temperatures[J]. Proc Nat Acad Sci, 2002, 99(3): 7786-7791. |
| [7] |
Chiara Campoli, Maria A, Matus-Cádiz, et al. Comparative expression of Cbf genes in the Triticeae under different acclimation induction temperatures[J]. Mol Gene Genomics, 2009, 288(2): 141-152. |
| [8] |
刘晓丹, 李海燕. CBF转录因子在提高植物抗逆性中的作用[J]. 安徽农业科学, 2009, 37(32): 15749-15751. |
| [9] |
Badawi M, Danyluk J, et al. The CBF gene family in hexaploid wheat and its relationship to the phylogenetic complexity of cereal CBFs[J]. Mol Gene Genomics, 2007, 23(27): 533-554. |
| [10] |
Turner JG, Elis C, Devoto A. The jasmonate pathway[J]. The Plant Cell, 2002, 45(7): 153-164. |
| [11] |
Creemn RA, Mullent JE. Jasmonic acid distribution and action in plants: Regulation during development and response to biotic and abiotic stress[J]. Proc Nat Acad Sci USA, 1995, 27(92): 4114-4119. |
| [12] |
Gunther S, Benno PArthtier. The biochemistry and the physiological and molecular actions of jasmonates[J]. Annual Review of Plant Physiology and Plant MolecularBiology, 1993, 32(44): 569-589. |
| [13] |
蔡昆争, 董桃杏, 徐涛. 茉莉酸类物质(JAs)的生理特性及其在逆境胁迫中的抗性作用[J]. 生态环境, 2006(2): 397-404. |
| [14] |
齐付国, 李建民, 等. 冠菌素和茉莉酸甲酯诱导小麦幼苗低温抗性的研究[J]. 西北植物报, 2006, 33(9): 1776-1780. |
| [15] |
马利明. 小麦不同生育期冻害发生特点及补救对策[J]. 河南农业, 2010(3): 27-28. |
| [16] |
高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006.
|
| [17] |
张志良, 瞿伟菁. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2003.
|
| [18] |
王璐. 普通小麦(Triticum aestivum L. )晋麦47中DREB转录因子基因的克隆及表达分析[D]. 保定: 河北农业大学, 2013. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2386690
|
| [19] |
熊结标. 拟南芥转录因子CBF1及NAC基因的克隆与原核表达[D]. 南昌: 南昌大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10403-1016031624.htm
|
| [20] |
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [21] |
Artus NN, Uwmura M, Steponkus PL, et al. Constitutive expression of the cold-regulated Arabidopsis thaliana COR15agene affects both chloroplast and protoplast freezing tolerance[J]. Proc Nat Acad Sci, 1996, 93(13): 404-409. |
| [22] |
Baker S, et al. The 5'-region of Arabidopsis thaliana COR 15a has cis-acting elements that confer cold-drought-and ABA-regulated gene expression[J]. Plant Mol Biol, 1994, 6(24): 701-713. |
| [23] |
花庆, 刘小刚, 张静雅, 等. 小麦冷驯化相关基因及抗寒性分子机理研究进展[J]. 中国农学通报, 2012, 28(36): 8-22. DOI:10.3969/j.issn.1000-6850.2012.36.002 |
| [24] |
李志亮, 等. 脯氨酸与植物抗渗透胁迫基因工程改良研究进展[J]. 河北师范大学学报, 2005, 21(4): 404-408. |
| [25] |
李鹏, 孙明柱, 张凤云, 等. 小麦抗寒生理生化特性与分子机理研究进展[J]. 山东农业科学, 2013, 45(9): 134-137. |
| [26] |
刘彧, 赵秀兰, 李欢庆. 茉莉酸甲酯抑制小麦根生长及体内抗氧化酶活性变化[J]. 安徽农业科学, 2007, 35(4): 988-989. |
| [27] |
王俊斌, 李明, 丁博, 等. 茉莉酸甲酯诱导保卫细胞气孔关闭的信号转导机制[J]. 中国细胞生物学报, 2013, 35(2): 224-228. |
| [28] |
牛吉山, 刘靖, 马文斌, 等. 茉莉酸甲酯诱导的小麦白粉病抗性与9个抗病相关基因表达(英文)[J]. Agricultural Science & Techno-logy, 2011, 12(4): 504-508. |
| [29] |
蔚慧欣, 高利, 刘太国, 等. 外源茉莉酸甲酯诱导小麦抗条锈病的研究[J]. 植物病理学报, 2016, 46(2): 190-197. |
| [30] |
Shahzad R, Waqas M, Khan AL, et al. Foliar application of methyl jasmonate induced physio-hormonal changes in Pisum sativum under diverse temperature regimes[J]. Plant Physiol Biochem, 2015, 34(96): 406-416. |
| [31] |
Kosová K, Prášil IT, Vítámvás P, et al. Complex phytohormone responses during the cold acclimation of two wheat cultivars differing in cold tolerance, winter Samanta and spring Sandra[J]. Journal of Plant Physiology, 2012, 169(6): 567-576. DOI:10.1016/j.jplph.2011.12.013 |
| [32] |
王兴. 外源激素调控冬小麦抗寒性的研究[D]. 哈尔滨: 东北农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10224-2010264274.htm
|
| [33] |
李速. 外源水杨酸提高小麦抗寒性的应用研究[D]. 哈尔滨: 东北农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10224-1015397062.htm
|





