2. 无锡市疾病预防控制中心,无锡 214023
2. Wuxi Center for Disease Control and Prevention, Wuxi 214023
微囊藻毒素(MC)是一种环状七肽物质,是古生物蓝藻的代谢释放产物,有多种异构体,对动物和人有强烈的肝毒性[1-2]。其中最常见、水体含量高、毒性最大的是MC-LR,能诱发肝癌,低剂量的MC-LR还能损伤神经细胞、生殖细胞,甚至危害肾、肺等器官[2-8]。在淡水水体富营养化的今天,蓝藻爆发事件时有发生,代谢产物MC-LR对人类的健康构成了严重威胁,而此毒素在水体中自然降解缓慢,使用现行自来水处理工艺难以去除[9-14]。鉴于此,我国制定标准《GB5749-2006》要求对饮用水、湖泊水、河水和地表水的MC-LR含量进行定期监测。
因为检测手段的便利程度和准确程度,关系到各水厂和环保单位,关系到对蓝藻水华的控制、对水环境的综合治理,关系到居民饮用水安全和经济发展,意义重大。因此,建立符合我国实际情况,快速、准确、现场检测MC-LR的方法,必要而且迫切,具有良好的应用前景和推广价值。
目前常用的MC-LR检测方法包括:高效液相色谱法和酶联免疫法[15-18],这些方法各自的特点如下:前者测得结果准确,但采用的仪器昂贵、操作繁琐、成本高;以后者为代表的免疫分析方法价格低、操作相对简单,但存在或仅能定性、准确度欠佳,或不能单样本检测等缺点,因此上述方法不能实现准确、快速、定量测定MC-LR。因此,本研究拟解决上述问题,运用试纸条层析的优势,建立可快捷、定量、简单检测该毒素的一种方法,并研制相应的试剂。
1 材料与方法 1.1 材料 1.1.1 实验样品水样源于无锡太湖水域,由无锡市疾控中心采样、收集。检测前,样品用0.45 μm膜过滤后,取澄清。
1.1.2 试剂与耗材MC-LR标准品、MC-LR-牛血清白蛋白(MC-LR-BSA)、抗MC-LR多克隆抗体、MC-LF,均由无锡市疾病预防控制中心提供。羊抗鼠IgG由武汉华美提供。含有荧光染料异硫氰酸的高分子纳米微球,购自biodot公司。样品垫、硝酸纤维素膜、吸水纸和卡壳,购自杰一公司。碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS)由Sigma公司提供。MC-LR ELISA试剂盒,由江苏省苏微微生物研究有限公司提供。其他试剂均为沪试分析纯。
1.1.3 仪器免疫层析定量分析仪,上海互帼公司;ELX800酶标仪,美国BioTek公司;5417R离心机,美国Eppendorf公司;超声仪,深圳洁康公司;喷金划膜仪和切条机,杭州赛凯生物公司。
1.2 方法 1.2.1 试纸条的制备 1.2.1.1 MC-LR抗体的预处理将MC-LR单克隆抗体、MC-LR-BSA和羊抗鼠IgG,分别用0.05 mol/L(pH 7.2)的磷酸盐缓冲液在4℃下透析过夜。
1.2.1.2 结合垫的制备在高分子纳米微球溶液中加入碳二亚胺(EDC)(终浓度为20 mmol)和预处理过的MC-LR抗体,室温反应2 h,离心,去除上清液后,加入样品稀释液(含有1%BSA的0.05 mol/L,pH 7.2的磷酸盐缓冲液)至微球浓度为1.0 g/L,待用。用喷金划膜仪以3 μL/cm-5 μL/cm的量将制备好的微球喷涂于聚酯膜形成的结合垫上,避光的条件下于35-38℃烘干1 h,加入干燥剂封存备用。
1.2.1.3 硝酸纤维素膜的制备使用含1%蔗糖的0.02 mol/L,pH 7.4的磷酸盐缓冲液,分别将透析过的MC-LR-BSA抗原和1 g/L的羊抗鼠IgG抗体,使用定量喷膜仪以1 μL/cm的量将两者以一定的间隔喷于硝酸纤维素膜上,35-38℃烘干1 h,加入干燥剂封存备用。
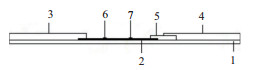
1.2.1.4 试纸条的组装在底板中间先铺设硝酸纤维素膜,然后在与质控线相临近的一端铺吸水纸,使吸水纸与硝酸纤维素膜部分重叠;在与检测线相临近的一端铺结合垫,使硝酸纤维素膜与结合垫部分重叠;最后贴样品垫。试纸条结构如图 1所示。用切条机切按0.4 cm宽度斩切后,装入塑料卡壳中。
|
| 图 1 MC-LR-POCT试纸条结构 1:底板;2:硝酸纤维素膜;3:吸水纸;4:样品垫;5:结合垫;6:质控线;7:检测线 |
使用前,先将试纸条和其他试剂室温放置15 min。将10 μL样品或者MC-LR标准品与50 μL样品缓冲液,滴加入试纸条的样品垫上,室温放置一定时间后,将试纸条卡壳放入检测仪器中读数,仪器可根据测定荧光值自动计算出样品的MC-LR浓度值。
1.2.3 统计学分析每个样品均检测3次,对应数据用均值(X)或X±变异系数(X±SD)表示。用Origin 8.0软件绘制曲线。
2 结果 2.1 反应原理MC-LR-荧光纳米免疫层析采用竞争型反应,经毛细管作用,样品中的MC-LR向结合垫方向移动,然后,带动了结合垫处耦联着MC-LR抗体的荧光微球向硝酸纤维素膜方向移动。当混合物到达检测线时,游离抗原、固定相人工抗原与荧光微球表面的抗体竞争结合,最终在检测线处形成抗原-抗体复合物。未被检测线捕获的微球,将与质控线上的羊抗鼠二抗,形成免疫复合物。其中,样品中MC-LR的含量与检测线上的荧光强度呈反比,荧光信号的强弱由数值显示,这使得样品浓度的定量成为可能。
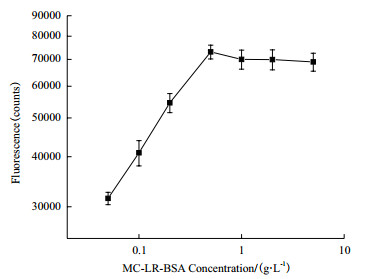
2.2 检测线抗原浓度的选择检测线抗原的浓度与抗体结合的效率决定了反应的信号强度,因此本研究率先探讨了检测线上MC-LR人工抗原的含量。使用1 μg/mL微球喷涂与结合垫,针对空白样品做检测,结果见图 2。由图所示,0.5 g/L的MC-LR人工抗原适合喷涂在检测线上,此时可以在检测线获得较高的荧光信号。
|
| 图 2 检测线上MC-LR-BSA含量与荧光信号强度的关系 |
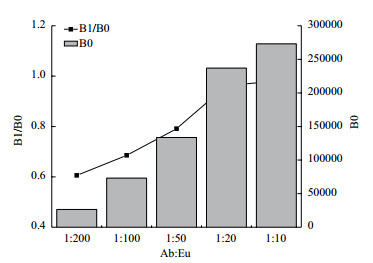
预处理过的MC-LR抗体和微球按照不同的质量比1:200-1:10,与EDC混合反应。获得的微球按照1 μg/L喷涂在结合垫上。用0和1 μg/L的MC-LR标准品作为样品,考察按照不同质量比标记的微球对反应结果的影响。测0 μg/L浓度样品时,有最高荧光值B0;1 μg/L与0 μg/L的比值B0/B1作为竞争反应效率的反映,比值越大,说明1 μg/L与空白浓度的区分度越大。结果见图 3,可知抗体与微球反应比率为1:50(wt:wt)时,免疫反应竞争结合效率较高,空白样本的荧光值也相当较高,因此选为本研究的工作比率。
|
| 图 3 微球标记量对结果的影响 |
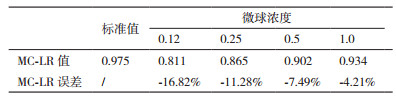
将微球用含有1%BSA,0.1%NaN3的0.05 mol/L,pH7.2的磷酸盐缓冲液稀释到0.12 μg/mL,0.25 μg/mL,0.5 μg/mL,1.0 μg/mL等不同的浓度,并进行喷涂等处理,然后按前述方法反应检测。结果见表 1,从上面的数据可以看到,喷涂不同的微球浓度,检测结果误差不同。当微球浓度较低时,标记抗体量不足,导致检测结果偏低,误差过大。当喷涂浓度为0.5 μg/L或以上时,误差降低,可控制在10%以内,从成本考虑,0.5 μg/mL的喷涂浓度合适。
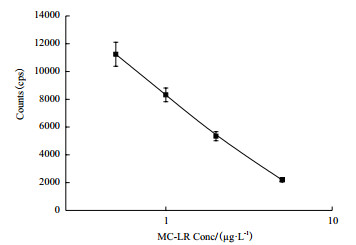
根据优化的条件制备MC-LR免疫层析试纸条,即以0.5 g/L的MC-LR人工抗原喷涂检测线,抗体与微球反应比率为1:50,使用该微球以0.5 μg/L的浓度喷涂于结合垫上。在试纸条的加样区加入不同浓度的MC-LR标准品(取6个不同的浓度,分别为0 μg/L、0.5 μg/L、1 μg/L、2 μg/L、5 μg/L,每个浓度做5个平行样)。膜层析反应15 min后,仪器读取T、C线信号,以检测的样品荧光值信号为纵坐标,MC-LR标准品浓度为横坐标,建立方程并拟合得到标准曲线y = 730.42x2 -6158.4x + 14665(R2 = 0.985),见图 4,然后通过该标准曲线得到标准卡,作为对样品中所含MC-LR浓度进行定量分析的基础。
|
| 图 4 MC-LR荧光纳米免疫层析法的工作曲线 |
采用重复测定10孔空白标准品荧光值,以X-2SD计算,再带入标准曲线获得对应的浓度值,即为本研究测定MC-LR的灵敏度0.195 μg/L。
2.6.2 准确性本方法的准确性由添加回收率反映,即向空白水样中添加0.5、2 μg/L低、高浓度的标准物质,对应的MC-LR浓度分别为0.517±0.041和1.906±0.095 μg/L。回收率分别为103.4%和95.3%,平均回收率99.4%。方法回收率于90%-110%内,说明本研究的检测结果准确。
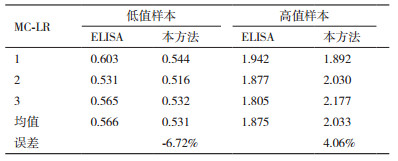
2.6.3 可靠性与精密度取试纸和市售的MC-LR酶联免疫试剂盒(ELISA),分别测试同一样品,重复3次,验证试纸的检测结果准确性。表 2结果说明:用该试纸和市售试剂盒检测的误差均小于10%,本方法的变异系数(SD/X)小于10%,该试剂的检测结果准确可靠。
MC-LF为MC-LR的异构体,三孔测定2 μg/L的MC-LF对应的MC-LR含量,结果交叉反应率为1.75%,说明本方法采用的单克隆抗体特异性较好。
2.6.5 稳定性在加速稳定性试验中,将试剂于37℃放置6 d若稳定,则代表该试剂可在2-8℃保存6个月。将市售的MC-LR-ELISA试剂与37℃放置6 d的试剂比较,标准品系列的荧光强度下降幅度低于10%,说明试剂在2-8℃可以保存6个月,可满足实际使用的需要。
3 讨论随着生物传感技术的发展,以及设备的小型化、便捷化,免疫层析技术得到进一步发展和快速推广应用。采用这一方法研发的试剂,一般情况下,加样15 min后,即可读取检测结果[19]。常见的免疫层析标记物为胶体金,对应的试纸条不需外部检测仪器,只需裸眼即可读取检测结果,可用于定性分析,区分阴阳性结果[18, 20-21]。但这种标记物不能用于精确定量检测,也很难将弱阳性结果区分开来。因此,尤其对MC-LR这样需要定量分析的小分子物质,传统的免疫层析技术尚不能完全满足监测要求。
本实验所述定量检测MC-LR的纳米荧光免疫层析试剂将纳米荧光免疫技术、竞争法测抗原与具体试纸结构相结合,形成了一种可用于单次、定量检测MC-LR含量的试纸条,解决了现有纳米荧光荧光分析技术中MC-LR试剂不适合单样本、小批量检测的问题,也解决了现有的免疫层析技术仅能定性,不能准确定量的问题。本方法所述MC-LR高分子纳米微球,解决了荧光染料发光效率低从而造成检测不准确的问题,进而提高了检测灵敏度,达到0.195 μg/L,远低于1 μg/L的国家标准。方法的线性工作范围达到5 μg/L,特异性强,与市售商品化试剂盒一致性好,因此可以满足实际使用需求。
4 结论本研究开发的定量检测MC-LR的纳米荧光免疫层析试纸,由荧光免疫层析试纸条和外壳组成,简单操作,性能稳定,对试剂长期存储有利;采用的仪器小,对工作环境要求低,便于推广使用。所述MC-LR检测试纸条灵敏度高,准确性好,操作快捷,具有实用性和良好的应用前景。
| [1] |
郁晞, 高红梅, 彭丽霞, 等. 淀山湖微囊藻毒素-LR的污染状况及居民肝功能的调查[J]. 环境与职业医学, 2010, 27(3): 153-155. |
| [2] |
Dietrich D, Hoeger S. Guidance values for microcystins in water and cyanobacterial supplement products(blue-green algal supplements):a reasonable or misguided approach?[J]. Toxicology & Applied Pharmacology, 2005, 203(3): 273-289. |
| [3] |
Covaci O I, Sassolas A, Alonso G A, et al. Highly sensitive detection and discrimination of LR and YR microcystins based on protein phosphatases and an artificial neural network[J]. Analytical & Bioanalytical Chemistry, 2012, 404(3): 711-720. |
| [4] |
Li Y, Han X. Microcystin-LR causes cytotoxicity effects in rat testicular Sertoli cells[J]. Environmental Toxicology & Pharmacology, 2012, 33(2): 318. |
| [5] |
周珏, 刘冉, 李晓波, 等. 微囊藻毒素-LR对PC12细胞氧化性损伤作用的实验研究[J]. 癌变突变畸变, 2012, 24(5): 349-351. |
| [6] |
He S, Liang XF, Sun J, et al. Induction of liver GST transcriptions by tert -butylhydroquinone reduced microcystin-LR accumulation in Nile tilapia(Oreochromis niloticus)[J]. Ecotoxicology & Environmental Safety, 2013, 90(3): 128-135. |
| [7] |
Wang J, Lin F, Cai F, et al. Microcystin-LR inhibited hippocampal long-term potential via regulation of the glycogen synthase kinase-3β pathway.[J]. Chemosphere, 2013, 93(2): 223-229. DOI:10.1016/j.chemosphere.2013.04.069 |
| [8] |
Xu P, Zhang XX, Miao C, et al. Promotion of melanoma cell invasion and tumor metastasis by microcystin-LR via phosphatidylinositol 3-kinase/AKT pathway.[J]. Environmental Science & Technology, 2013, 47(15): 8801-8808. |
| [9] |
夏商周, 杨朝晖. 微囊藻毒素的检测及危害研究进展[J]. 四川环境, 2012, 31(3): 90-93. |
| [10] |
Li D, Yu Y, Yang Z, et al. The dynamics of toxic and nontoxic Microcystis during bloom in the large shallow lake, Lake Taihu, China[J]. Environmental Monitoring & Assessment, 2014, 186(5): 3053-3062. |
| [11] |
胡新梅, 农清清, 赵惠柳, 等. 广西地区原发性肝癌患者血清微囊藻毒素-LR水平研究[J]. 中国全科医学, 2017, 20(11): 1330-1334. DOI:10.3969/j.issn.1007-9572.2017.11.011 |
| [12] |
万翔, 邰义萍, 王瑞, 等. 洱海水华期间饮用水源区产毒微囊藻和微囊藻毒素-LR的分布特征[J]. 环境科学学报, 2017, 37(6): 2040-2047. |
| [13] |
王阳, 徐明芳, 耿梦梦, 等. 基于Monte Carlo模拟法对水源水体中微囊藻毒素的健康风险评估[J]. 环境科学, 2017, 38(5): 1842-1851. |
| [14] |
姜蕾. 不同工艺给水厂对典型微囊藻毒素的去除研究[J]. 给水排水, 2017, 53(9): 11-15. |
| [15] |
Poon KF, Lam MH, Lam PK, et al. Determination of microcystins in cyanobacterial blooms by solid-phase microextraction-high-performance liquid chromatography[J]. Environ Toxicol Chem, 2001, 20(8): 1648-1655. |
| [16] |
Mountfort DO, Holland P, Sprosen J. Method for detecting classes of microcystins by combination of protein phosphatase inhibition assay and ELISA:comparison with LC-MS[J]. Toxicon, 2005, 45(2): 199-206. DOI:10.1016/j.toxicon.2004.10.008 |
| [17] |
沈强, 李嗣新, 胡俊. 微囊藻毒素HPLC快速检测方法研究[J]. 环境科学与技术, 2017(2): 103-106. |
| [18] |
Liu L, Xing C, Yan H, et al. Development of an ELISA and immunochromatographic strip for highly sensitive detection of microcystin-LR[J]. Sensors, 2014, 14(8): 14672. DOI:10.3390/s140814672 |
| [19] |
刘鑫. 荧光免疫层析分析仪的设计分析[J]. 生命科学仪器, 2015(3): 23-26. |
| [20] |
Zhang GP, Guo JQ, Wang XN, et al. Development and evaluation of an immunochromatographic strip for trichinellosis detection[J]. Veterinary Parasitology, 2006, 137(3): 286-293. |
| [21] |
Wen-de W, Min L, Ming C, et al. Development of a colloidal gold immunochromatographic strip for rapid detection of Streptococcus agalactiae in tilapia[J]. Biosensors & Bioelectronics, 2016, 91: 66-69. |