葡萄酒在生产过程中会产生各种各样的副产物,如葡萄籽、葡萄皮等,葡萄籽在葡萄皮渣这些副产物中高达到65%左右。葡萄籽中含有丰富的蛋白质、纤维素、脂肪、矿物质和维生素等营养成分,还富含白藜芦醇[1]。白藜芦醇是一类多酚类化合物,具有广泛的抗癌、抗氧化、抗炎等作用。在清除自由基、保持机体自由基动态平衡,延缓衰老方面也发挥着重要作用[2-3]。酒精是葡萄酒中的主要成分之一,急性酒精摄入对肝脏具有显著的脂质过氧化作用。目前,酒精对肝脏的影响及酒精性肝病发病机制的研究多集中于短期、急性酒精摄入方面,而有关白藜芦醇与酒精对LO2肝细胞氧化损伤模型的构建及氧化损伤保护作用的研究较少。本实验通过酒精诱导构建LO2细胞的氧化损伤模型,并通过D-半乳糖构建衰老小鼠模型,采用白藜芦醇提取物干预后,对细胞及小鼠肝匀浆超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-px)、丙二醛(MDA)含量进行测定,探讨白藜芦醇提取物对肝细胞损伤及延缓衰老的作用,旨为其抗氧化损伤机理研究奠定基础。
1 材料与方法 1.1 材料 1.1.1 细胞株LO2细胞,哈尔滨商业大学细胞与分子生物学研究所保存。
1.1.2 动物昆明种健康小鼠,购自长春亿斯。
1.1.3 实验材料葡萄籽(购自哈尔滨家乐福超市);白藜芦醇(≥98%,西安玉泉生物科技有限公司);四甲基氮唑盐(Sigma公司);RPMI1640培养基(四季青);双抗(碧云天);胎牛血清(Hyclone);MDA、SOD和GSH-Px试剂盒(南京建成生物工程研究所)。
1.1.4 实验仪器SX-700型高压灭菌锅(TOMY);高效液相色谱仪Agilent1200(Agilent);质谱仪API3000(Applied Biosystems);酶标仪ELx800(BioTek),CO2培养箱(memmert);生物安全柜(Airstream)紫外分光光度计(HALO DynamicaDB-20),电热恒温水浴锅(上海华运分析仪器有限公司)。
1.2 方法 1.2.1 葡萄籽中白藜芦醇的提取及检测将葡萄籽经过粉碎机粉碎,过80目筛之后,准确称取粉碎后的葡萄籽样品。分别通过乙醇浸提法、热回流提取、超声波辅助提取、超声波辅助双水相提取等方法对葡萄籽中的白藜芦醇进行提取。超声波辅助双水相提取是在葡萄籽样品中加入一定量的乙醇-硫酸铵双水相体系溶剂放入恒温水浴锅内浸提,取出后用超声提取。提取完毕后料液经抽滤后,得到上下相,上相用旋转蒸发仪浓缩,得葡萄籽粗提物。将粗提物用乙醇溶解,备用[4-7]。每种方法均取10.00 g葡萄籽粉末于三角瓶中,液料比为1:10、浸提时间40 min、超声功率300 W、超声温度50℃、超声时间10 min,双水相体系为(乙醇:硫酸铵=1:1),处理后抽滤获取上清液浓缩后乙醇溶解。
HPLC检测条件及定量方法如下:安捷伦1200高效液相色谱仪;HIQ Sil C18W(250 mm × 4.6 mm,5 μm)色谱柱;检测波长为291 nm;检测温度为35℃;流动相为乙腈-水(26:74);流速为1 mL/min。采用外标法进行定量[8]。通过检测白藜芦醇的含量计算白藜芦醇提取率计算公式如下:
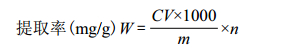
式中:m为葡萄籽粗粉质量(g);C为葡萄籽样品溶液浓度(μg/mL);V为提取后滤液体积(mL);n为滤液中白藜芦醇的含量。
1.2.2 LO2细胞的培养与药效学检测细胞株培养于含10%胎牛血清与1%双抗的RPMI 1640培养基中,将细胞培养瓶于37℃、5%CO2培养箱内连续培养。细胞贴壁长满后,用0. 25%胰蛋白酶消化,传代培养。按如下方法进行MTT法细胞抑制率检测,取处于对数生长期的LO2细胞,使用含有10%胎牛血清与1%双抗的RPMI1640培养液稀释成1×104个细胞/mL;将200 μL细胞悬液分别加入96孔板每个孔中,置于37℃、5% CO2培养箱中培养24 h。每孔中加入不同浓度的白藜芦醇提取物,稀释至需要的工作浓度(0、5、10、20、40、80 μg/mL)。置于37℃、5% CO2的培养箱中培养72 h。首先加入80 μLDMSO,MTT用无血清RPMI1640培养液配成浓度为5 mg/mL的溶液,每孔中加入20 μL,置于37℃、5% CO2孵化培养箱中孵育4 h。吸出上清,加入150 μL DMSO溶解沉淀物,低速摇床震荡10 min,OD480 nm酶标仪检测。药物对LO2细胞的存活率公式:
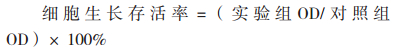
取处于对数生长期的LO2细胞接种于6孔培养板,每孔1×104细胞,培养约12 h后,分为阴性对照组、阳性对照组和不同浓度的白藜芦醇组。阴性对照组不加受试物;阳性对照组只加入100 mmol/L酒精干预6 h,白藜芦醇组(0、5、10、20、40 μg/mL)预处理12 h,各浓度再加入100 mmol/L酒精作用6 h,置于37℃,5% CO2培养箱中培养。干预结束后用0.01 mol/L PBS清洗2次,然后每孔加入细胞裂解液100 μL裂解细胞后于4℃ 12 000 r/min离心15 min取得上清,参照试剂盒要求,测定细胞中MDA水平、SOD活性、GSH-PX活性等相关氧化损伤的指标[9]。阳性对照药选取维生素C(0-40 μg/mL)。
1.2.4 衰老小鼠模型的构建参照《药理学实验方法学》中的方法造模[10]。昆明种小鼠60只,雌雄各半,适应性喂养1周后,平均分为6组,每组各10只小鼠。各组分别作如下处理:(1)正常对照组,每天注射生理盐水;(2)D-半乳糖组,每天注射D-半乳糖;(3)维生素E组,每天注射D-半乳糖及灌胃给药100 mg/kg的维生素E;(4)白藜芦醇提取物高剂量组,每天注射D-半乳糖及灌胃给药150 mg/kg白藜芦醇提取物;(5)白藜芦醇提取物中剂量组,每天注射D-半乳糖及灌胃给药100 mg/kg白藜芦醇提取物;(6)白藜芦醇提取物低剂量组,每天注射D-半乳糖及灌胃给药50 mg/kg的白藜芦醇提取物。生理盐水和D-半乳糖注射剂量均为100 mg/kg,所有试验动物均食用全价混合饲料,自由摄取和取水,连续给药、灌胃10周。
1.2.5 白藜芦醇提取物对衰老小鼠肝MDA水平、SOD活性、GSH-PX活性的影响小鼠猝死后,取肝研磨后,参照试剂盒要求,测定组织研磨液中MDA水平、SOD活性、GSH-PX活性等相关氧化损伤的指标[11-13]。
1.2.6 白藜芦醇的纯化及质谱检测通过硅胶柱层析法对白藜芦醇提取物进一步分离纯化,硅胶与上样量比为50:1,流动向为甲醇:氯仿,梯度洗脱后将目标组分浓缩并溶解于色谱甲醇,0.22 μm滤膜过滤后进行质谱检测。
1.2.7 统计学处理及方法应用SPSS统计软件包进行数据统计学处理。采用ANOVA方差分析并行方差齐性检验;结果以x±s表示。
2 结果 2.1 葡萄籽中白藜芦醇的提取及含量计算对乙醇浸提法、热回流提取、超声波辅助提取、超声波辅助双水相提取等方法对葡萄籽中的白藜芦醇进行提取,并通过检测白藜芦醇的含量计算白藜芦醇提取率。
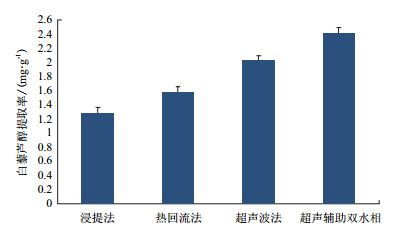
比较几种提取白藜芦醇的方法,超声辅助双水相提取的方法葡萄籽中白藜芦醇的提取率较高,提取效果较好。达到2.408 ±0. 088 mg/g采用超声波集成乙醇-硫酸铵双水相体系萃取分离葡萄籽中的白藜芦醇,同时具有超声与双水相提取的优点。具有较好的提取纯化效果(图 1)。
|
| 图 1 不同提取方法下的白藜芦醇提取率 |
通过MTT法测定了葡萄籽中白藜芦醇提取物对LO2细胞的抑制作用,与空白对照组相比白藜芦醇提取物浓度(0、5、10、20、40 μg/mL)保护组表现为对细胞无明显抑制作用。如图 2所示,在0-40 μg/mL浓度的白藜芦醇提取物作用下,细胞的抑制率≤10%,说明在0-40 μg/mL浓度下对白藜芦醇提取物对LO2细胞无明显抑制作用。
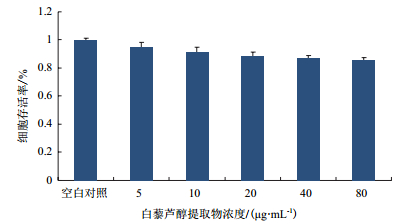
|
| 图 2 白藜芦醇提取物对LO2细胞存活率的影响 |
与空白对照组比较,乙醇诱导模型组细胞裂解液中SOD活性明显降低,GSH-Px活性明显下降,MDA水平明显升高。白藜芦醇提取物作用于LO2细胞后,能够降低乙醇诱导损伤引起的丙二醛(MDA)含量的升高,MDA含量由5.26 nmol/mg蛋白下降为3.44 nmol/mg蛋白。提高SOD和GSH-Px活性,SOD活性由15.38 U/mg蛋白升高至16.91 U/mg蛋白,GSH-Px活性由6.45U/mg蛋白升高至8.58 U/mg蛋白。且变化趋势均呈明显的剂量依赖性,如图 3所示。与阳性对照维生素C(0-40 μg/mL)结果呈现一致性,维生素C作用LO2细胞后,MDA含量下降2.38 nmol/mg蛋白,SOD活性上升3.48 U/mg蛋白,GSH-Px活性上升3.83 U/mg蛋白。
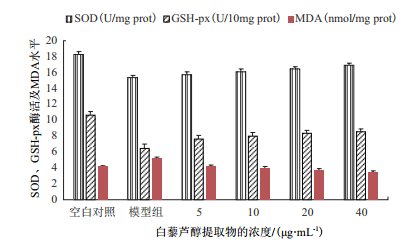
|
| 图 3 白藜芦醇提取物对SOD、GSH-Px活力及MDA水平的影响 |
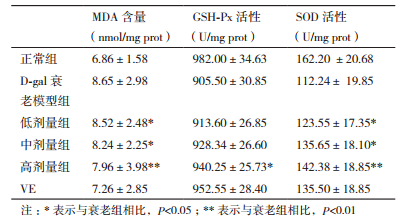
本研究发现白藜芦醇提取物灌胃D-半乳糖致衰小鼠一段时间后,与衰老模型相比,小鼠肝内GSH-Px酶活性略有升高,由905.50±30.85升高到940.25±25.73(U/mg prot)。白藜芦醇提取物对小鼠肝中MPA的产生有轻微的抑制作用,与衰老模型组小鼠相比,提取物抑制MDA产生,由8.65±2.98降至7.96±3.98(nmol/mg prot),3个剂量组MDA含量差异不明显。同衰老模型组小鼠相比,白藜芦醇提取物能显著增强衰老小鼠肝中SOD活性,且随着提取物浓度的增大,SOD活性增强,由112.24± 19.85升高至142.38±18.85(U/mg prot),高剂量组饲喂小鼠肝脏中SOD活性的增强较显著(表 1)。
通过硅胶柱层析法对白藜芦醇提取物进一步分离纯化,洗脱下来富含白藜芦醇的组分。通过质谱检测发现,白藜芦醇纯化组分中含有m/z=226.9的色谱峰,与白藜芦醇标准品一致,说明该组分中富含白藜芦醇。
3 讨论葡萄籽作为一种葡萄酒产业的废弃物,如果能充分利用葡萄籽资源提取白藜芦醇等多酚类成分,可节约资源、变废为宝、保护环境。双水相萃取技术已广泛应用于天然产物的提取分离等领域,乙醇-硫酸铵双水相体系具有黏度小、价格低、分相清晰、绿色环保等特点,而超声波辅助提取具有节省时间和溶剂、提取效率高等特点。超声波辅助双水相提取葡萄籽中白藜芦醇的研究较少。卜晓英等[14]在研究双水相萃取虎杖白藜芦醇提纯工艺中,白藜芦醇含量为0.694%,李一凡等[15]在研究超声波辅助提取葡萄芪化物工艺条件中,芪化物提取量可达104.97 μg/g,张喜峰等[16]在研究乙醇-硫酸铵双水相体系分离纯化葡萄籽总黄酮时发现,双水相体系具有良好的黄酮类化合物萃取能力,总黄酮萃取率达到98.8%。本研究结合超声波和双水相的优势,白藜芦醇的提取率达到了2.408±0.088 mg/g,由于葡萄籽中本身白藜芦醇的含量与虎杖也有所差别,所以与卜晓英的研究相比提取率略低,但与李一凡的研究相比,提取率较高。对于葡萄籽提取物对酒精诱导的LO2细胞以及衰老小鼠模型中SOD、GSH-px和MDA含量的影响可反应出葡萄籽提取物的抗氧化及保护细胞与机体防御氧化应激损伤的能力。对于这部分的研究目前也较少,周晓云等[17]研究发现白藜芦醇对小鼠酒精性肝损伤有抑制作用,因而对肝细胞起保护作用,与本研究结果一致。白藜芦醇的功能目前已经受到了人们的广泛认可。本课题组也将对白藜芦醇的保护细胞氧化损伤机理及延缓衰老功能机理进一步深入研究。
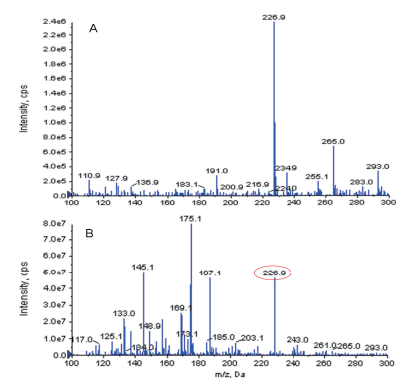
|
| 图 4 白藜芦醇及白藜芦醇纯化组分的质谱图 A:白藜芦醇;B:白藜芦醇纯化组分 |
本研究通过超声波辅助双水相法对葡萄酒产业废弃物葡萄籽进行白藜芦醇的提取纯化,白藜芦醇提取率达到2.408±0.088 mg/g。白藜芦醇提取物降低了乙醇诱导引起的丙二醛含量升高,且能显著提高SOD和GSH-px的活性。白藜芦醇提取物对衰老模型小鼠肝中丙二醛的产生有一定的抑制作用,且能够提升SOD和GSH-px的活性。
| [1] |
贾荣. 山葡萄籽提取物及抗氧化活性的研究[D]. 长春: 吉林大学, 2010. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=spgykj201218038
|
| [2] |
夏兰兰, 张雅丽, 朱磊, 等. 葡萄籽多酚化合物抗氧化能力与抗癌细胞增殖活性的评价[J]. 食品科技, 2011(11): 174-178. |
| [3] |
刘以娟, 范方辉, 王芳兵, 等. 葡萄籽提取物体外抗氧化活性的研究[J]. 食品工业科技, 2012(18): 143-151. |
| [4] |
张喜峰, 李彩霞, 张瑾, 等. 超声集成双水相体系提取葡萄籽中的原花青素[J]. 天然产物研究与开发, 2013, 25: 444-449. DOI:10.3969/j.issn.1001-6880.2013.04.004 |
| [5] |
胡佳钦, 向福, 石长萍, 等. 金银花中绿原酸的双水相萃取及抗氧化能力研究[J]. 中国酿造, 2014, 34(12): 109-112. |
| [6] |
陈姗姗, 王丹, 张超, 等. 紫甘薯花色苷在双水相萃取体系中的分配特性[J]. 食品科学, 2013, 34(19): 76-79. DOI:10.7506/spkx1002-6630-201319017 |
| [7] |
李超, 等. 超声强化亚临界水提取脱脂葡萄籽中原花青素的工艺及其抗氧化研究[J]. 中国中药杂志, 2010(8): 967-972. |
| [8] |
曹雪杰, 高明波, 朴晶晶. 双水相萃取双优红葡萄籽中的白藜芦醇[J]. 广州化工, 2015, 43(11): 65-67. DOI:10.3969/j.issn.1001-9677.2015.11.024 |
| [9] |
黄娜娜. 柑橘精油抗氧化特性及对皮肤细胞氧化损伤的保护作用研究[D]. 武汉: 华中农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10504-1016155956.htm
|
| [10] |
徐叔云, 卞如镰, 陈修. 药理实验方法学[M]. 第2版. 北京: 人民卫生出版社, 2008, 1465-1466.
|
| [11] |
王玉娇. 草苁蓉多糖对肝细胞氧化损伤的保护作用[D]. 延边: 延边大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10184-1014358246.htm
|
| [12] |
周玲芝. 白藜芦醇酒剂对老龄小鼠MDA、SOD和GSH-PX的影响[J]. 湖南中医药大学学报, 2010, 30(7): 45-46. |
| [13] |
赵旭, 刘寿荣, 冯仙菊, 等. 从氧化应激谈白藜芦醇对高尿酸介导的非酒精性脂肪肝大鼠的影响[J]. 中华中医药学刊, 2016, 34(5): 1193-1195. |
| [14] |
卜晓英, 姚姝凤, 许新军. 微波程序控温控压辅助双水相萃取虎杖果实中白藜芦醇与大黄素的研究[J]. 林产业化学与工业, 2016, 36(5): 113-119. |
| [15] |
李一凡, 等. 响应面法优化超声波辅助提取玫瑰香葡萄中芪化物的工艺条件[J]. 食品工业科技, 2016(20): 258-262. |
| [16] |
张喜峰, 杨春慧, 等. 乙醇/硫酸铵双水相体系分离纯化葡萄籽总黄酮[J]. 食品与发酵工业, 2013(10): 254-258. |
| [17] |
周晓云, 崔晓明, 崔国金, 等. 白藜芦醇对小鼠酒精性肝损伤的抑制作用[J]. 河北联合大学学报:医学版, 2014, 16(1): 3-5. |