2. 青岛农业大学食品科学与工程学院,青岛 266109
2. School of Food Science and Engineering, Qingdao Agricultural University, Qingdao 266109
酵母菌在工业领域中的许多方面发挥着重要的作用,但工业生产环境对于酵母并非最佳的生理环境,基中包括葡萄酒的酿造环境[1]。在发酵过程中酵母会受到各种环境因素的影响,目前已有大量文献报道了单一环境条件对酵母的影响,如温度、酒精、渗透压等[2]。但实际生产中酵母菌面对的环境通常是由几种因素共同作用的[3]。通过文献检索发现,目前对两种或两种以上环境因素共同作用的研究相对较少[4]。
较低的pH值(通常低于4)是酵母所面临的主要胁迫[5]。培养液中的pH值,即氢离子浓度会影响酵母原生质膜所带的电荷,引起原生质膜对某些离子渗透性的改变,从而影响酵母细胞对某些重要离子的吸收[6]。
无机离子(如Ca2+、Mg2+、Zn2+和K+等)是酵母细胞生长所必须的营养元素[7],其中Ca2+在保护细胞膜结构和功能的完整,稳定细胞壁的结构,调节酶的活性等方面发挥重要的作用[8]。除此之外,作为第二信使,由钙调蛋白(Ca2+/calmodulin)调控的生物信号传导在细胞应对环境压力时起着关键作用[9]。目前研究表明Ca2+的存在可以缓解发酵过程中酒精胁迫所带来的毒害作用。前期的研究亦得到同样的结论,同时还发现Ca2+可以提高质膜H+-ATPase的活性[10]。质膜H+-ATPase是细胞质膜上的一种重要功能蛋白,其活性依赖于介质阳离子的浓度,如Mg2+、K+、Ca2+等[11]。H+-ATPase能水解ATP产生能量,利用水解ATP产生的能量将细胞质膜内侧的H+泵到质膜外侧,产生跨膜pH梯度,起到平衡pH的作用[12]。
因此,Ca2+在调节细胞内外H+浓度(pH)方面起着重要的作用[13]。前人的研究表明,培养基中pH和K+的相互作用是影响发酵进程的一个关键因素,当发酵液中pH值和K+的含量均很低时,会导致发酵不彻底;而且只有当pH较低的条件下,K+的促进作用才会表现出来[14]。Ca2+和pH值协同作用对细胞产生的影响目前还未见报道。
本文研究Ca2+和pH相互作用对酵母代谢的影响,并从酵母细胞膜通透性和完整性的角度探讨影响酵母细胞的代谢的机制,更加系统地阐述Ca2+和pH协同作用对酵母细胞的作用。
1 材料与方法 1.1 材料 1.1.1 菌株Saccharomyces cerevisiae AWRI R2是一株商业葡萄酒酿酒酵母,由Marivin(Australian)公司商业化,具有良好的发酵性能[15]。
1.1.2 培养基(1)YPD培养基:酵母膏1%、蛋白胨2%、葡萄糖2%。(2)模拟葡萄汁培养基:葡萄糖10%,果糖10%,KH2PO4 0.5%,MgSO4·7H2O 0.04%,酵母膏0.1%(于121℃灭菌20 min),(NH4)2SO4 0.2%。模拟葡萄汁培养基是一种模拟标准葡萄汁的组成成分,且成分确定的培养基,利用此培养基可以保证培养条件的一致性,为实验的准确性和重复性提供保证[16]。
1.1.3 试剂高效液相的标样购自Sigma(Castle Hill,NSW,Australia),为色谱纯;葡萄糖、果糖、KH2PO4、MgSO4·7H2O、酵母膏、(NH4)2SO4、蛋白胨、盐酸,氢氧化钠、丙酮、CaCl2、DNS试剂、二乙酸荧光素(FDA)溶液、碘化丙锭(PI)溶液均为分析纯。
1.2 方法 1.2.1 酵母菌发酵条件的确定 1.2.1.1 酵母菌接种量的确定pH确定在3.0,Ca2+浓度选择1×10-1、1×10-4 mol/L,接种量选择1×106、4×106、1.2×107 CFU/mL,进行6组发酵实验。28℃、120 r/min摇床培养,定期取样,测定残糖含量,根据结果确定接种量[17]。
1.2.1.2 pH和Ca2+处理水平的确定在确定的接种量下,Ca2+浓度选择1×10-1、1×10-2、1×10-3、1×10-4 mol/L,pH设定在3.0、3.25、3.5,进行12组发酵试验。28℃、120 r/min摇床培养,定期取样,测定残糖含量,根据实验结果确定pH(L1)和Ca2+(La、Lb)的处理水平。
1.2.2 pH和Ca2+的协同作用对酵母的作用实验选取6个不同的发酵体系(表 1),(Ca2+浓度为0时记为Lc,pH为5.5时记为L2)将菌液分别接入不同的发酵体系中,28℃、120 r/min摇床培养,定期取样考查CO2释放量和残糖含量。
每天同一时间对所有发酵瓶进行称重,得出每天CO2的释放量[18]。
1.2.2.2 残糖含量的测定将培养至各时间点的模拟葡萄汁发酵培养液置于超净工作台中取样5 mL,离心得上清液进行检测。参照Ciani等[19]的方法,发酵液中葡萄糖和果糖的含量采用高效液相色谱法(Waters-2695),色谱条件:Bio-Rad HPX-87H色谱柱(300 mm×7.8 mm),示差检测器(RID,waters-2414)。柱温65℃,流速0.6 mL/min,等度洗脱,进样量10 μL,以峰面积外标法定量。流动相为0.005 mol/L H2SO4,经溶剂过滤器过滤,滤膜为0.22 μm水相膜(四氟乙烯膜)。
1.2.3 pH和Ca2+水平对酵母细胞膜的通透性的影响 1.2.3.1 电导率的测定定期量取培养基测定电导率。将电导率仪探测头没入培养液中,待电导率仪显示屏上的数值稳定时即可读数,记录数据[21]。
1.2.3.2 核酸和蛋白质的测定将发酵液于80℃水浴5 min灭酶,取经处理的发酵液在3 000 r/min离心20 min,取上清液0.2 mL,然后用紫外分光光度计分别在260 nm和280 nm下测定核酸和蛋白质的含量[22]。
1.2.4 pH和Ca2+水平下研究酵母细胞膜的完整性取处于指数期的发酵液2 mL,5 000 r/min离心10 min,蒸馏水清洗一次,然后加入乙二酸荧光素(FDA)20 μL,振荡混合均匀后加入60 μL碘化丙锭(PI)和920 μL无菌水;在室温下避光放置5 min保证染色彻底;染色后在5 000 r/min离心5 min,用蒸馏水清洗1-2次,弃去上清液;最后用蒸馏水悬浮细胞,涂片。用荧光显微镜观察、拍照和检测,保存图片[23]。染色时加入的乙二酸荧光素,保证其终浓度为100 μg/mL,加入的碘化丙锭,保证其终浓度为60 μg/mL。
1.2.5 数据处理每组试验设3个平行,试验结果利用excel软件进行数据统计分析和作图,0.05显著水平。
2 结果 2.1 接种量的确定在确定的pH值和Ca2+浓度下,设定不同的接种量。发酵结束后测定培养基中残糖含量,实验结果如图 1所示。
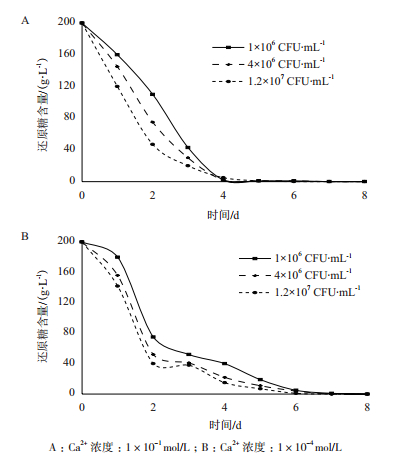
|
| 图 1 酵母菌接种量的确定 A:Ca2+浓度:1×10-1 mol/L;B:Ca2+浓度:1×10-4 mol/L |
在pH为3.0,Ca2+浓度分别为1×10-1、1×10-4 mol/L时,3个不同浓度接种量呈现的耗糖趋势大致相同,如图 1所示。接种量为1×106 CFU/mL时,培养基中糖消耗的最慢;接种量为4×106 CFU/mL和1.2×107 CFU/mL时,培养基中糖消耗的速度依次增加,说明不同的接种量对酵母的代谢具有明显的影响作用。为了更好的控制代谢速度,选择接种量为1×106 CFU/mL。
比较图 1-A和B可以看出,不同的Ca2+浓度下,消耗还原糖的速度表现出不同。当Ca2+浓度为1×10-1mol/L时,在前4 d培养基中糖消耗比较快,第4天还原糖基本耗尽;而当Ca2+浓度为1×10-4mol/L时,在前2 d培养基中糖消耗比较快,之后以相对平稳的速度下降,到第7天才基本消耗完。这说明较高浓度的Ca2+可以促进酵母菌的代谢。
2.2 Ca2+浓度的确定从图 2可以看出在接种量和pH值相同的情况下,随着Ca2+的加入,酵母糖代谢的速度加快。但Ca2+浓度为1×10-1、1×10-2 mol/L的发酵体系中耗糖速度差异较小。为了获得较大的处理差异,最终确定Ca2+浓度为1×10-2、1×10-4 mol/L。比较3个图可以看出,不同pH下消耗还原糖的速度基本相似。都是在发酵第4天还原糖基本消耗完。pH值越低,还原糖在最初消耗的越快。且随着Ca2+浓度的增加,酵母代谢糖越快。说明Ca2+起到了一定的缓解作用。
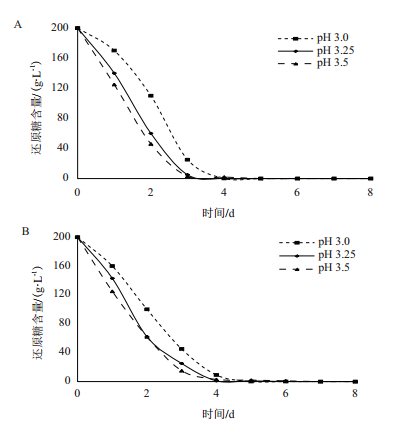
|
| 图 2 Ca2+浓度的确定 A:pH 3.5;B:pH 3.25;C:pH 3.0 |
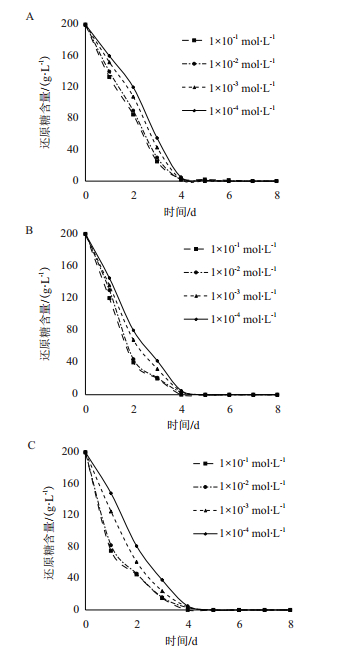
在接种量和Ca2+浓度确定的条件下,pH为3.0的培养基中耗糖速度最慢;pH为3.25和pH为3.5的培养基中酵母耗糖速度逐渐增加,但差距较小(图 3)。结合图 2结果,为了获得较大的处理差异,确定pH值为3.0。
|
| 图 3 pH的确定 A:Ca2+浓度:1×10-2 mol/L;B:Ca2+浓度:1×10-4 mol/L |
根据最适pH值(5.5)以及最终确定的pH(3.0)和Ca2+浓度(0、1×10-2、1×10-4 mol/L)设定不同的发酵体系,如表 2所示。
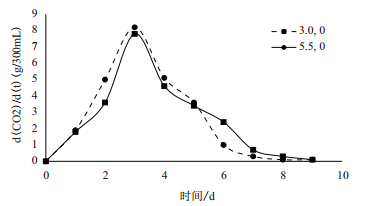
由图 4可以看出,在未添加Ca2+的体系中,pH5.5条件下的CO2释放率比pH3.0的条件下快,使CO2的释放早2-3 d结束。结果表明低pH值明显抑制了酵母细胞的代谢。
|
| 图 4 Ca2+浓度为0时不同pH对CO2释放率的影响 |
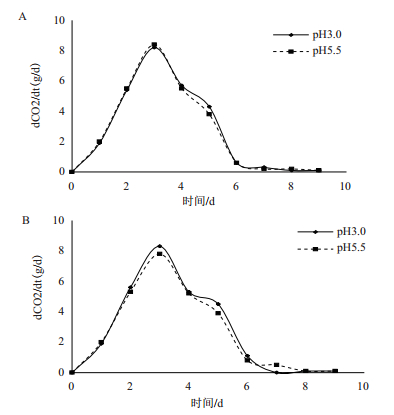
相同Ca2+浓度不同pH下CO2的释放量的情况如图 5所示。当pH为3.0时,CO2代谢速率减慢。比较图 5-A和B可以看出,随着Ca2+的加入,不同pH值对CO2代谢的影响差距逐渐缩小,即随着Ca2+浓度的增大,pH的影响出现微弱的减弱趋势,从而可以得出Ca2+有助于缓解低pH所带来的生理毒害作用,并且浓度越大,缓解作用越明显。
|
| 图 5 相同Ca2+浓度、不同pH值对CO2释放率的影响 A:Ca2+浓度:1×10-2 mol/L;B:Ca2+浓度:1×10-4 mol/L |
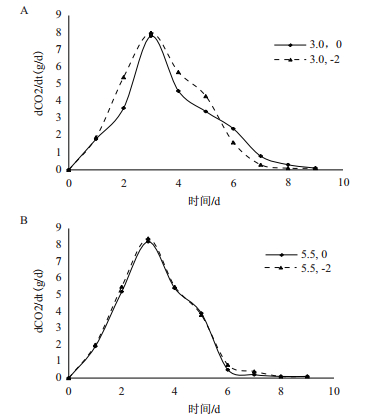
比较图 6-A和B可以看出在低pH环境中,Ca2+对CO2释放速率具有明显的促进作用。而当酵母生长在较适pH环境中,Ca2+的促进作用不明显。
|
| 图 6 相同pH、不同Ca2+浓度对CO2释放率的影响 A:pH 3.0;B:pH 5.5 |
由图 7可以看出,酵母在pH为3.0,Ca2+浓度为1×10-2 mol/L的发酵体系中,CO2的代谢速率与在pH为5.5的体系中代谢速率无明显差异(P>0.05)。结果表明Ca2+可以加快酵母细胞CO2代谢速率和缓解pH的毒害作用,可基本抵消pH的胁迫作用。
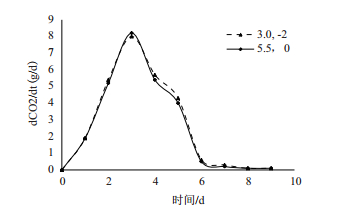
|
| 图 7 pH和Ca2+对CO2释放率的影响 |
如图 8-A所示,与CO2代谢相同,在未添加Ca2+的体系中,pH为5.5时酵母细胞耗糖速率较快。同样证明低pH不利于酵母代谢。比较图 8-B和图C看出随着Ca2+浓度的增大,不同的pH对糖代谢影响的差距逐渐减小,同样说明Ca2+有助于缓解低pH所带来的生理毒害作用,并且浓度越大,缓解作用越明显。
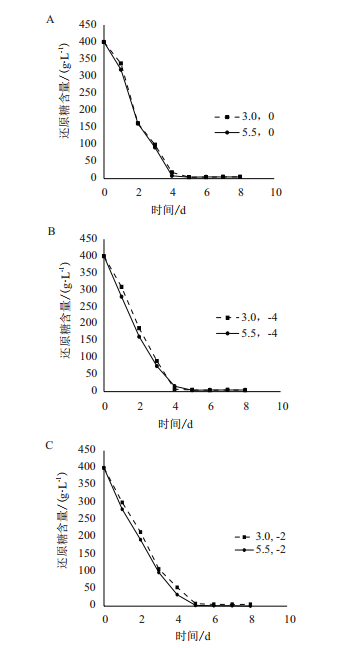
|
| 图 8 相同Ca2+浓度、不同pH对糖利用的影响 A:Ca2+浓度:0 mol·L-1;B:Ca2+浓度:1×10-4 mol·L-1;C:Ca2+浓度:1×10-2 mol·L-1 |
比较图 9-A和B,与CO2代谢特征一致,当酵母生长在较适pH环境中,Ca2+对酵母细胞的糖代谢没有明显影响。
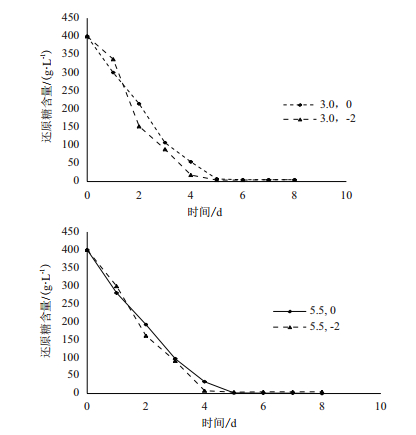
|
| 图 9 相同pH、不同Ca2+浓度下对还原糖利用的影响 A:pH 3.0;B:pH 5.5 |
由图 10可以看出,酵母在pH为3.0,Ca2+浓度为1×10-2 mol/L的发酵体系中糖的代谢速率比在pH为5.5的体系中代谢速率要慢(P<0.05)。结果表明在糖代谢方面,Ca2+虽然可以缓解pH的毒害作用,但不能抵消pH的胁迫作用。
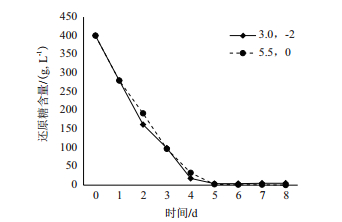
|
| 图 10 pH和Ca2+对糖代谢的影响 |
综上结果表明pH和Ca2+对酵母细胞的生长表现出协同作用。在较适pH下,Ca2+对酵母代谢的促进作用不明显。而当pH较低时,Ca2+表现出明显的促进作用,即Ca2+可缓解pH的毒害作用,但不能完全抵消其胁迫作用。
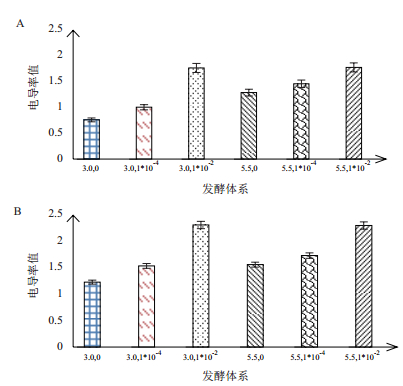
2.5 pH和Ca2+对酵母细胞膜通透性的作用不同发酵体系中的发酵液电导率如图 11所示。相同Ca2+浓度下,相比pH5.5,pH3.0的发酵体系中电导率值明显降低,说明低pH值降低酵母细胞膜的通透性。在pH为3.0时,随着Ca2+浓度的增加,电导率值显著增加,且增长幅度较大,表明细胞膜的通透性显著增加。在pH为5.5时,随着Ca2+浓度的增加,电导率值增长较为缓慢,说明当pH不是胁迫条件的情况下,Ca2+对细胞膜通透性影响较小。
|
| 图 11 不同发酵体系发酵液的电导率 A:发酵第2天;B:发酵第8天 |
结果表明Ca2+在低pH胁迫条件下能明显增加细胞膜的通透性,而细胞膜通透性的增加有助于胞内外营养物质和细胞内代谢产物的互换,克服胞内产物的抑制作用,从而增强酵母的代谢。
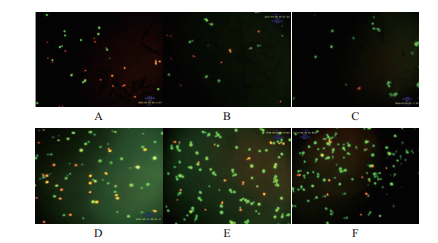
2.6 pH和Ca2+对酵母细胞膜完整性的作用当细胞膜完好无损时,PI不能进入细胞内,此时主要是FDA与细胞内的脂酶相结合产生荧光素,在荧光显微镜下产生绿色荧光信号。细胞膜受损之后PI染料大分子物质才能进入细胞内与细胞内的核酸物质(DNA和RNA)相结合,荧光的颜色向红色转变,使得死亡细胞发出红色荧光。由图 12可知,相同Ca2+浓度下,相比于pH为5.5,pH为3.0的发酵体系中绿色细胞比率较低,根据显色原理说明低pH值破坏酵母细胞膜的完整性,造成细胞死亡。而且当Ca2+的浓度越低,pH为3.0的发酵体系中绿色细胞比率降低越明显。
|
| 图 12 pH和Ca2+的协同作用下对酵母细胞完整性的影响 A:pH为3.0,Ca2+浓度为0;B:pH为3.0,Ca2+浓度为1×10-4;C:pH为3.0,Ca2+浓度为1×10-2;D:pH为5.5,Ca2+浓度为0;E:pH为5.5,Ca2+浓度为1×10-4;F:pH为5.5,Ca2+浓度为1×10-2 |
在同一pH条件下,随着Ca2+浓度的增大,荧光显微镜下绿色细胞的比率越来越大,即活细胞所占的比率越来越大,说明细胞膜的完整性越来越好。但在pH3.0的发酵体系中,Ca2+的影响更加明显。
由实验分析可得Ca2+和pH对酵母细胞代谢影响和对细胞膜的影响作用相同,表明Ca2+可以提高细胞膜的通透性和维持对细胞壁的结构,这与缓解pH的毒害作用密切相关。
3 讨论前人研究表明培养基pH和K+的相互作用是影响发酵进程的一个关键因素。当发酵液中pH值和K+的含量均很低时,会造成发酵不彻底;而且只有在pH较低的条件下,K+的促进作用才会表现出来[24-25]。本文在此基础上对Ca2+和pH的相互作用进行了相关的研究,结果证明了Ca2+和K+具有相似的作用,只有当pH较低时,Ca2+才对酵母代谢表现出明显的促进作用。
周风帆等[26]的研究结果表明钙离子的加人能提高低pH下水蚤的存活率[27];孔繁翔等[28]的研究也表明当培养基中加入适当量的Ca2+,会一定程度保护藻细胞中酸性磷酸酶和硝酸还原酶活性不受低pH的影响。前人的其他研究结果与本研究结果基本一致,进一步证明Ca2+能缓解低pH带来的生理毒害作用,且只有在低pH下Ca2+才表现出作用。而在酵母菌的最适pH下Ca2+并没有发挥大的作用。同时,本研究深入了解了酵母细胞的胁迫应答机制,通过添加适当浓度的Ca2+,更好的解决在葡萄酒发酵初期低pH对酵母细胞的毒害作用;也不会影响酵母细胞对其他重要离子的吸收,更好地控制酵母细胞的酒精发酵进程[29]。酒精发酵作为葡萄酒酿造的关键环节,延迟和停滞(非理想状态发酵)现象一直是葡萄酒酿造领域普遍关注的问题[30]。在本研究基础上可以通过调控pH值和Ca2+的含量比例来优化发酵进程。
由于本研究所采用的培养基是模拟葡萄汁培养基,与实际酿造葡萄酒时的葡萄汁有一定的差别,故在实际生产中可能会出现偏差,应根据实际情况进行调整和改善,以期达到最优结果。
4 结论本文研究了pH和Ca2+协同作用对酵母代谢的影响,结果表明只有当pH较低时,Ca2+才对酵母代谢表现出明显的促进作用。低pH时添加Ca2+能显增强细胞膜的通透性,有助于胞外营养物质进入胞内促进酵母细胞的生理活性及生长代谢;以及有助于胞内代谢产物分泌到胞外,克服胞内产物的抑制作用。另外,Ca2+增强细胞膜的完整性有助于减轻外界环境对酵母细胞的抑制甚至毒害作用。由此从细胞膜的角度解释Ca2+缓解pH生理毒害,促进酵母代谢的机制。
| [1] |
邓成菊, 张建斌, 贾彩红, 等. 香蕉乙二醛酶基因增强酿酒酵母对非生物胁迫抵抗能力的研究[J]. 中国生物工程杂志, 2010(8): 22-26. |
| [2] |
刘兴艳. 低pH对酿酒酵母酒精发酵的影响及酵母应答酸胁迫机制初探[D]. 北京: 中国农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10019-1015582630.htm
|
| [3] |
Kilstrup M, Jacobsen S, Hammer K, Vogensen FK. Induction of heat shock proteins DnaK, GroEL, and GroES by salt stress in Lactococcus lactis[J]. Appl Environ Microbiol, 1997, 63(5): 1826-1837. |
| [4] |
Li RD, Li YY, Lu LY, et al. An improved kinetic model for the acetone-butanol-ethanol pathway of Clostridium acetobutylicum and model-based perturbation analysis[A]. BMC Systems Biology, 2011, 5(Suppl. 1): S12. http://www.ncbi.nlm.nih.gov/pubmed/21689471
|
| [5] |
Wei C, Lan S, Xu Z. Ultracytochemical localization and functional analysis of ATPase during the endosperm development in Oryza sativa L. Agricultural.[J]. Sciences in China, 2003, 2: 144-148. |
| [6] |
陈松海, 韩启德. 细胞内游离Ca2+浓度的调节机制[J]. 生理科学进展, 1993(1): 10-13. |
| [7] |
刘晓艳, 丘泰球, 刘石生. 超声对细胞膜通透性的影响及应用[J]. 应用声学, 2002(2): 26-29. DOI:10.11684/j.issn.1000-310X.2002.02.006 |
| [8] |
刘海臣, 张敏楠, 阮时雷, 等. 多样品耐高温产乙醇酵母的筛选及生长特性研究[J]. 食品科技, 2008(3): 17-21. |
| [9] |
Cardona F, Carrasco P, Pérea-Ortín JE, et al. A novel approach for the improvement of stress resistance in wine yeasts[J]. International Journal of Food Microbiology, 2007, 114: 83-91. DOI:10.1016/j.ijfoodmicro.2006.10.043 |
| [10] |
Heipieper HJ, Weberm FJ, Weber JS, et al. Mechanisms of resistance of whole cells to toxic organic solvents[J]. Trands in Biotechnology, 1994, 12: 409-415. DOI:10.1016/0167-7799(94)90029-9 |
| [11] |
吕园丽, 吴胜举, 马艳, 史小丽. 超声对细胞膜通透性影响的研究现状[J]. 菏泽学院学报, 2007(5): 67-69. |
| [12] |
张旭, 徐维奇. 激光扫描共聚焦显微镜技术的发展及科学仪应用[J]. 现代科学仪器, 2001(2): 21-23. |
| [13] |
于洋, 孔繁翔, 王美林. 应用流式细胞技术研究铜对藻细胞膜完整性及脂酶活性的影响[J]. 应用与环境生物学报, 2006(5): 706-709. |
| [14] |
杜春迎, 赵辉, 赵志昌, 等. 发酵工业中酿酒酵母耐性机制的研究进展[J]. 食品工业科技, 2012, 33(13): 378-382. |
| [15] |
魏娜, 李柏林, 欧杰. 胞膜通透性调节在发酵代谢中的重要性[J]. 食品科技, 2006(9): 14-17. |
| [16] |
杜敬彩, 曹春蕾, 赵刚. 酿酒酵母中与钙离子稳态调控因子ScRCH1细胞质膜定位相关的转录因子基因的筛选检测[J]. 微生物学杂志, 2014(4): 21-26. |
| [17] |
Li H, Gang D, Li HL, et al. Physiological response of different wine yeasts to hyperosmotic stress[J]. American Journal of Enology and Viticulture, 2010, 61: 529-535. DOI:10.5344/ajev.2010.09136 |
| [18] |
Li JY, Huang WD, Wang XQ, et al. Improvement of alcoholic fermentation by calcium ions under enological conditions involves the increment of H+-ATPase activity[J]. World Journal of Microbiology and Biotechnology, 2010, 26: 1181-1186. DOI:10.1007/s11274-009-0286-x |
| [19] |
Ciani M, Beco L, Comitini F. Fermentation behavior and metablic interaction of multistarter wine yeast fermentations[J]. International Journal of Food Microbiology, 2006, 108: 239-245. DOI:10.1016/j.ijfoodmicro.2005.11.012 |
| [20] |
Schmidt SA, Dillon S, et al. Impacts of variations in elemental nutrient concentration of Chardonnay musts on Saccharomyces cerevisiae fermentation kinetics and wine composition[J]. Appl Microbiol Biotechnol, 2011, 91(2): 365-375. DOI:10.1007/s00253-011-3197-3 |
| [21] |
郑丽雪, 谢群凡, 等. 不同pH值酿酒酵母分批发酵生产谷胱甘肽数学模型建立[J]. 食品科学, 2013, 34(13): 162-164. DOI:10.7506/spkx1002-6630-201313035 |
| [22] |
牛书操, 等. 透性化处理对酵母细胞谷胱甘肽分泌能力的影响[J]. 食品工业科技, 2016(17): 175-179, 184. |
| [23] |
赵倩. 根际pH对'平邑甜茶'幼苗生长及Ca2+吸收和分布的影响[D]. 石家庄: 河北师范大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10094-1014256956.htm
|
| [24] |
仉丽娟, 姬厚国, 王玉光, 万利利, 周洪波. 在酵母粉或Cu2+胁迫下古菌Ferroplasma thermophilum与两种中度嗜热细菌的协同作用[J]. 中国有色金属学报, 2013(1): 265-273. |
| [25] |
苑华宁, 黄冬云, 张晖, 等. 反复冻融和超声协同作用破碎酵母细胞[J]. 食品与发酵工业, 2013(12): 62-67. |
| [26] |
周风帆, 蒋锋, 金洪钧, 尹大强. 低PH、铝和钙离子对隆线溞(Daphnia carinata King)生存、生长及繁殖的影响[J]. 南京大学学报:自然科学版, 1992(3): 411-417. |
| [27] |
杨东升, 罗先群, 王新广. CO2对啤酒发酵过程中酵母生长代谢及酯的形成影响[J]. 中国酿造, 2013(4): 70-73. |
| [28] |
孔繁翔, 桑伟莲, 胡伟. 低pH、铝及钙铝比对斜生栅藻(Scenedesmus obliquus)的生理生化影响[J]. 环境科学, 1998(4): 58-60. |
| [29] |
何荣海. 低强度超声波对热带假丝酵母的促增殖效应及其机制研究[C]. 中国食品科学技术学会第十三届年会论文摘要集. 中国食品科学技术学会, 2016: 2. http://cdmd.cnki.com.cn/Article/CDMD-10299-1016728456.htm
|
| [30] |
张瑞刚, 仪慧兰. 活性氧和钙信号参与铅对酵母细胞的毒性作用[J]. 生态毒理学报, 2016(6): 128-133. |