2. 沈阳农业大学土地与环境学院,沈阳 110866
2. Shenyang Agricultural University, College of Land and Environment, Shenyang 110866
生物固氮是自然生态系统中氮的主要来源,陆地生态系统中通过生物固氮输入的氮约110 Tg/a,对全球生态系统氮素循环平衡起着关键作用[1]。固氮菌在自然界分布十分广泛,可固定空气中的游离氮转变为生物可以利用的氮元素,固氮反应是地球上氮素的重要来源。有些固氮菌分泌一些植物激素,促进植物根系生长和对水分及矿物质的吸收[2-4]。过量氮肥的施用抑制土壤中固氮菌的固氮作用,减弱了固氮菌的氮素营养竞争优势,固氮种群呈下降趋势。在减施氮肥的国家调控战略条件下,利用固氮菌资源保持玉米稳产增产成为重要途径。本研究以沈阳农业大学棕壤长期定位试验站玉米栽培土壤为样品来源,分离目标固氮菌。
固氮菌为保障固氮酶在低氧条件发挥作用,经常依靠分泌胞外多糖控制进入细胞的氧浓度。胞外多糖还有助于固氮菌抵抗营养、干燥、不良环境等胁迫,有利于菌体定值在植物根部,所以本研究将高产胞外多糖作为筛选固氮菌的一个重要指标,以期达到获得利于固氮菌体,使减施氮肥土壤补充保持玉米等作物稳产高产需求的目的。
1 材料与方法 1.1 材料 1.1.1 样品来源供试土壤采集于沈阳农业大学棕壤长期定位试验站(北纬40°48',东经123°33')。
1.1.2 培养基阿须贝(Ashby)培养基:KH2PO4(0.2g),NaCl(0.2g),CaCO3(5.0g),CaSO4·2H2O(0.1g),MgSO4·7H20(0.2g),葡萄糖(10.0g),琼脂粉(20.0g)溶于1 000 mL蒸馏水中,pH7.2。LB培养基:酵母浸粉5.0 g,NaCl 10.0 g,蛋白胨10.0 g,琼脂粉20.0 g,溶于1 000 mL蒸馏水中,pH7.0。牛肉膏蛋白胨固体培养基:牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂20.0 g,pH 6.0。优化培养基:蔗糖20.0 g,牛肉膏2.0 g,KH2PO4 0.4 g、MgSO4·7H2O 0.4 g、NaCl 0.4 g、CaSO4·2H2O 0.4 g和CaCO3 2.0 g,溶于1 000 mL蒸馏水中,pH7.0。
生理生化试验用培养基。淀粉培养基:蛋白胨10.0 g,牛肉膏3.0 g,可溶性淀粉2.0 g,NaCl 5.0 g,琼脂20.0 g,溶于1 000 mL蒸馏水中,pH7.0。
葡萄糖蛋白胨水溶液培养基:蛋白胨5.0 g,NaCl 5.0 g,葡萄糖5.0 g,溶于1 000 mL蒸馏水中,pH7.0-7.2。M.R.反应中,所用试剂为甲基红(甲基红0.1 g,95%乙醇300 mL,蒸馏水200 mL)。
柠檬酸盐培养基:NH4H2PO4 0.5 g,柠檬酸钠2.0 g,MgSO4.7H2O 0.2 g,NaCl 1.0 g,溶于1 000 mL蒸馏水中,0.04%酚红液溶液20 mL,pH6.8。将上述营养物质溶解后,将pH调节至6.8,加入指示剂制成黄绿色溶液后,分装到试管中,121℃湿热灭菌30 min。
糖发酵培养基:MgSO4·7H2O 0.2 g,(NH4)2- HPO4 1.0 g,KCl 0.2 g,碳水化合物(葡萄糖和蔗糖)10.0 g,酵母浸粉0.2 g,溶于1 000 mL蒸馏水中,0.04%溴甲酚紫15 mL,pH7.0-7.2。
1.2 方法 1.2.1 土样的采集土壤样品采集时去掉土壤表层的作物残茬,采集深度为0-20 cm。从试验站取得的新鲜土壤样品分别标记并放入已灭菌的塑封袋中,封口,于4℃冰箱中保存。
1.2.2 固氮菌的分离筛选取采集的新鲜土壤样品10 g,放入盛有90 mL无菌水并带有少量小玻璃珠的三角瓶中,180 r/min振荡培养30 min,制成10-1悬浊液,并依次稀释到10-6。选取10-3、10-4和10-5三个稀释梯度的悬浊液,分别吸取0.1 mL稀释液在分离用阿须贝(Ashby)培养基上均匀涂布,置于30℃恒温培养5-7 d,每个梯度设置3次重复。待平板上微生物菌落长出后,挑取单菌落,划线转接于分离用选择性培养基中,30℃培养5-7 d。依此方法连续划线纯化培养,直至获得纯撇杨,划线于试管斜面,于4℃冰箱保藏备用。
1.2.3 粗多糖的提取得到的纯化菌株转接至装有50 mL LB液体培养基的三角瓶中,180 r/min,37℃活化24 h。吸取1 mL已活化的菌株接入装有50 mL新鲜的液体LB培养基的三角瓶中,180 r/min,37℃培养48 h,得发酵液。取10 mL发酵液,5 000 r/min条件下离心10 min,取上清液,加入两倍体积95%无水乙醇,用玻璃棒均匀搅拌至出现絮状沉淀,静置于4℃冰箱中沉淀24 h;10 000 r/min离心15 min得多糖沉淀,自然风干,称重。
1.2.4 菌株鉴定形态学鉴定:将菌株在牛肉膏蛋白胨培养基上进行划线,30℃培养48 d后,对菌落的生长情况、菌落形状、大小、透明度、颜色、光滑度、边缘特征、凹凸度、是否隆起等生物学形状进行观察,并挑取少量已活化的菌落于载玻片上进行涂片,固定。对菌株进行简单染色后用光学显微镜观察,对细胞大小、形状等特征进行观察和记录。生理生化鉴定:参照《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》(第8版)的方法,对菌株进行部分生理生化鉴定。分子生物学鉴定:用细菌基因组快速提取试剂盒提取菌株的基因组DNA。以菌株的基因组为模板,以27F和1492R为引物,采用50 μL PCR反应体系进行PCR扩增。扩增产物由生工生物工程(上海)股份有限公司进行同源性序列分析与比对。根据测序结果构建系统发育树。
1.2.5 生长条件优化WN-F菌株生长曲线的测定:将活化后的菌液接入50 mL牛肉膏蛋白胨培养基中,180 r/min,37℃条件下培养。每隔2 h测定菌液OD600值,直至OD值趋于稳定,作3组对照。
碳、氮源对WN-F菌株生长的影响:在无机盐培养基中分别加入2%的葡萄糖、蔗糖、麦芽糖和乳糖,再分别加入0.1%(NH4)2SO4、磷酸二氢铵、牛肉膏、蛋白胨和酵母浸粉,以不加碳源为对照,接种0.5 mL母液,37℃,180 r/min培养24 h,测定菌体浓度,每组处理设3个重复,以筛选最佳碳氮源组合。
正交试验设计:以最佳碳氮源组合(蔗糖和牛肉膏)、KH2PO4、MgSO4·7H2O、NaCl、CaSO4·2H2O和CaCO3共7个因素,设计7因素3水平正交试验,测定WN-F菌株的最优培养条件;多糖的提取采用乙醇沉淀法。
1.2.6 菌株固氮与产糖关系配置优化培养基,氮源(牛肉膏)分别加入0%、0.5%、1%、1.5%和2%浓度,接种1%活化菌液,37℃,180 r/min振荡培养24 h。每组作3个重复,以空白培养基为对照。分别测定菌体OD600值及产糖量。
2 结果 2.1 固氮菌筛选结果通过分离纯化得到2株在不同土样中均大量存在的菌株WN-E、WN-F。对2菌株产糖能力测定分析表明,相同条件下培养24 h,10 mL发酵液WN-E产糖量为0.06 g,WN-F产糖量为0.08 g,由此,以产糖相对较高的WN-F菌株开展后续研究。
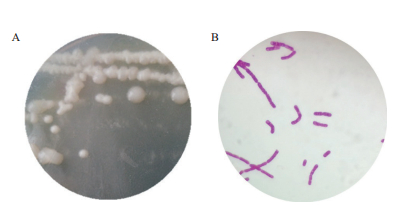
2.2 WN-F菌株的鉴定 2.2.1 WN-F菌株形态学观察WN-F菌株在牛肉膏蛋白胨培养基上生长良好,菌落较大,菌苔较厚,菌落湿润光滑,透明,圆形或近似圆形,边缘整齐且清晰,湿润有光泽,菌落中央凸起,呈乳白色(图 1-A)。WN-F菌体呈长杆状,两端圆形,多排列成长短不一的链状,也有单个分散排列(图 1-B)。
|
| 图 1 WN-F菌落形态(A)WN-F菌体形态放大1600倍(B) |
WN-F菌株部分生理生化特性试验结果见表 1。
WN-F菌株测序长度为1 496 bp,经BLAST比对,该菌株与芽孢杆菌属的16S rDNA的同源性高达99%,结合生理生化及生物学特性试验结果,判定WN-F为芽孢杆菌属,命名为Bacillus sp. WN-F。利用MEGA7.0构建系统树,如图 2所示。

|
| 图 2 WN-F菌16S rDNA序列的系统发育树 |
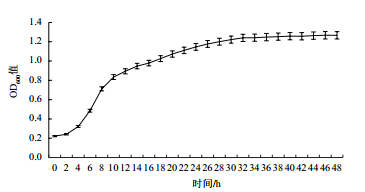
如图 3所示,菌株在接种0-4 h内处于迟缓期,之后进入对数期,此阶段菌株生长较快,12 h开始生长缓慢,到32 h趋于稳定。
|
| 图 3 WN-F菌株生长曲线 |
利用酶标仪测定菌体在不同碳、氮源条件下生长OD600值,结果(表 2)显示,该菌株在以蔗糖为碳源、以牛肉膏为氮源的情况下生长情况最好。
设计的7因素3试验结果见表 3。根据R值大小可得各因素作用的主次顺序为磷酸二氢钾>碳酸钙>二水硫酸钙>氯化钠>牛肉膏>七水硫酸镁>蔗糖。
由上述无机盐培养基正交试验结果中的各列K值可知:碳源蔗糖的最适浓度为A2,氮源牛肉膏的最适浓度为B3,磷酸二氢钾的最适浓度为C3,七水硫酸镁的最适浓度为D2,氯化钠的最适浓度为E3,二水硫酸钙的最适浓度为F3,碳酸钙的最适浓度为G3。
由测定结果可知,WN-F菌株最佳培养基的配方为(L-1):蔗糖20.0 g,牛肉膏2.0 g,KH2PO4 0.4 g,MgSO4·7H2O 0.4 g,NaCl 0.4 g,CaSO4·2H2O 0.4 g和CaCO3 2.0 g。
2.4 WN-F菌株固氮与产糖关系测定阿氏芽孢杆菌WN-F在24 h时,不同初始浓度氮源的产糖量成抛物线形(图 4)。在无氮条件下,菌株生长繁殖需要固氮,消耗能量大,积累少量多糖;WN-F在适宜碳氮比(葡萄糖20 g/牛肉膏1 g)条件下,有利于胞外多糖合成;当牛肉膏氮源含量2%时,菌体生长繁殖速度快,产糖量急剧下降。
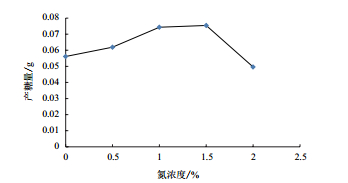
|
| 图 4 WN-F不同初始氮浓度产糖 |
目前发现的几种产多糖微生物及其多糖如出芽短梗霉(Aureobasidium pullulans),主要产普鲁兰糖[5],黄单胞菌(Xanthomonas campestris)经过发酵产生黄原胶[6],土壤杆菌(Agrobacterium sp.)经过发酵产生的胞外多糖叫做热凝胶[7],链球菌属(Streptococcus spp.)能产透明质酸(即玻尿酸),伊乐假单胞菌(Pseudomonas elodea)能产生结冷胶[8-9],肠膜明串珠菌(Leuconostoc mesenteroides)经过发酵合成右旋糖酐[10],芽孢杆菌属(Bacillus sp.)经过发酵产生生物絮凝剂。常见的产多糖土壤微生物有土壤杆菌属、醋酸杆菌属、固氮菌属、芽孢杆菌属、假单胞菌属及根瘤菌属等。
许多研究表明,植物中多糖含量不仅与植株本身有关,与固氮菌接种量,氮施用等均有关系[11-13]。施肥对固氮微生物群落多样性和结构有显著的影响,高氮水平会降低生态系统对固氮菌的依赖性,抑制固氮效果。如Silva等[14]发现增加铵态氮和硝态氮会降低荷兰地区不同质地的农耕土壤中nifH基因的拷贝数。在澳大利亚放牧林地土壤中,固氮酶活性和nifH基因丰度与总氮量呈负相关[15]。在巴西种植高粱的土壤中,非共生固氮菌的丰度在低氮水平下比高氮水平下高30%[16]。对长江三角洲平原典型水稻土壤研究也发现,固氮微生物的丰度和群落结构与速效N含量呈负相关,氮肥会抑制固氮微生物的生长,显著降低水田α变形菌纲固氮微生物的相对丰度[17]。糖类积累的主要过程是碳代谢过程,而碳代谢与氮代谢相互依存和限制。两种生理过程之间的联系是α-酮戊二酸与NH4+在谷氨酰胺合成酶(GS)和谷氨酸合成酶的联合催化。因此,氮供应在调节糖类积累中起重要作用[18-19]。
本研究结果表明,固氮阿氏芽孢杆菌WN-F在适宜碳氮比条件下,有利于胞外多糖合成。合成胞外多糖有利于菌体固氮,说明该菌株有望在1%-1.5%氮源存在下固氮,使其在适量施用氮肥的土壤中保持固氮活性,将为减施氮肥土壤补充保持玉米等作物稳产高产需求的氮素。
4 结论在沈阳农业大学棕壤长期定位试验站采集的土样中,筛选出1株产糖较高的固氮菌WN-F。经形态学和分子生物学鉴定,命名为阿氏芽孢杆菌(Bacillus aryabhattai)WN-F。该菌株在12 h时达到最佳生长点,在24 h时产糖量趋于平稳,产糖量随着初始氮浓度的增加呈现抛物线形变化。
| [1] |
徐鹏霞, 韩丽丽, 贺纪正, 等. 非共生生物固氮微生物分子生态学研究进展[J]. 应用生态学报, 2017, 28(10): 3440-3450. |
| [2] |
谢达平, 雷女孝, 彭道林, 等. 微生物菌肥的作用机理研究[J]. 湖南文理学院学报:自然科学版, 2002, 14(1): 48-50. |
| [3] |
蒋先军, 黄昭贤, 等. 硅酸盐细菌代谢产物对植物生长的促进作用[J]. 西南大学学报:自然科学版, 2000, 22(2): 116-119. |
| [4] |
姚拓, 蒲小鹏, 张德罡, 等. 高寒地区燕麦根际联合固氮菌研究——Ⅲ固氮菌对燕麦生长的影响及其固氮量测定[J]. 草业学报, 2004, 13(5): 101-105. |
| [5] |
Cheng KC, Demirci A, Catchmark JM. Pullulan: biosynthesis, production, and applications[J]. Applied Microbiology & Biotechnology, 2011, 92(1): 29-44. |
| [6] |
Saehun M, Young-Lim K, Choon-Gil K. Development of reduced-fat mayonnaise using 4α GTase-modified rice starch and xanthan gum[J]. International Journal of Biological Macromolecules, 2009, 44(5): 400-407. DOI:10.1016/j.ijbiomac.2009.02.008 |
| [7] |
Moon CJ, Lee JH. Use of curdlan and activated carbon composed adsorbents for heavy metal removal[J]. Process Biochemistry, 2005, 40(3-4): 1279-1283. DOI:10.1016/j.procbio.2004.05.009 |
| [8] |
聂凌鸿, 彭华松. 微生物胞外多糖-结冷胶的生产与应用前景[J]. 生命的化学, 2002, 22(2): 178-181. |
| [9] |
Fialho AM, Martins LO. Structures and properties of gellan polymers produced byATCC 31461 from lactose compared with those produced from glucose and from Cheese Whey[J]. Journal of Composite Materials, 2013, 48(25): 3083-3090. |
| [10] |
Hemme D, Foucaud-Scheunemann C. Leuconostoc, characteristics, use in dairy technology and prospects in functional foods[J]. International Dairy Journal, 2004, 14(6): 467-494. DOI:10.1016/j.idairyj.2003.10.005 |
| [11] |
Xiao YH, Ting-Ting L, Tang XQ, et al. Effects of topdressing nitrogen on apparent quality, dry matter accumulation and contents of active components in the root of Isatis indigotica Fort[J]. Journal of Plant Nutrition & Fertilizer, 2014, 20(2): 437-444. |
| [12] |
Liu XH, Ou HP, Yang RZ, et al. Change of polysaccharide content and its relation with nitrogen level in sugarcane leaves under nitrogen-fixing bacteria inoculation and nitrogen supply[J]. Sugar Tech, 2016, 18(1): 87-92. DOI:10.1007/s12355-015-0368-z |
| [13] |
Tang J, Wan N, Zheng-Yu HU. Effect of Nitrogen on the Growth and polysaccharide content of Nostoc flagelliforme[J]. Food Science, 2010, 36(19): 92-95. |
| [14] |
Silva MCPE, Schloter-Hai B, Schloter M, et al. Temporal dynamics of abundance and composition of nitrogen-fixing communities across agricultural soils[J]. PLoS One, 2013, 8(9): e74500. DOI:10.1371/journal.pone.0074500 |
| [15] |
Reed SC, Cleveland CC, Townsend AR. Functional ecology of free-living nitrogen fixation: A contemporary perspective[J]. Annual Review of Ecology Evolution and Systematics, 2011, 42: 489-512. DOI:10.1146/annurev-ecolsys-102710-145034 |
| [16] |
Coelho MRR, de Vos M, Carneiro NP, et al. Diversity of nif H gene pools in the rhizosphere of two cultivars of sorghum(Sorghum bicolor)treated with contrasting levels of nitrogen fertilizer[J]. FEMS Microbiology Letters, 2008, 279: 15-22. DOI:10.1111/fml.2008.279.issue-1 |
| [17] |
侯海军, 秦红玲, 陈春兰, 等. 土壤氮循环微生物过程分子生态学进展[J]. 农业现代化研究, 2014, 35(5): 588-594. |
| [18] |
Crété P, Caboche M, Meyer C. Nitrite reductase expression is regulated at the post-transcriptional level by the nitrogen source in Nicotiana plumbaginifolia and Arabidopsis thaliana[J]. Plant Journal, 2010, 11(4): 625-634. |
| [19] |
Sun HY, Guo W, Center T. Effects of different nitrogen level on carbon-nitrogen metabolic balance in kidney bean(Phaseolus vulgari L.)[J]. Agricultural Research in the Arid Areas, 2013, 81(5): AB465-AB466. |