漆酶(EC 1.10.3.2,p-diphenol:dioxygen oxido-reductase)是一种多铜氧化还原酶,铜中心催化底物的单电子氧化过程,将电子转移到分子氧并生成水,氧化底物产生的自由基可以进行非酶反应,包括单体交联、聚合物的降解和芳香化合物的环裂,具有催化底物的广谱性[1]。近些年来的研究表明漆酶在造纸工业、食品工业、纺织工业、有机合成和污染物降解等领域具有广泛用途[2]。
一般真菌漆酶在酸性条件下(pH 4-6)和30-55℃下保持较高的活性[3],而造纸和纺织等工业领域往往伴随着高温、强碱等反应条件,使真菌漆酶的应用受到限制且使用成本较高。随着分子生物学的发展,越来越多的证据表明漆酶广泛分布在细菌中,研究较深入的是枯草芽孢杆菌的芽孢外壁蛋白CotA,该漆酶具有较高的热稳定性,在80℃的半衰期高达2 h[4]。由于芽孢特殊构造,CotA蛋白与芽孢内壁其他蛋白紧密相连[5],不易分离纯化,在一定程度上限制了其应用。重组表达是克服这一障碍的有效方法[6-7]。毕赤酵母(Pichia pastoris)表达系统在进行外源基因表达时,具有生长周期短、可进行胞外分泌表达、目的蛋白易于纯化和易于高密度发酵培养等优点[8]。
实验室前期从森林土壤中筛选分离到一株具有较高漆酶活性的短小芽孢杆菌LC01,本研究通过克隆出短小芽孢杆菌的漆酶基因,并在毕赤酵母中进行高活性分泌表达,同时研究重组漆酶的酶学性质以及对染料的脱色能力,旨在为推动细菌漆酶在染料废水处理中的应用奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒短小芽孢杆菌(Bacillus pumilus)LC01保存于东北林业大学生命科学学院微生物学实验室。大肠杆菌(Escherichia coli)TOP10为北京天根公司产品;表达载体pPICZαA和毕赤酵母(Pichia pastoris)SMD1168H购自Invitrogen公司。
1.1.2 酶和主要试剂2,2'-连氮-二(3-乙基苯并噻唑-6-磺酸)(ABTS)、丁香醛连氮(Syringaldazine,SGZ)、2,6-二甲氧基苯酚(2,6-dimethoxyphenol,DMP)、乙酰丁香酮、RB亮蓝、活性黑5和靛红为Sigma公司产品;细菌基因组提取试剂盒、胶回收试剂盒和质粒提取试剂盒为Omega公司产品;Q5高保真聚合酶,EcoR Ⅰ、SacⅡ和SacⅠ限制性内切酶,T4 DNA连接酶为NEB公司产品,dNTP,低分子量蛋白marker为TaKaRa公司产品;Zeocin为Invitrogen公司产品;其他试剂均为国产分析纯试剂。
1.1.3 培养基LLB、YPD、BMGY、BMM等培养基配方和毕赤酵母SMD1168H培养条件参照Invitrogen公司提供的毕赤酵母操作手册。
1.2 方法 1.2.1 漆酶基因的PCR扩增采用细菌基因组提取试剂盒提取短小芽孢杆菌LC01的基因组DNA,通过PCR扩增漆酶基因,PCR扩增引物为:上游引物5'-CGGGAATTCAACCTAGAAAAATTTGTTGACGAGC-3';下游引物5'-TCCCCGCGGTTACTGGATGATATCCATCGGC-3'。PCR扩增条件为:98℃,30 s;98℃,8 s;54℃,30 s;72℃,50 s,共30个循环;72℃,2 min。
1.2.2 重组表达载体的构建PCR产物和表达载体pPICZαA经EcoR Ⅰ和SacⅡ双酶切后胶回收纯化,然后用T4 DNA连接酶4℃连接过夜,转化至大肠杆菌TOP10感受态细胞中,在含Zeocin(25 mg/L)的LLB平板上筛选阳性克隆。对阳性克隆提取质粒进一步进行酶切验证,并送到上海Invitrogen公司进行测序。
1.2.3 毕赤酵母的转化与筛选构建好的重组表达载体pPICZαA-lac经Sac Ⅰ线性化后,电转化毕赤酵母感受态细胞,电转化条件为1 500 V,5 ms。将YPD/Zeocin抗性平板上的重组菌株点接至添加0.2 mmol/L CuSO4和0.1 mmol/L ABTS的BMM筛选培养基上,30℃倒置培养。每隔24 h定时向培养皿盖中补加甲醇(100 μL),直至菌落周围出现绿色反应圈,根据反应圈颜色的深浅筛选高效重组菌株。将高活性的重组菌株转接到BMGY液体培养基中,30℃,200 r/min培养至OD600为2.0-6.0,3 000×g离心5 min后将菌体沉淀用BMM液体培养基稀释菌至OD600为1.0,30℃,200 r/min培养,每隔24 h定时向培养基中加入终浓度0.5%(V/V)甲醇诱导重组蛋白的表达并绘制培养曲线。每个实验重复3个平行。
1.2.4 重组漆酶纯化依据产酶曲线,在重组蛋白表达量最高时收集培养液,离心收集上清液移到透析袋中,利用PEG20000进一步浓缩。采用DEAE-Sepharose FF对浓缩的漆酶样品进行离子交换层析,缓冲液为20 mmol/LTris-HCl缓冲液(pH 7.5),使用浓度为0-1 mol/L的NaCl进行梯度洗脱,收集具有漆酶活性的组分并进行超滤浓缩。然后采用Sephadex G75进行凝胶层析,用20 mmol/L pH 7.5的磷酸盐缓冲液洗脱,收集有活性组分,采用SDS-PAGE检测纯化后的蛋白条带。
1.2.5 漆酶活性的测定分别采用ABTS、SGZ和DMP为底物检测漆酶活性[9]。采用ABTS为底物时,3 mL反应体系含一定体积的漆酶样品,0.1 mol/L柠檬酸-磷酸盐缓冲液和1 mmol/L的ABTS,30℃反应3 min后在420 nm处测定吸光值。采用SGZ为底物时,3 mL反应体系含一定体积的漆酶样品,0.1 mol/L柠檬酸-磷酸盐缓冲液,0.1 mmol/L的SGZ,30℃反应3 min后在525 nm处测定吸光值。采用DMP为底物时,3 mL反应体系含一定体积的漆酶样品,0.1 mmol/L的Tris-HCl缓冲液和1 mmol/L的DMP,30℃反应3 min后在468 nm处测定吸光值。以1 min内催化氧化1 μmol底物所需的酶量为1个酶活单位(U)。所有测定均重复3次取平均值。
1.2.6 漆酶酶学性质 1.2.6.1 pH对漆酶活性及稳定性的影响采用不同pH的0.1 mol/L柠檬酸-磷酸盐缓冲液(pH 2.2-7.0),0.1 mol/L Tris-HCl缓冲液(pH 7.0-9.0),0.1 mol/L甘氨酸-氢氧化钠缓冲液(pH范围为9.0-10.0)。以ABTS、SGZ和DMP为底物测定漆酶活性,确定漆酶的最适反应pH。pH稳定性的研究通过将漆酶在30℃时将漆酶与不同的缓冲液混合放置1-10 d后测定漆酶残余活性。所有实验重复3次。
1.2.6.2 温度及稳定性的影响在最适pH下,以SGZ为底物分别在20-100℃条件下检测酶活,确定重组漆酶的最适反应温度。将漆酶样品在50、60、70和80℃保温0-10 h后测定漆酶活性,研究重组漆酶在不同温度下的热稳定性。所有实验重复3次。
1.2.6.3 动力学常数测定以不同浓度的ABTS、SGZ和DMP为底物,分别在最适pH、30℃下测定重组漆酶的酶活,利用Lineweaver-Burk法,求出kcat和Km值。所有测定均重复3次取平均值。
1.2.6.4 抑制剂及有机溶剂对重组漆酶活性的影响将漆酶常见的抑制剂(半胱氨酸、SDS、EDTA和NaN3)和有机溶剂(甲醇、乙醇、丙酮和乙腈)与重组漆酶混合均匀后在30℃条件下以SGZ为底物测定漆酶剩余活性。同时设置阴性对照。选取常见的金属离子并使其终浓度为10 mmol/L,在30℃时加入底物SGZ反应3 min测定酶活。
1.2.6.5 金属离子对重组漆酶活性的影响配制终浓度为10 mmol/L的金属离子Ba2+、Mn2+、Zn2+、Mg2+、Ca2+、Cu2+、Fe3+、Al3+、K+、Na+、Co2+,并设置阴性对照,30℃下以SGZ为底物测定剩余酶活。所有测定均重复3次。
1.2.6.6 重组漆酶的染料脱色选择RB亮蓝(λmax=591 nm)、活性黑5(λmax=597 nm)和靛红(λmax=610 nm)染料进行在介体乙酰丁香酮参与下进行染料脱色研究。6 mL脱色体系包括缓冲液、染料(终浓度分别为100、40、25 mg/L),0.1 mmol/L乙酰丁香酮,重组漆酶(终浓度为20 U/L),在相同条件下以不加酶液为空白对照。脱色过程在pH 6.8和9.0,40℃进行。
脱色率用染料在最大吸收峰下其吸光值减少的百分比表示。计算公式为:脱色率(%)=(A0-A)/A0×100%,A0为初始染料吸光值,A为反应一段时间后测的吸光值。所有测定均重复3次取平均值。
2 结果 2.1 漆酶基因的克隆以短小芽孢杆菌LC01的基因组为模板扩增漆酶基因,PCR产物经1%琼脂糖电泳检测大小约为1.5 kb,与预期大小相符。测序结果分析表明该漆酶基因全长为1 533 bp(GenBank登录号KC237769),编码510个氨基酸。将菌株LC01的漆酶基因序列在NCBI上进行BLAST分析,选择相似度较高的细菌漆酶采用MEGA 5.0软件构建系统发育树,结果(图 1)表明LC01与其他芽孢杆菌的CotA漆酶基因序列具有较高的同源性,与Bacillus pumilus W3 cotA(KF040050)和B. altitudinis SYBC hb4 cotA(KU363621)的同源性达到了97%,与B. pumilus MK001的cotA(JQ734990)的同源性达到了88%。
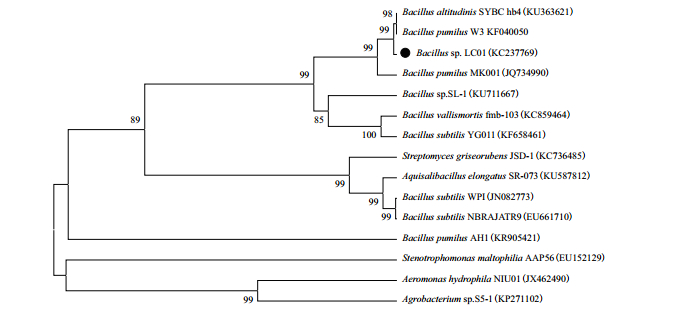
|
| 图 1 基于漆酶基因序列构建的系统发育树 |
通过每天定时加入定量的甲醇诱导AOX1调控重组基因的表达,产酶曲线(图 2)表明,前4 d缓慢升高,在第4天开始快速上升,在第7天达到峰值,为1 390±58 U/L。利用离子交换层析和凝胶层析对收集的粗酶液进行纯化,纯化后漆酶的SDS-PAGE电泳呈现单一条带,无其他杂蛋白(图 3),表明重组漆酶纯化效果较好。该重组漆酶大小约为65 kD。
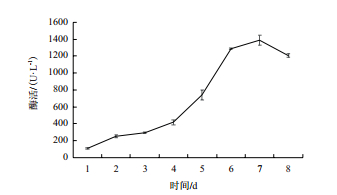
|
| 图 2 毕赤酵母表达重组漆酶的产酶曲线 |
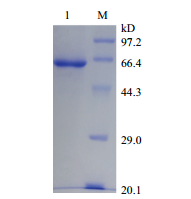
|
| 图 3 纯化漆酶的SDS-PAGE检测 |
以ABTS、SGZ和DMP为底物时的最适pH分别为3.0、6.8和7.4(图 4-A)。重组漆酶的pH稳定性结果如图 4-B,在酸性条件下的稳定性较差,5 d后丧失了80%的酶活。而在中性和碱性条件下稳定性较好,尤其是pH 9.0条件下保存10 d后,较初始酶活基本没有损失。这表明该细菌重组漆酶的pH反应条件宽泛,在不同的pH范围内仍可以保持稳定的催化活性。

|
| 图 4 pH对重组漆酶活性(A)及稳定性(B)的影响 |
重组漆酶的最适温度为70℃,在50-80℃保持较高的催化活性(图 5-A)。温度稳定性如图 5-B所示,在50℃下温浴10 h后基本保持其较高的催化活性,60℃放置10 h后保持初始酶活的48%,随着温浴时间的延长和温度的提高,重组漆酶的催化活性显著下降,在70℃、10 h后保留初始酶活的36%,80℃放置6 h后剩余19%的酶活。
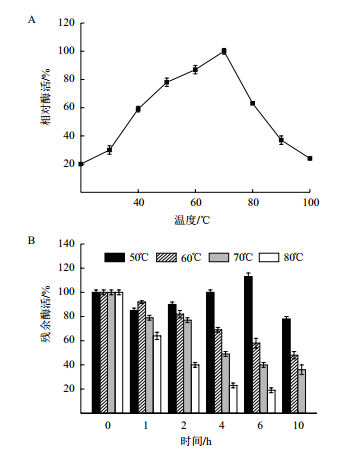
|
| 图 5 温度对漆酶活性(A)及温度稳定性(B)的影响 |
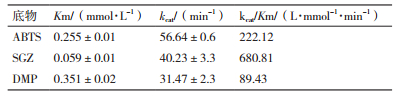
以ABTS、SGZ、DMP为底物进行动力学参数研究,实验结果如表 1,SGZ的Km值最低,DMP最高,表明重组漆酶对SGZ的亲和力高于ABTS和DMP。DMP的kcat/Km值最低,表明其催化效率最低,SGZ的催化效率最高,且是ABTS的3倍。
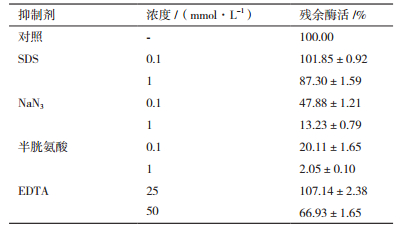
低浓度的SDS和EDTA对酶活有一定的促进作用(表 2),随着抑制剂浓度的升高,漆酶催化活性受到了不同程度的抑制作用。在1 mmol/L的SDS和50 mmol/L的EDTA中漆酶可分别保留87%和67%的酶活。半胱氨酸对漆酶活性的抑制作用最为明显,在0.1 mmol/L时即可抑制80%左右的漆酶活性。NaN3对漆酶活性也有较强的抑制作用,1 mmol/L的NaN3可抑制86%以上的漆酶活性。
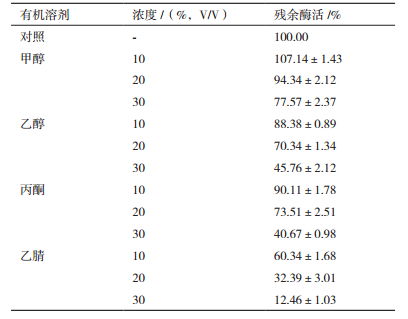
常见的有机溶剂对重组漆酶催化活性的影响如表 3,有机溶剂浓度在10%时漆酶可保持较高的酶活,随着有机溶剂浓度增加,漆酶活性逐渐下降。重组漆酶在甲醇中的稳定性要高于其他有机溶剂,在30%的甲醇中仍可保留77%左右的活性。乙腈对漆酶的抑制作用较大,在30%的浓度下可抑制87%左右的漆酶活性。
以SGZ为底物,常见金属离子对酶活性的影响如图 6,漆酶是一种铜依赖性蛋白,铜离子的加入对活性影响不大。Co2+、Na+、Mg2+和Ca2+对重组漆酶酶活有轻微的促进作用,而Al3+、Fe3+和Mn2+则完全抑制了重组漆酶的催化活性。
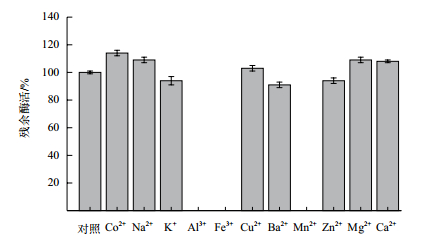
|
| 图 6 金属离子对重组漆酶的影响 |
选择常见的染料RB亮蓝、活性黑5、靛红在乙酰丁香酮作为氧化还原介体进行了重组漆酶染料降解能力的研究。结果如图 7,重组漆酶能够在pH 6.8、pH 9.0对3种染料有效的脱色降解。在pH 6.8,1 h内RB亮蓝和活性黑5的脱色过程比较缓慢(图 7-A),RB亮蓝属于蒽醌染料,结构复杂,对重组漆酶显示出一定的抗性。2 h后活性黑5脱色率增加了40%,达到了91%。靛红脱色效率最高,在1 h内就已经达到了97%。碱性条件下脱色率明显增加,重组漆酶保持较高的催化效率(图 7-B),在6 h内RB亮蓝、活性黑5、靛红脱色率分别达到了90%、97%和98%。高效的染料降解表明该重组漆酶能够应用于生物处理染料废水过程。
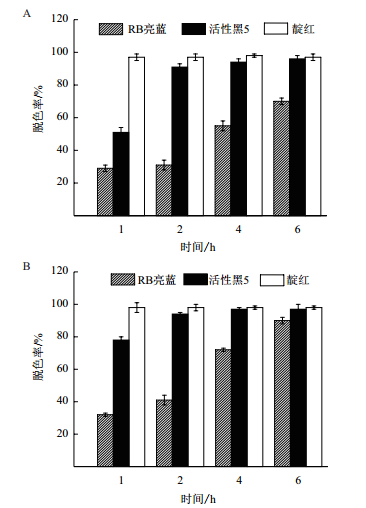
|
| 图 7 重组漆酶对不同染料的脱色(A)pH 6.8和(B)pH 9.0 |
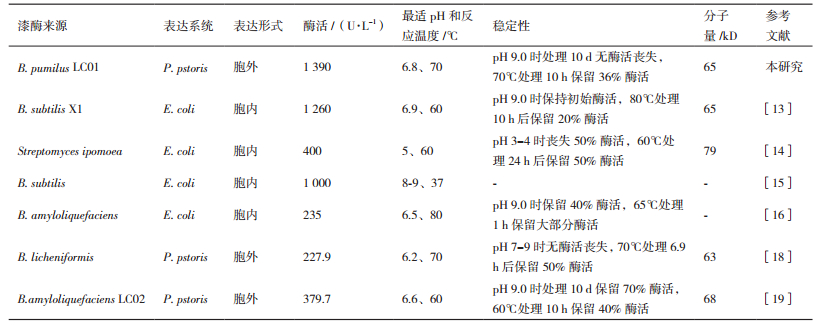
细菌漆酶突出的稳定性吸引了越来越多的关注,目前研究最多的细菌漆酶来自于枯草芽孢杆菌CotA漆酶,关于短小芽孢杆菌的CotA漆酶较少[10-11]。具有漆酶催化活性的CotA蛋白是组成芽孢外壁重要成分之一,尤其是在极端的温度和pH条件下,依然能够保持稳定的酶学特性且在异源表达方面较真菌漆酶更具优势。如利用大肠杆菌能高密度发酵培养及遗传操作简单的特点,可实现细菌漆酶的高效重组表达,从而能有效提高酶活和产量[12]。但大肠杆菌表达的重组蛋白一般位于胞内[13-16],需要破碎细胞进行目的蛋白的分离纯化,而且细菌漆酶在大肠杆菌中表达时容易形成大量没有活性的包涵体,降低了重组漆酶的表达量,但毕赤酵母具有生长速度快,可使用高效的AOX启动子以及可实现异源蛋白的分泌表达等优点,广泛用于各种具有工业用途的重组蛋白的生产[17]。本文通过克隆短小芽孢杆菌LC01的漆酶基因并在毕赤酵母中实现胞外表达,在培养7 d时培养液上清的漆酶活性达到1 390 U/L。从表 4可看出其重组漆酶的产量,高于其他一些芽孢杆菌如Bacillus subtilis X1在大肠杆菌的表达量,是同样以毕赤酵母为表达系统的B. amyloliquefaciens LC02重组漆酶表达量的3.7倍[19]。毕赤酵母可通过高密度发酵培养大量生产重组蛋白,在提高细菌漆酶产量的同时有利于简化纯化步骤,降低生产成本[20]。
大多数印染废水及造纸废水的pH都在碱性范围[21],真菌漆酶一般在酸性条件下保持活性,而在碱性范围内易失活,因此限制了在废水处理中的作用[22]。菌株LC01的重组漆酶以SGZ和ABTS为底物的最适pH分别为6.8和3.0,这与已报道的细菌漆酶如Lactobacillus plantarum、Aquisalibacillus elongatus的漆酶结果相近[23-24],实验结果表明在酸性范围内重组漆酶对ABTS催化活力较强。在稳定性方面,本实验的重组漆酶在中性和碱性条件下都具有较好的催化活性,在pH 9.0放置10 d后酶活没有下降,相比之下,一些细菌漆酶如耐热芽孢杆菌SL-1在大肠杆菌表达的重组漆酶在pH 8.5处理3 d后仅保留17%的初始酶活[25]。与一些pH稳定的细菌相比,如Klebsiella pneumoniae重组漆酶在pH 9.0放置1 d后剩余酶活低于70%[26];Pleurotus nebrodensis真菌漆酶Lac1在pH 8时酶活急剧下降[27]。因引,菌株LC01的重组漆酶可以在广泛的pH下催化底物并在碱性条件下保持稳定的酶活性。
温度是影响漆酶活性的另一重要因素。在温度稳定性方面,该重组漆酶在60-80℃内保持较好的催化活性,在70℃的酶活半衰期约为4 h,具有较好的热稳定性。这要高于一些热稳定性真菌漆酶,例如Cladosporium cladosporioides的漆酶在80℃下处理5 min就已经失去了52%的酶活[28],而其他一些真菌漆酶则在温和的条件下保持较高的催化活性[27]。相比其他细菌漆酶,如Ricklefs等[29]从Corynebacterium glutamicum中克隆到CgL1,实验显示在70℃保温1 h后丧失了50%酶活,最近报道的一些具有热稳定性的细菌Bacillus sp. SL-1和B. licheniformis ATCC 9945a的重组漆酶在70℃的酶活半衰期分别为1 h和50 min[25, 30],Pawlik等[31]通过对苜蓿根瘤菌漆酶的研究显示在70℃处理30 min后酶活损失超过了80%。到目前为止,越来越多的报道表明细菌漆酶具有更高的热稳定性,如B. tequilensis漆酶在70℃放置24 h仍可保留80%的活性[32]。
本实验选择常用的偶氮类、蒽醌类和靛族染料进行细菌重组漆酶脱色能力的研究。结果表明,该重组漆酶在乙酰丁香酮参与下对三类染料能够进行有效的脱色,使用小分子介体物质进行电子传递从而达到提高脱色效率[33]。菌株LC01重组漆酶对靛红在1 h内的脱色率达到97%,远高于一些真菌和细菌漆酶[34-36]。本文对RB亮蓝染料4 h内的脱色率为72%,而其他细菌漆酶如Pantoea ananatis的漆酶在4 h的脱色率仅为35%[37-39],由于蒽醌类染料结构复杂难降解,对漆酶有一定的抗性。不过也有实验发现通过对漆酶进行固定化,RB亮蓝的脱色效率可以从74.6%提高到90.3%[40]。真菌产生的漆酶对不同染料具有较好的降解效果,可有效用于工业染料废水的处理,然而当废水pH呈碱性时其应用便会受到限制。
4 结论短小芽孢杆菌LC01的重组漆酶具有较高的胞外表达量,并且在高温和碱性条件下保持稳定的催化活性。在介体乙酰丁香酮的协助下,对几种不同结构的工业染料(RB亮蓝、活性黑5和靛红)在碱性条件下均有较好的降解作用。
| [1] |
Jones SM, Solomon EI. Electron transfer and reaction mechanism of laccases[J]. Cellular and Molecular Life Sciences, 2015, 72(5): 869-883. DOI:10.1007/s00018-014-1826-6 |
| [2] |
Pezzella C, Guarino L, Piscitelli A. How to enjoy laccases[J]. Cellular and Molecular Life Sciences, 2015, 72(5): 923-940. DOI:10.1007/s00018-014-1823-9 |
| [3] |
Torressalas P, Mate DM, Ghazi I, et al. Widening the pH activity profile of a fungal laccase by directed evolution[J]. ChemBioChem, 2013, 14(8): 934-937. DOI:10.1002/cbic.v14.8 |
| [4] |
Martins LO, Durão P, et al. Laccases of prokaryotic origin: enzymes at the interface of protein science and protein technology[J]. Cellular and Molecular Life Sciences, 2015, 72(5): 911-922. DOI:10.1007/s00018-014-1822-x |
| [5] |
Tan IS, Ramamurthi KS. Spore formation in Bacillus subtilis[J]. Environmental Microbiology Reports, 2014, 6(3): 212-215. DOI:10.1111/1758-2229.12130 |
| [6] |
Kalyani DC, Munk L, et al. Molecular and biochemical characteriza-tion of a new thermostable bacterial laccase from Meiothermus ruber DSM 1279[J]. RSC Advances, 2015, 6(5): 3910-3918. |
| [7] |
Gunne M, Al-Sultani D, Urlacher VB, et al. Urlacher VB, et al. Enhancement of copper content and specific activity of CotA laccase from Bacillus licheniformis by coexpression with CopZ copper chaperone in E. coli[J]. Journal of Biotechnology, 2013, 168(3): 252-255. DOI:10.1016/j.jbiotec.2013.06.011 |
| [8] |
Rosano GL, Ceccarelli EA. Recombinant protein expression in Escherichia coli: advances and challenges[J]. Frontiers in Microbiology, 2014, 5(172): 172-184. |
| [9] |
Lu L, Zhao M, Wang TN, et al. Characterization and dye decolorization ability of an alkaline resistant and organic solvents tolerant laccase from Bacillus licheniformis LS04[J]. Bioresour Technol, 2012, 115(13): 35-40. |
| [10] |
Reiss R, Ihssen J, Thöny-Meyer L. Bacillus pumilus laccase: a heat stable enzyme with a wide substrate spectrum[J]. BMC Biotechnology, 2011, 11(1): 9-20. DOI:10.1186/1472-6750-11-9 |
| [11] |
Guan ZB, Song CM, Zhang N, et al. Overexpression, characterization, and dye-decolorizing ability of a thermostable, pH-stable, and organic solvent-tolerant laccase from Bacillus pumilus W3[J]. J Mol Catal B Enzym, 2014, 101(1-2): 1-6. |
| [12] |
Mate DM, Alcalde M. Laccase engineering: from rational design to directed evolution[J]. Biotechnology Advances, 2015, 33(1): 25-40. DOI:10.1016/j.biotechadv.2014.12.007 |
| [13] |
Guan ZB, Zhang N, Song CM, et al. Molecular cloning, characterization, and dye-decolorizing ability of a temperature-and pH-stable laccase from Bacillus subtilis X1[J]. App Biochem Biotechnol, 2014, 172(3): 1147-1157. DOI:10.1007/s12010-013-0614-3 |
| [14] |
Molinaguijarro JM, Muéozdorado J, Pérez J, et al. Detoxification of azo dyes by a novel pH-versatile, salt-resistant laccase from Streptomyces ipomoea[J]. International Microbiology, 2009, 12(1): 13-21. |
| [15] |
Pereira L, Coelho AV, et al. Enzymatic biotransformation of the azo dye Sudan Orange G with bacterial CotA-laccase[J]. Journal of Biotechnology, 2009, 139(1): 68-77. DOI:10.1016/j.jbiotec.2008.09.001 |
| [16] |
Lončar N, Božić N, Lopez-Santin J, et al. Bacillus amyloliquefaciens laccase-from soil bacteria to recombinant enzyme for wastewater decolorization[J]. Bioresour Technol, 2013, 147: 177-183. DOI:10.1016/j.biortech.2013.08.056 |
| [17] |
Krainer FW, Dietzsch C, et al. Recombinant protein expression in Pichia pastoris strains with an engineered methanol utilization pathway[J]. Microbial Cell Factories, 2012, 11(1): 22-36. DOI:10.1186/1475-2859-11-22 |
| [18] |
Lu L, Wang TN, et al. Cloning and expression of thermo-alkali-stable laccase of Bacillus licheniformis in Pichia pastoris and its characterization[J]. Bioresour Technol, 2013, 134(5): 81-86. |
| [19] |
Chen B, Xu WQ, Pan XR, et al. A novel non-blue laccase from Bacillus amyloliquefaciens: secretory expression and characterization[J]. International Journal of Biological Macromolecules, 2015, 76: 39-44. DOI:10.1016/j.ijbiomac.2015.02.019 |
| [20] |
Zhang ZH, Yang SS, Zhang AL. Using pGAP promoter to express of laccase gene from Bacillus subtilis in P. pastoris[J]. Biotechnology, 2011, 21(6): 24-27. |
| [21] |
Manu B, Chaudhari S. Anaerobic decolorisation of simulated textile wastewater containing azo dyes[J]. Bioresour Technol, 2002, 82(3): 225-231. DOI:10.1016/S0960-8524(01)00190-0 |
| [22] |
Jimenez-Juarez N, Roman-Miranda R, Baeza A, et al. Alkali and halide-resistant catalysis by the multipotent oxidase from Marinomonas mediterranea[J]. Journal of Biotechnology, 2005, 117(1): 73-82. DOI:10.1016/j.jbiotec.2005.01.002 |
| [23] |
Callejón S, Sendra R, Ferrer S, et al. Cloning and characterization of a new laccase from Lactobacillus plantarum J16 CECT 8944 catalyzing biogenic amines degradation[J]. Appl Microbiol Biotechnol, 2016, 100(7): 3113-3124. DOI:10.1007/s00253-015-7158-0 |
| [24] |
Rezaei S, Shahverdi AR, Faramarzi MA. Isolation, one-step affinity purification, and characterization of a polyextremotolerant laccase from the halophilic bacterium Aquisalibacillus elongatus and its application in the delignification of sugar beet pulp[J]. Bioresour Technol, 2017, 230: 67-75. DOI:10.1016/j.biortech.2017.01.036 |
| [25] |
Safary A, Moniri R, Hamzeh-Mivehroud M, et al. A strategy for soluble overexpression and biochemical characterization of halo-thermotolerant Bacillus laccase in modified E. coli[J]. Journal of Biotechnology, 2016, 227: 56-63. DOI:10.1016/j.jbiotec.2016.04.006 |
| [26] |
Liu Y, Huang L, Guo W, et al. Cloning, expression, and characterization of a thermostable and pH-stable laccase from Klebsiella pneumoniae and its application to dye decolorization[J]. Process Biochemistry, 2016, 53: 125-134. |
| [27] |
Yuan X, Tian G, Zhao Y, et al. Biochemical characteristics of three laccase isoforms from the basidiomycete Pleurotus nebrodensis[J]. Molecules, 2016, 21(2): 203-218. DOI:10.3390/molecules21020203 |
| [28] |
Halaburgi VM, Sharma S, Sinha M, et al. Purification and characterization of a thermostable laccase from the ascomycetes Cladosporium cladosporioides and its applications[J]. Process Biochemistry, 2011, 46(5): 1146-1152. DOI:10.1016/j.procbio.2011.02.002 |
| [29] |
Ricklefs E, Koschorreck K, Winkler N, et al. Expanding the laccase-toolbox: a laccase from Corynebacterium glutamicum with phenol coupling and cuprous oxidase activity[J]. Journal of Biotechnology, 2014, 191: 46-53. DOI:10.1016/j.jbiotec.2014.05.031 |
| [30] |
Lončar N, Božić N, Vujčić Z. Expression and characterization of a thermostable organic solvent-tolerant laccase from Bacillus licheniformis ATCC 9945a[J]. J Mol Catal B Enzym, 2016, 134: 390-395. DOI:10.1016/j.molcatb.2016.06.005 |
| [31] |
Pawlik A, Wójcik M, Rulka K, et al. Purification and characterization of laccase from Sinorhizobium meliloti and analysis of the lacc gene[J]. International Journal of Biological Macromolecules, 2016, 92: 138-147. DOI:10.1016/j.ijbiomac.2016.07.012 |
| [32] |
Sondhi S, Sharma P, Saini S, et al. Purification and characterization of an extracellular, thermo-alkali-stable, metal tolerant laccase from Bacillus tequilensis SN4[J]. PLoS One, 2014, 9(5): e96951. DOI:10.1371/journal.pone.0096951 |
| [33] |
Yavuz M, Kaya G, Aytekin Ç. Using Ceriporiopsis subvermispora CZ-3 laccase for indigo carmine decolourization and denim bleaching[J]. International Biodeterioration and Biodegradation, 2014, 88(1): 199-205. |
| [34] |
Pan K, Zhao N, et al. Induction of a laccase Lcc9 from Coprinopsis cinerea by fungal coculture and its application on indigo dye decolorization[J]. Bioresour Technol, 2014, 162(6): 45-52. |
| [35] |
Cho EA, Seo J, Lee DW, et al. Decolorization of indigo carmine by laccase displayed on Bacillus subtilis spores[J]. Enzyme Microb Technol, 2011, 49(1): 100-104. DOI:10.1016/j.enzmictec.2011.03.005 |
| [36] |
Koschorreck K, Wahrendorff F, Biemann S, et al. Cell thermolysis-A simple and fast approach for isolation of bacterial laccases with potential to decolorize industrial dyes[J]. Process Biochemistry, 2017, 56: 171-176. DOI:10.1016/j.procbio.2017.02.015 |
| [37] |
Shi X, Liu Q, Ma J, et al. An acid-stable bacterial laccase identified from the endophyte Pantoea ananatis Sd-1 genome exhibiting lignin degradation and dye decolorization abilities[J]. Biotechnology Letters, 2015, 37(11): 2279-2288. DOI:10.1007/s10529-015-1914-1 |
| [38] |
Liu H, Cheng Y, Du B, et al. Overexpression of a novel thermostable and chloride-tolerant laccase from Thermus thermophilus SG0. 5JP17-16 in Pichia pastoris and its application in synthetic dye decolorization[J]. PLoS One, 2015, 10(3): e0119833. DOI:10.1371/journal.pone.0119833 |
| [39] |
Afreen S, Bano F, Ahmad N, et al. Screening and optimization of laccase from cyanobacteria with its potential in decolorization of anthraquinonic dye Remazol Brilliant Blue R[J]. Biocatalysis and Agricultural Biotechnology, 2017, 10(5): 403-410. |
| [40] |
Dassi D, Rodríguez-Couto S, Nasri M, et al. Biodegradation of textile dyes by immobilized laccase from Coriolopsis gallica into Ca-alginate beads[J]. International Biodeterioration and Biodegradation, 2014, 90(1): 71-78. |