2. 兰州交通大学环境与市政工程学院,兰州 730070
2. College of Environmental and Municipal Engineering, Lanzhou Jiaotong University, Lanzhou 730070
植物内生菌是指生活史中某一阶段或整个阶段定植在植物各组织器官或细胞间隙内的一类对自身植物不引起明显病害症状的一类微生物群,其包括内生细菌、内生真菌和内生放线菌等[1-2]。它们具有丰富的生物多样性、宿主植物种类多样性及功能多样性[3]。这些菌株对植物本身具有促生长、生物防治、增强抗逆性及生物修复等多种有益的生物学功能[4-7]。研究表明,内生菌与宿主之间建立了十分密切的生态关系,参与植物次级代谢产物的合成与转化,并且由于协同进化中基因的横向转移与交换,内生菌还会获得与宿主相同的部分代谢途径,合成与宿主相同或相似的次生代谢产物[8-9]。由于化学农药使用存在残留、引发植物病原菌抗性和再猖獗等隐患,近年来从药用植物中分离筛选具有生防作用的内生菌以研发生物农药成为一个新兴的研究热点[10-11]。因此,从植物中发掘有益微生物资源具有广阔前景。
菘蓝(Isatis indigotica),以根入药又称板蓝根,十字花科(Cruciferae),菘蓝属,两年生草本植物,是应用广泛的大宗药材,主产于河北、浙江、安徽、河南及河西走廊等地。菘蓝性寒,味苦,主归心,多被用于治疗病毒性感冒、腮腺炎、湿病发热、风热感冒、咽喉肿痛、流行性乙肝型脑炎及肝炎等[12-13]。
近年来,有关于菘蓝的栽培技术、化学成分、药理活性、生物学特性及中药材质量评价的研究较多,但目前有关菘蓝内生菌的研究未见报道。本研究以从菘蓝的根、茎、叶、叶柄和花中分离出的内生细菌为材料,从微生物的培养、形态及生理生化指标、分子生物学鉴定和抑菌性入手,探讨菘蓝中内生细菌对植物病原菌的抗菌作用,旨为菘蓝的进一步开发利用和探寻有效拮抗微生物资源提供参考。
1 材料与方法 1.1 材料供试样品菘蓝:采自甘肃省张掖市山丹县位奇镇四坝村菘蓝大田种植田,样品采集后用自封袋密封后马上回实验室进行内生菌的分离。
供试菌株:禾谷镰刀菌(Fusarium oxysporum)、大斑凸脐蠕孢(Exserohilum turcicum)、链格孢霉(Alternaria alternata)均来自于河西学院微生物生理生化实验室惠赠。
1.2 方法 1.2.1 内生菌的分离纯化将采集的鲜菘蓝植株的根、茎、叶、叶柄和花放在自来水中冲洗干净,分别将根、茎和叶柄截成1-1.5 cm长,放入无菌广口瓶。置于超净工作台紫外灭菌。采用朱士茂报道的表面消毒方法[14]对菘蓝的根、茎、叶、叶柄和花进行表面灭菌。用无菌蒸馏水冲洗已表面灭菌后的材料,然后将此液体移入培养基中,培养观察是否灭菌彻底。在超净工作台上用无菌镊子挑取经预处理和表面灭菌的根茎放在无菌培养皿中,将其剥皮,用无菌小刀纵切表皮,中间部分切成0.5 cm×0.5 cm大小,插入牛肉膏蛋白胨培养基中。再用无菌镊子挑取处理过的叶、叶柄和花各1 g,放于无菌的盛有石英砂的研钵进行研磨,并用无菌水制成溶液涂布在牛肉膏蛋白胨培养基上于37℃恒温培养24 h(以上每种均接3个平皿),待菌落长出后,根据菌落大小、形态、颜色进行初步筛选,反复划线分离,纯化菌株冷藏保存。
1.2.2 拮抗菌株的筛选采用同步培养法将内生细菌用划线法接种于平板培养基中,然后迅速以无菌操作将灭菌的牛津杯(直径为0.5 cm)放置于有禾谷镰刀菌、大斑凸脐蠕孢和链格孢菌的培养基上打孔,将孔中的培养基用针头挑出,接种在之前内生细菌培养基中于28℃恒温培养,5 d后测定内生细菌的抑菌活性。以只接病原真菌为对照,3次重复,计算抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-0.5 cm)× 100%。
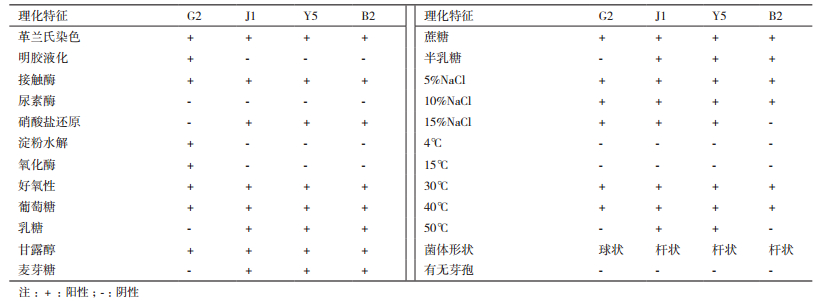
1.2.3 拮抗菌株的菌落特征及生理生化反应参照《微生物学实验》[15]对筛选的拮抗菌在培养基上采用划线法划出单菌落,记录菌落的形态、颜色、透明度等,显微镜下观察细菌的形态特征及革兰氏染色反应。参考《常见细菌系统鉴定手册》[16]对筛选的内生菌菌株进行生理生化反应的测定。
1.2.4 16S rRNA分子生物学鉴定将筛选的拮抗内生菌株采用高盐法提取菌体的染色体总DNA。以菌株的总DNA为模板,使用通用引物来扩增降解菌株的16S rRNA基因。5'端引物为5'-AGAGTTTGATCCTGGCTCAG-3'(Escherichia coli bases 8-27),3'端引物为5'-TACCTTGTTACGACTT-3'(E. coli bases 1507-1492)。50 μL的反应体系:10×Buffer 5.0 μL,MgCl2(25 mmol/L)4.0 μL,dNTP(2.5 mmol/L)4.0 μL,引物(1 mmol/L)各1.0 μL,DNA模板(50.0 ng/μL)1.0 μL,Taq酶(5.0 U/μL)0.5 μL,超纯水33.5 μL。PCR反应条件:94℃预变性2 min,进入热循环:94℃变性30 s,52℃退火30 s,72℃延伸1.5 min,共30个循环;最后72℃延伸10 min。取PCR产物于0.75%的琼脂糖凝胶上电泳。根据试剂盒操作说明进行。回收DNA片段并电泳检测其纯度。将回收后的DNA片段用pMD18-T通用测序引物测序[17],序列测定工作委托上海生工生物工程有限公司完成。根据基因的测序结果,将其序列EzTaxon-eserver(http://eztaxon-e.ezbiocloud.net/)数据库中基因序列进行同源性比较[18],采用CLUSTAL_X将菌株的基因序列与其同源关系相近的序列比对分析后,把两头的序列剪切整齐,用MEGA version 6.0软件转换格式后,采用邻近法构建系统进化树[19-20]。
2 结果 2.1 菘蓝内生菌的分离纯化通过微生物学传统分离纯化的方法从菘蓝的根、茎、叶、叶柄和花中分别分离到7、5、5、2及0株内生细菌,其中以根中的细菌数量最多。
2.2 菘蓝内拮抗菌株的筛选以大斑凸脐蠕孢等3种植物病原真菌作为靶标菌,对分离到的19株内生细菌进行拮抗作用测定(图 1),如表 1,有10株菌对植物病原菌禾谷镰刀菌有不同程度的抑制作用,占分离菌总数的52.6%,抑菌率从19.96%到94.63%,其中G2对禾谷镰刀菌的抑菌效果最强,抑菌率为94.63%;19株内生细菌对链格孢霉,大斑凸脐蠕孢均有很强的抑制作用,占分离菌总数的100%,其中菌株G2、J1、Y5及B2对链格孢霉,大斑凸脐蠕孢的抑菌率最大均接近100%,整体来看,从菘蓝中所分离的19株内生细菌具有较好的抑菌作用。

|
| 图 1 菘蓝内生菌的拮抗菌筛选结果 A:大斑凸脐蠕孢;B:禾谷镰刀菌;C:链格孢霉,第1行:空白对照,第2行:具有抑菌活性的菌株 |
对3种病原菌抑制作用较强的菌株G2、J1、Y5和B2进行平板培养,经48 h培养观察,平板菌落特征为:菌落均湿润、不透明、易挑起、生长速度快,菌落正反面颜色一致,菌落边缘不整齐或呈缺刻状。菌株J1、Y5的菌落扁平状,有光泽,黄色,菌株G2菌落圆形、稍凸起、橙黄色、有粘性,菌株B2菌落浅黄色,边缘光滑凸起。根据细胞形态特征和生理生化特性试验如表 2,结合东秀珠等编的《常见细菌系统和鉴定手册》[16],菌株G2被初步鉴定为库克菌属(Kocuria)菌株;菌株J1、Y5被初步鉴定为微杆菌属(Microbacterium)菌株;菌株B2被初步鉴定为短状杆菌属(Brachybacterium)菌株。
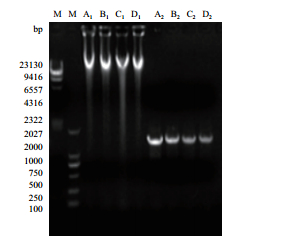
拮抗菌株G2、J1、Y5和B2的基因组DNA提取结果见图 2,基因组DNA在电泳图上的23 130 bp附近一条明显的条带,可以用于PCR扩增。
|
| 图 2 菌株G2、J1、Y5和B2的基因组DNA及16S rRNA基因的PCR扩增产物 M:Marker;A1、B1、C1和D1为菌株G2、J1、Y5和B2的总DNA;A2、B2、C2和D2为菌株的16S rRNA基因 |
将菌株G2、J1、Y5和B2的基因序列提交到GenBank,将该基因序列在EzTaxon-e server进行比较(http://eztaxon-e.ezbiocloud.net/)发现,菌株B2与模式菌株Brachybacterium ginsengisoli DCY80(T)有最大的序列相似性,为98.28%,G2与模式菌株Kocuria rosea DSM 20447(T)有最大的序列相似性,为99.16%;菌株J1和Y5与模式菌株Microbacterium maritypicum DSM 12512(T)有最大的序列相似性,分别为99.36%和99.14%,用MEGA version 5.0软件包中的Kimura-Parameter Distance模型计算进化距离,用Neighbor-Joining构建系统进化树,如图 3,1 000次随机抽样,计算自引导值(Bootstrap)以评估系统进化树的置信度。结合菌株细胞形态及生理生化指标鉴定菌株B2为人参短状杆菌(Brachybacterium ginsengisoli);菌株G2为玫瑰色库克菌(Kocuria rosea);菌株J1,Y5为微杆菌属的黄杆菌(Microbacterium maritypicum)。

|
| 图 3 筛选菌株的16S rRNA序列的系统发育树 |
本试验共从采自于张掖的菘蓝中分离得到19株内生细菌,经过筛选得到4株拮抗性较高的内生细菌,基于16S rRNA全序列的系统发育分析及生理生化显示,供试菌株分属于3个菌属4个种。其中2个属于微杆菌属,1个属于库克菌属,1个属于短状杆菌属。本研究从菘蓝根、茎、叶、叶柄和花中分离出不同的内生细菌,结果仅在菘蓝根、茎、叶、叶柄中分离出数量有限的内生细菌,这与其他一些关于内生菌分离的结果并不一致,结果可能是采集样本的数量有限,样本来源地较为单一所导致。在试验过程中,我们以最后一次表面冲洗的无菌水作为阴性对照,并未在其中发现可培养的任何细菌,说明整个操作过程消毒严密,这些内生菌并不是从空气、土壤及其他环境因素中带入,或者是试验条件所致的不可培养微生物的丢失。在以后的研究中,我们会探索其他的培养和检测方法,以期更为真实的揭示内生细菌的遗传多样性信息。
分离结果中发现的菌株既有病原菌,也有非病原菌:黄杆菌革兰氏阳性菌,是从海水和海洋泥浆中分离出来的,该菌耐极端环境,参与核黄素代谢,是一种机会性致病菌,会引起食源性疾病[21-23],但该菌株抑菌性未见报道,常见的微杆菌属的抑菌性报道有氧化微杆菌等[24-26]。人参短状杆菌是Hoang等[27]首次从韩国人参田土壤中分离到的新型菌株,其能产生铁载体并对青霉素G、红霉素、万古霉素、四环素、利福平和新霉素具有敏感性,海洋细菌是潜在有用的抗菌分子的丰富来源;Liu等[28]从广东湛江硇洲岛褐篮子鱼的胃肠道中分离筛选到19株拮抗菌,其中包括短状杆菌ZJHD5-23发现,其对大肠埃希氏菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus))、白色念珠菌(Candidia albicans)、单核细胞增生李斯特菌(Listeria monocytogenes)、枯草芽孢杆菌(Bacillus subtilis)、副溶血性弧菌(Vibrio Parahemolyticus)具有不同程度的抑制作用,表现出良好的抗菌谱。短状杆菌在内生拮抗菌中占据比例很少,一般大多数关于短状杆菌的报道有环境污染物的降解[29-30]、耐金属性[31]、产酶特性[32]等。玫瑰色库克菌属,一般从土壤和水中分离,对多黏菌、夹竹桃霉素、卡那霉素、万古霉素和链霉素等敏感,对溶菌酶有轻微的抗性[33],具有耐极端环境[34]和很好的腐殖质还原特性[35-36]。该菌株通常定殖于口咽、皮肤和黏膜的非致病性共生体,一般在免疫功能低下的患者中引起机会性感染,目前常见的病例有坏死性纵隔炎、心内膜炎和脑膜炎[37-39]。据报道[40]该菌株对植物病原真菌灰霉病(Botrytis cinerea)、西瓜枯萎病菌(Fusarium oxysporum f. sp. niveum)、玉米赤霉(Gibberella zeae)、核盘菌(Sclerotinia sclerotiorum)、柿树炭疽菌(Colletotrichum gloesporioides)和细菌金黄色葡萄球菌、枯草芽孢杆菌、蜡状芽孢杆菌(Bacillus cereus)、大肠杆菌、绿脓假单胞菌(Pseudomonas aeruginos)具有很强的抑制作用。
这些菌株中,只有玫瑰库色克菌是传统意义上的病原菌,而其余均为具有特殊生物学属性的细菌,体现在对环境的适应能力、参与地球化学物质循环、产生促生作用和良好的抗菌效果等方面。因此,我们猜测,在菘蓝中分离得到的这些内生细菌,与菘蓝本身具有的良好抗菌效果之间有一定的关联,可能是内生菌菌株在长期进化中获得了植物本身的部分特性,以适应特殊的生存环境,达到与植物共进化的目的。本试验选取的3个病原菌均为河西走廊制种玉米生育中的常见、多发性病害。目前对其防治主要采用化学方法,而本实验中所有供试菌株对其中的两种主要病原菌均具有良好的抗性作用,尤其是从菘蓝中筛选的内生菌菌株G2、J1、Y5和B2对这些植物病害有有效的拮抗作用。内生菌的生防效果及其应用有待后续进一步研究,这将为进一步利用内生菌制备良好的生物制菌肥或菌剂及新药物的开发奠定一定的理论基础。
4 结论本研究从药用植物菘蓝中共分离到19株内生细菌,并发现它们对河西走廊3种常见植物病原真菌有不同程度的抗菌作用;10株细菌对禾谷镰刀菌有不同程度的抑制作用,占分离菌总数的52.6%,其中菌株G2对禾谷镰刀菌的抑菌效果最强,抑菌率为94.63%;19株细菌均对链格孢霉、大斑凸脐蠕孢有不同程度的抑制作用,占分离菌总数的100%。其中菌株G2、J1、Y5和B2对这两种病原菌的抑菌率最大,均接近100%。经形态学观察、生理生化检测及16S rRNA序列分析,菌株G2为玫瑰色库克菌;菌株J1、Y5为黄杆菌;菌株B2为人参短状杆菌。
| [1] |
Suhandono S, Kusumawardhani MK, Aditiawati P. Isolation and molecular identification of endophytic bacteria from rambutan fruits(Nephelium lappaceum L.)cultivar binjai[J]. HAYATI Journal of Biosciences, 2016, 23(1): 39-44. DOI:10.1016/j.hjb.2016.01.005 |
| [2] |
Tadych M, White JF. Endophytic microbes[M]. Encyclopedia of Microbiology, 2009, 431-442.
|
| [3] |
郑艳, 戴婧婧, 管玉鑫, 等. 凤丹内生菌的分离鉴定及抑菌活性研究[J]. 中国中药杂志, 2016, 41(1): 45-50. |
| [4] |
Mahmoud WY, Irin A, Bernard RG. Bernard RG. Isolation and characterization of endophytic plant growth-promoting bacteria from date palm tree(Phoenix dactylifera L.)and their potential role in salinity tolerance[J]. Ant Leeuwenh, 2015, 107: 1519-1532. DOI:10.1007/s10482-015-0445-z |
| [5] |
Compant S, Clément C, Sessitsch A. Plant growth-promoting bacteria in the rhizo-and endosphere of plants: their role, colonization, mechanisms involved and prospects for utilization[J]. Soil Biol Biochem, 2010, 42: 669-678. DOI:10.1016/j.soilbio.2009.11.024 |
| [6] |
Kukla M, et al. Diversity of endophytic bacteria in Lolium perenne and their potential to degrade petroleum hydrocarbons and promote plant growth[J]. Chemosphere, 2014, 117: 40-46. DOI:10.1016/j.chemosphere.2014.05.055 |
| [7] |
Abdallah RAB, et al. Biocontrol of Fusarium wilt and growth prom-otion of tomato plants using endophytic bacteria isolated from Nico-tiana glauca organs[J]. Biological Control, 2016, 97: 80-88. DOI:10.1016/j.biocontrol.2016.03.005 |
| [8] |
国辉, 毛志泉, 刘训理. 植物与微生物互作的研究进展[J]. 中国农学通报, 2011, 27(9): 28-33. |
| [9] |
Nongkhlaw FMW, Joshi SR. Microscopic study on colonization and antimicrobial property of endophytic bacteria associated with ethnomedicinal plants of Meghalaya[J]. Journal of Microscopy and Ultrastructure, 2017, 5(3): 132-139. DOI:10.1016/j.jmau.2016.09.002 |
| [10] |
Wicaksono WA, Jones EE, et al. Biological control of Pseudomonas syringae pv. actinidiae(Psa), the causal agent of bacterial canker of kiwifruit, using endophytic bacteria recovered from a medicinal plant[J]. Biological Control, 2018, 116: 103-112. DOI:10.1016/j.biocontrol.2017.03.003 |
| [11] |
史应武, 娄恺, 李春. 植物内生菌在生物防治中的应用[J]. 微生物学杂志, 2009, 29(6): 61-64. |
| [12] |
肖云华, 吕婷婷, 唐晓清, 等. 追施氮肥量对菘蓝根的外形品质、干物质积累及活性成分含量的影响[J]. 植物营养与肥料学报, 2014, 20(2): 437-444. DOI:10.11674/zwyf.2014.0221 |
| [13] |
He L, Fan F, Hou X, et al. 4(3H)-Quinazolone regulates innate immune signaling upon respiratory syncytial virus infection by moderately inhibiting the RIG-1 pathway in RAW264. 7 cell[J]. International Immunopharmacology, 2017, 52: 245-252. DOI:10.1016/j.intimp.2017.09.010 |
| [14] |
朱士茂. 银杏内生菌的分离与鉴定[J]. 中山大学研究生学刊, 2011, 32(4): 64-74. |
| [15] |
沈萍, 范秀容, 李广武. 微生物学实验[M]. 第3版. 北京: 高等教育出版社, 2007.
|
| [16] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001, 267-295.
|
| [17] |
叶聿程, 李祖巍, 张向明, 等. 一株降解树脂细菌的鉴定及培养基的优化[J]. 中华纸业, 2013, 34(6): 64-69. |
| [18] |
Kim OS, et al. Introducing EzTaxon-e: a prokaryotic 16S rRNA gene sequence database withphylotypes that represent uncultured species[J]. Int J Syst Evol Microbiol, 2012, 62: 716-721. DOI:10.1099/ijs.0.038075-0 |
| [19] |
Smyth EM, Kulkarni P, et al. Smokeless tobacco products harbor diverse bacterial microbiota that differ across products and brands[J]. Appl Microbiol Biotechnol, 2017, 101(13): 539-5403. |
| [20] |
Tamura K, Stecher G, Peterson D, et al. MEGA6: molecular evolutionary genetics analysis version 6. 0[J]. Mol Biol Evol, 2013, 30(12): 2725-2729. DOI:10.1093/molbev/mst197 |
| [21] |
Williams PD, Eichstadt SL, Kokjohn TA, et al. Effects of ultraviolet radiation on the gram-positive marine bacterium Microbacterium maritypicum[J]. Current Microbiology, 2007, 55(1): 1-7. DOI:10.1007/s00284-006-0349-2 |
| [22] |
Zaini NAM, et al. Level of chemical and microbiological contamin-ations in chili bo(paste)[J]. J Food Prot, 2010, 3: 541-546. |
| [23] |
Xu H, Chakrabarty Y, et al. Identification of the first riboflavin catabolic gene cluster isolated from Microbacterium maritypicum G10[J]. J Biol Chem, 2016, 45: 23506-23515. |
| [24] |
Haque MA, Yun HD, Cho KM. Diversity of indigenous endophytic bacteria associated with the roots of Chinese cabbage(Brassica campestris L.)cultivars and their antagonism towards pathogens[J]. The Journal of Microbiology, 2016, 54(5): 353. DOI:10.1007/s12275-016-5641-7 |
| [25] |
Chulze SN, et al. Biological control as a strategy to reduce the impact of mycotoxins in peanuts, grapes and cereals in Argentina[J]. Food Addit Contam: Part A, 2015, 32(4): 471-479. DOI:10.1080/19440049.2014.984245 |
| [26] |
杜晓宁. 宁夏枸杞可培养内生菌的多样性及其生物活性研究[D]. 银川: 宁夏大学, 2016. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y3108938
|
| [27] |
Hoang VA, Kim YJ, Nguyen NL, et al. Brachybacterium ginsengisoli sp. nov., isolated from soil of a ginseng field[J]. Int J Syst Evol Microbiol, 2014, 64(9): 3063-3068. |
| [28] |
Liu Y, Shi W, An J, et al. Diversity of antimicrobial bacteria asso-ciated with Siganus fuscescens from Naozhou island in Zhanjiang, China[J]. Acta Microbiologica Sinica, 2014, 54(5): 582-588. |
| [29] |
Müller-Hellwig S, Groschup MH, Pichner R, et al. Biochemical evidence for the proteolytic degradation of infectious prion protein PrP Sc in hamster brain homogenates by foodborne bacteria[J]. Systematic and Applied Microbiology, 2006, 29(2): 165-171. DOI:10.1016/j.syapm.2005.07.010 |
| [30] |
Wang X, et al. Draft genome sequence of Brachybacterium phenoli-resistens strain W13A50, a halotolerant hydrocarbon-degrading bacterium[J]. Genome Announc, 2014, 2(5): e00899-14. DOI:10.1128/genomeA.00899-14 |
| [31] |
Santo CE, Morais PV, Grass G. Isolation and characterization of bacteria resistant to metallic copper surfaces[J]. Appl Environ Microbiol, 2010, 76(5): 1341-1348. DOI:10.1128/AEM.01952-09 |
| [32] |
薛永萍, 吴元欣, 赵玉凤, 等. 产酶新菌株短状杆菌的分离及其鉴定[J]. 化学与生物工程, 2006, 23(6): 27-29. |
| [33] |
Stackebrandt E, et al. Taxonomic dissection of the Genus Microco-ccus: Kocuria gen. nov., Nesterenkonia gen. nov., Kytococcus gen. nov., Dermacoccus gen. nov., and Micrococcus Cohn 1872 gen. emend[J]. Int J Syst Evol Microbiol, 1995, 45(4): 682-692. |
| [34] |
Mortazavi SM. Isolation a new strain of Kocuria rosea capable of tolerating extreme conditions[J]. Journal of Environmental Radioactivity, 2015, 147: 153. DOI:10.1016/j.jenvrad.2015.05.010 |
| [35] |
Bóka B, Adányi N, Szamos J, et al. Putrescine biosensor based on putrescine oxidase from Kocuria rosea[J]. Enzyme Microb Technol, 2012, 51(5): 258-262. DOI:10.1016/j.enzmictec.2012.07.006 |
| [36] |
陈楠. Fe(Ⅲ)腐殖质还原菌的分离鉴定及还原特性研究[D]. 海口: 海南大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10589-1014189871.htm
|
| [37] |
Sipahi OR, Mermer S, Aydemir S, et al. Kocuria rosea meningitis[J]. Surgical Infections, 2014, 15(5): 659-659. DOI:10.1089/sur.2013.220 |
| [38] |
Moreira JS, et al. Endocarditis by Kocuria rosea in an immunocom-petent child[J]. Braz J Infect Dis, 2015, 19(1): 82-84. DOI:10.1016/j.bjid.2014.09.007 |
| [39] |
Lee MK, et al. Descending necrotizing Mediastinitis caused by Koc-uria rosea: a case report[J]. BMC infect Dis, 2013, 1: 475. |
| [40] |
Xin H, Guo Z, Fan L, et al. Diversity and antimicrobial activities of actinomycetes from pesticide-contaminated spots in Shandong Peninsula[J]. Acta Microbiologica Sinica, 2012(4): 435-441. |